Óxido nitroso – Wikipédia, a enciclopédia livre
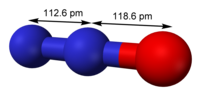
O óxido nitroso, protóxido de nitrogênio (português brasileiro) ou protóxido de azoto (português europeu), também conhecido como gás hilariante, é apresentado na forma de um gás incolor, composto de duas partes de nitrogênio e uma de oxigênio, cuja fórmula química é N2O. É um composto químico que age como agente anestésico fraco em forma de gás respiratório inorgânico e inodoro que tem efeitos analgésicos significativos e baixa solubilidade no sangue. O N2O causa modestos aumentos da frequência respiratória e quando administrado isoladamente pode aumentar de forma expressiva o fluxo sanguíneo cerebral e a pressão intracraniana.[1][2] Sendo o terceiro gás de efeito estufa de longa duração mais importante, o óxido nitroso contribui substancialmente para o aquecimento global e é uma substância que esgota substancialmente o ozônio estratosférico.[3]
Foi descoberto em 1772 pelo clérigo inglês Joseph Priestley e utilizado, juntamente com outros gases inalatórios, na tentativa de cura de doenças que variam desde a tuberculose até moléstias gástricas. Entretanto, só em 1777 que Priestley se deu conta de estar trabalhando com um novo tipo de gás, o qual chamou de "ar nitroso desflogisticado".[2]
Ciclo do azoto/nitrogênio
[editar | editar código-fonte]A maior parte do ar atmosférico é constituída por moléculas de nitrogênio, muito estáveis. O processo de decomposição destas moléculas e síntese de moléculas que permitem aproveitar o nitrogênio como nutriente é altamente endoenergético e não é realizado por animais e plantas, o que explica casos de desnutrição por falta de nitrogênio. Só algumas poucas bactérias especializadas do solo e aquáticas são capazes de retirar o nitrogênio do ar. Todas as plantas retiram seu nitrogênio dessas espécies de bactérias simbióticas; todos os animais, inclusive o homem, retiram seu nitrogênio das plantas.[4] Outras espécies de bactérias, as da deterioração, eventualmente devolvem o nitrogênio ao ar. Estes processos constituem o chamado ciclo do azoto ou ciclo do nitrogênio.
Nos tempos recentes, ações antrópicas têm provocado mudanças no ciclo do nitrogênio, que envolvem o óxido nitroso, mediante ajustes globais tão drásticos quanto no ciclo do carbono.[5] Em 1950, no mundo, produziam-se e aplicavam-se anualmente cerca de 3 milhões de toneladas de fertilizantes artificiais de nitrogênio. Hoje, esse total passa de 50 milhões de toneladas. Este e outros progressos da agricultura estão alterando o ciclo do nitrogênio de formas que a ciência ainda não compreende plenamente. Por outro lado, a queima de combustíveis fósseis não produz apenas monóxido de carbono e dióxido de carbono, mas também compostos de nitrogênio e oxigênio. O óxido nítrico (NO) tem um átomo de nitrogênio e um de oxigênio; o oxido nitroso (N2O) tem dois átomos de nitrogênio e um de oxigênio, sendo que este segundo provoca efeito estufa. Uma molécula deste gás equivale ao potencial de efeito estufa de cerca de 250 moléculas de dióxido de carbono e também permanece mais tempo no ar, em média 125 anos. A concentração de N2O na atmosfera tem aumentado na taxa de 0,25 % ao ano, sendo os solos tropicais considerados os maiores responsáveis pela emissão de N2O em ecossistemas terrestres naturais. As florestas tropicais têm maior abundância relativa de nitrogênio em comparação a outros biomas.
Processos de formação de N2O
[editar | editar código-fonte]A desnitrificação e nitrificação são processos biogênicos que produzem N2O e NO. Estes gases são importantes para a química da atmosfera. O N2O contribui para o aquecimento global e para destruição do ozônio na estratosfera.[6][7] O NO afeta regionalmente a química do ozônio na troposfera. A desnitrificação é um processo heterotrófico pelo qual muitos gêneros de bactérias (principalmente Pseudomonas) utilizam o carbono orgânico como fonte redutora e, na ausência do O2, utilizam os óxidos de nitrogênio como aceptores de elétrons – resultando na produção de N2O,NO e N2(Davidson,1991). A nitrificação é um processo de oxidação biológica das formas redutíveis de nitrogênio (NH4+) resultando em NO2- e NO3-. As bactérias nitrificantes podem obter energia desta oxidação (família Nitribacteriaceae) ou utilizá-la como produto secundário de nitrificação heterotrófica.
A Quimiodesnitrificação é um processo abiogênico de autodecomposição do HNO2, e da reação deste com grupos fenólicos da matéria orgânica do solo, resultando na produção de NO e N2O. A ocorrência de quimiodesnitrificação é significativamente maior quando o pH do solo é menor que 5. O controle da produção de N2O por microrganismos desnitrificadores no solo é determinado pelo suprimento de nitrato, CO de fácil assimilação e status de O2 no solo. Os microrganismos desnitrificadores utilizam o N na forma de nitrato como aceptor final de elétrons sob condições anaeróbias. A conversão de florestas em pastagens aumenta a disponibilidade imediata de N no solo graças à rápida mineralização provocada pelo fogo, por ocasião da queima da biomassa vegetal derrubada, embora parte do N seja perdido sob formas gasosas durante a queima. Aparentemente, pastagens novas liberam quantidades significativas de N2O, dependendo do referido aumento na disponibilidade de N para os microrganismos desnitrificadores. Com o passar dos anos de exploração dessas pastagens, há redução acentuada na disponibilidade de N no solo, conforme as perdas excessivas por lixiviação, que ocorrem graças à quantidade de N disponível no solo superar a demanda das plantas forrageiras. Como conseqüência, os fluxos de N2O também decrescem com o tempo de exploração da pastagem.
Aplicações
[editar | editar código-fonte]Sendo um agente inalatório,[8] o Óxido Nitroso tem sua maior aplicação na área médica e na odontologia. Administrado juntamente com o Oxigênio, possui efeito analgésico e sedativo.[9] Em anestesia geral, a adição de Óxido Nitroso ao Oxigênio permite uma redução da quantidade do agente anestésico mais caro, obtendo-se o mesmo efeito. Para fins industriais é utilizado principalmente na fabricação de chantilly e em automóveis.
Uso automobilístico
[editar | editar código-fonte]O óxido nitroso (ou Nitro) pode ser utilizado em motores de combustão interna com o objetivo de se obter um aumento de potência. É popularmente conhecido no meio automobilístico como nitro. Da mesma forma que turboalimentação, a injeção de óxido nitroso nas câmaras de combustão tem como objetivo elevar a massa de oxigênio injetada. Neste caso, o óxido nitroso diminui o aquecimento da câmara de combustão, fazendo com que uma quantidade maior de mistura ar-combustível seja injetada na mesma. Isto permite queimar maior quantidade de combustível numa mesma câmara de combustão.
Existem três mecanismos físicos/químicos através dos quais a injeção de óxido nitroso permite elevar a potência de motores. O principal efeito ocorre em conseqüência do aumento da massa de comburente para a queima, permitindo maior injeção de combustível, já que a potência do motor está relacionada com a quantidade de calor gerada na reação de combustão. Paralelamente, a injeção deste gás a baixas temperaturas reduz a densidade total da mistura, também ocasionado maior fluxo de massa de ar. Por fim, esta baixa temperatura auxilia a refrigeração da máquina, que pode operar a maior potência sem elevação de temperatura. O resfriamento do óxido nitroso se explica pela teoria geral dos gases. No instante em que o óxido nitroso sai do cilindro, expelido pelo fogger, passando de um meio de alta pressão (cilindro) para um de baixa pressão (em geral próxima à atmosférica), o gás sofre uma rápida expansão. Isto faz com que a substância se resfrie significativamente. Como o gás é expelido, em geral, no sistema de admissão do veículo, tal sistema torna-se extremamente frio. Isto por si, como explicado acima, faz com que o ar em admissão se adense. Numa segunda etapa, a mistura de ar + nitrox + combustível entra nos cilindros do motor. Como os cilindros trabalham em alta temperatura e pressão (em geral acima de 400°C e acima de 100 bar), a molécula de N2O, num processo químico, se dissocia em moléculas de N2 (nitrogênio) e O2 (oxigênio). O oxigênio dissociado do óxido nitroso soma-se ao oxigênio admitido no ar, formando a massa total de comburente que será utilizada para a queima. Combustível adicional já está presente nos cilindros, uma vez que o fogger já tem a função de injetar mais combustível, juntamente com o óxido nitroso, na proporção correta do acréscimo de comburente+combustível. Esta é a forma principal de ganho de potência proporcionada pelo nitro, que gera cerca de 70 a 80% do acréscimo de potência gerado.
O nitrogênio resultante da dissociação do óxido nitroso permanece inerte no cilindro durante a queima, porém reduzindo muito significativamente a temperatura interna dos cilindros, o que permite ao mesmo tempo maior segurança e melhores possibilidades para o acréscimo de potência. Isto porque ocorre grande aumento de massa admitida e da queima, gerando maiores pressão e temperatura interna dos cilindros, o que exigiria maiores alterações na estrutura do motor e do acerto, no sentido de conter o aumento de temperatura e a compressão interna do motor - e o nitrogênio compensa isso ao resfriar os cilindros. O nitrogênio, resfriando os cilindros, atua como um agente regulador, complementando acréscimo de potência. Existem outros sistemas de injeção de gases diversos na admissão de veículos. Mas as vantagens do N2O sobre outros sistemas de injeção de gases são enormes. Por exemplo, nos sistemas de injeção de CO2, ocorrem apenas os ganhos proporcionados pela primeira e pela terceira etapas. Em relação à injeção de O2, oxigênio puro, existem 2 problemas principais deste sistema: o primeiro, porque o oxigênio puro aquece enormemente as câmaras de combustão, já que não existe agente regulador de temperatura (nitrogênio) e, o segundo, porque é extremamente perigoso transportar oxigênio puro. O óxido nitroso, apesar de fornecer comburente (oxigênio), não é um comburente por si, e só o faz uma vez dentro das câmaras de combustão. Portanto, ele é inerte em condições de temperatura e pressão ambientes. Em caso de vazamento ou acidente com o cilindro, mangueiras, ou mesmo falha do fogger, os sistemas de injeção de óxido nitroso não oferecem qualquer risco. O aumento de potência pode mais do que dobrar a potência original, dependendo do motor e da regulagem do nitro. Como medida de segurança para carros originais, aconselha-se a utilizar apenas 40% a mais de potência (em relação a potência original do carro), o que ajuda a preservar a durabilidade e a vida útil do motor, câmbio, embreagem e demais partes mecânicas.
Ocorrência
[editar | editar código-fonte]
O óxido nitroso é emitido por bactérias no solo e oceanos, e é, portanto, uma parte da atmosfera da Terra. A agricultura é a principal fonte de óxido nitroso produzido pelo homem: cultivar o solo, o uso de fertilizantes nitrogenados, e tratamento de resíduos animais podem estimular naturalmente bactérias a produzirem mais óxido nitroso. O setor pecuário (principalmente vacas, galinhas e porcos) produzem 65% de óxido nitroso humano relacionado.[10] Fontes industriais representam apenas cerca de 20% de todas as fontes antropogênicas, e incluem a produção de náilon, e a queima de combustíveis fósseis em motores de combustão interna. Acredita-se que a atividade humana dê conta de 30%; solos tropicais e oceânicos contam uma liberação de cerca de 70%.[11]
O óxido nitroso reage com o ozônio na estratosfera. O óxido nitroso é o principal regulador natural do ozônio estratosférico. O óxido nitroso é um dos principais gases do efeito estufa. Considerando durante um período de 100 anos, tem 298[12] vezes mais impacto por unidade de peso do que o dióxido de carbono. Assim, apesar de sua baixa concentração, o óxido nitroso é o quarto maior contribuinte para estes gases do efeito estufa. Ele fica atrás de vapor de água, dióxido de carbono e metano. Controle do óxido nitroso é parte dos esforços para reduzir as emissões de gases de efeito estufa.[13]
Referências
- ↑ L. Brunton, Laurence; Chabner, Bruce A.; C. Knollmann, Björn. As Bases Farmacológicas da Terapêutica de Goodman e Gilman 12ª edi. Porto Alegre, RS: McGraw Hill, 2012. pp. 547. ISBN 9788580551167
- ↑ a b Sociedade Brasileira de Dermatologia. Tratado de Cirurgia Dermatológica, Cosmiatria e Laser da SBD Elsevier Brasil, 2013. ISBN 8535265430
- ↑ Thompson, R.L., Lassaletta, L., Patra, P.K. et al. Acceleration of global N2O emissions seen from two decades of atmospheric inversion. Nat. Clim. Chang. (2019) doi:10.1038/s41558-019-0613-7
- ↑ Machado Leão, Regina. A floresta e o homem. EdUSP, 2000. pp. 36. ISBN 8531405432
- ↑ Thompson, R. L.; Lassaletta, L.; Patra, P. K.; Wilson, C.; Wells, K. C.; Gressent, A.; Koffi, E. N.; Chipperfield, M. P.; Winiwarter, W. (18 de novembro de 2019). «Acceleration of global N 2 O emissions seen from two decades of atmospheric inversion». Nature Climate Change (em inglês). 9 (12): 993–998. ISSN 1758-6798. doi:10.1038/s41558-019-0613-7
- ↑ Castro, Peter; E. Huber, Michael. Biologia Marinha - 8ª edi.. Porto Alegre, RS: McGraw Hill, 2012. pp. 239. ISBN 858055103X
- ↑ de Ávila Ribeiro, Anexandra. Mudança do clima 1995: a ciência da mudança do clima. [col: Intergovernmental Panel on Climate Change] Ministério da Ciência e Tecnologia, 2000. pp. 22-26.
- ↑ C. Sabiston Jr, David; David C. Sabiston Jr, R. Daniel Beauchamp, Mary Courtney Townsend, R. Daniel Beauchamp. Sabiston - Tratado de Cirurgia, 2v.. Elsevier Brasil, 2005. pp. 402. ISBN 8535215816
- ↑ Turner, Sally (30 de agosto de 2024). «Nitrous-Oxide: What is it good for?». Drug Science (em inglês). Consultado em 3 de outubro de 2024
- ↑ Steinfeld, H.; Gerber, P.; Wassenaar, T.; Castel, V.; Rosales, M. and de Haan, C. (2006). "Livestock's long shadow – Environmental issues and options". Fao.org. Página visitada em 13 de abril de 2014.
- ↑ "Sources and Emissions – Where Does Nitrous Oxide Come From?". U.S. Environmental Protection Agency. 2006. Página visitada em 13 de abril de 2014.
- ↑ "Overview of Greenhouse Gases – Nitrous Oxide". (PDF) US EPA. Página 164 (document header listing). Página visitada em 13 de abril de 2014.
- ↑ "4.1.1 Sources of Greenhouse Gases" Arquivado em 4 de março de 2016, no Wayback Machine.. IPCC TAR WG1 2001. Página visitada em 13 de abril de 2014.


 French
French Deutsch
Deutsch