Isoelectrónicos – Wikipédia, a enciclopédia livre
Duas ou mais entidades moleculares (átomos, moléculas, íons) (cátions e anions) são descritos como sendo isoeletrónicos entre si se tem o mesmo número de elétrons[1] ou a mesma configuração eletrónica[2] e a mesma estrutura (número e conectividade de átomos), independentemente da natureza dos elementos envolvidos.
O termo valência isoeletrónica la paira en hilo
é usado quando as condições acima forem satisfeitas, mas apenas com o mesmo número de elétrons de valência.[3]
A declaração "esses compostos ou moléculas são isoeletrônicos" não é apenas uma implemetação da definição acima. Ela tem importância pelo fato de que os cálculos sobre moléculas e densidade de elétrons e, portanto, a capacidade de reação, foram realizadas em um volume significativo de substâncias comuns. Ao identificar-se um novo composto, raro ou estranho como sendo isoeletrônico com um já conhecido, oferecem-se pistas para possíveis propriedades e reações.
Exemplos
[editar | editar código-fonte]O átomo N e o íon radical O+ são isoeletrônicos porque cada um tem 5 elétrons na camada eletrônica exterior. Da mesma forma, os cátions K+, Ca2+, e Sc3+, os ânions Cl−, S2−, e P3− são todos isoeletrônicos com o átomo Ar. Em tais casos monoatômicos, há uma tendência clara nos tamanhos dessas espécies, com raio atômico diminuindo à medida que a carga aumenta.
CO, N2 e NO+ são isoeletrônicos porque cada um tem 2 núcleos e 10 elétrons de valência - 4+6, 5+5, e 5+5, respectivamente. Talvez seja mais preciso pensar na molécula de dióxido de carbono, como C-O+, considerando a sua coordenação, o que lhe confere uma distribuição 5+5 de elétrons como os outros.
- Etenona
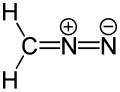
- Diazometano
A molécula desprovida de carga H2C=C=O (etenona) e a molécula zwitterionica CH2=N+=N- (diazometano) são isoelétricas.
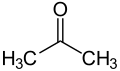
- Propanona
- Um dos isômetros do dimetildiazeno
CH3COCH3 (propanona) e CH3N2CH3 (dimetildiazeno) são não isoelétricos. Eles têm o mesmo número de núcleos e o mesmo número de elétrons de valência, mas a conectividade dos átomos é diferente: o primeiro tem tanto grupos metil (CH3) ligados ao átomo de carbono de carbonilo (CO), formando um estrutura planar trigonal: H3C-C(=O)-CH3; a estrutura da segunda molécula é linear: H3C-N=N-CH3 e seus grupos metil não estão ligados ao mesmo átomo de nitrogênio.
- Cisteína
- Serina
Os aminoácidos cisteína e serina também são considerados isoelétricos (ao menos em valência).
Referências
- ↑ «Isoelectronic Configurations iun.edu»
- ↑ «Isoelectronic thefreedictionary.com»
- ↑ Advances in Organonmetallic chemistry. F.G.A. Stone page 190 google books link


 French
French Deutsch
Deutsch