Química organometálica – Wikipédia, a enciclopédia livre

Química organometálica é o estudo de compostos químicos contendo ao menos uma ligação química entre um átomo de carbono de um composto orgânico e um metal, incluindo os alcalinos, alcalinos terrosos, metais de transição, e outros casos, de onde são ditos compostos organometálicos.[1]
Eventualmente, pode-se fazer confusão entre compostos organometálicos e complexos metálicos ou compostos de coordenação, uma vez que nestes últimos, íons metálicos apresentam-se coordenados com moléculas que contém átomos de carbono.
Apesar da maioria dos compostos organometálicos possuírem metais de transição como centros metálicos, existem exemplos importantes dentre estes compostos com metais representativos. São exemplo disso os compostos de Grignard, que possuem íons Mg(II) (magnésio) como centro metálico de um composto organometálico.
Além disso, alguns compostos relacionados, tais como hidretos de metais de transição e complexos de fosfina metálica são frequentemente incluídos nas discussões sobre compostos organometálicos. O campo da química organometálica combina aspectos da química inorgânica e química orgânica tradicional.[2]
Compostos organometálicos são largamente usados tanto estequiometricamente em pesquisa e reações químicas industriais, bem como no papel de importantes catalisadores para aumentar as taxas de tais reações (e.g., como em usos de catálise homogênea), onde moléculas alvo incluem polímeros, fármacos e muitos outros tipos de produtos práticos. Por exemplo, um complexo de ródio(I) pode levar a adição de hidrogênio à moléculas orgânicas insaturadas por meio de um mecanismo em que se forma uma ligação organometálica. Esse catalisador é o [RhCl(PPh3)3], onde PPh3 refere-se ao ligante trifenilfosfina (Ph = phenyl, em inglês) com um átomo de fósforo ligado a três grupos fenila (C6H]]5-).[3]
Compostos organometálicos
[editar | editar código-fonte]Compostos organometálicos são distinguidos pelo prefixo "organo-", e.g. compostos organopaládio. Exemplos de tais compostos organometálicos incluem reagentes de Gilman, os quais contém lítio e cobre. Níquel tetracarbonilo e ferroceno são exemplo de compostos organometálicos contendo metais de transição. Outros exemplos incluem compostos organomagnésio como iodo(metil)magnésio MeMgI, dimetilmagnésio (Me2Mg) e todos os reagentes de Grignard; compostos organolítio tais como n-butil lítio (n-BuLi), compostos organozinco tais como dietilzinco (Et2Zn) e cloro(etoxicarbonilmetil)zinco (ClZnCH2C(=O)OEt); e compostos organocobre tais como dimetilcuprato de lítio (Li+[CuMe2]−).
O termo "organometálico" geralmente refere-se a compostos contendo metais que não possuem ligações diretas de metal-carbono, mas que contêm ligandos orgânicos.[4] Metal beta-dicetonatos, alcóxidos e dialquilamidas são membros representativos desta classe.
Em adição aos metais tradicionais, lantanídeos, actinídeos e semimetais, elementos tais como boro, silício, arsênico e selênio são considerados como formando compostos organometálicos, e.g. compostos organoboranos tais como trietilborano (Et3B).
- Compostos Organometálicos Representativos
- Ferroceno é um composto organoferro arquetípico. É um composto sublimável estável ao ar.
- Cobaltoceno é um análogo estrutural do ferroceno, mas é altamente reativo em relação ao ar.
- Hidreto de carbonilo tris(trifenilfosfina)ródio é usado na produção comercial de muitas fragrâncias baseadas em aldeídos.
- Sal de Zeise é um exemplo de um complexo de alceno metal de transição.
- Trimetilalumínio é um compostos organometálico com um grupo metilo em ponte. É utilizado na produção industrial de alguns álcoois.
- Dimetilzinco tem uma coordenação linear. É um líquido pirofórico volátil que é usado na preparação de filmes semicondutores.
Nomenclatura
[editar | editar código-fonte]A recomendação da IUPAC para a escrita da fórmula de um organometálico é a mesma que para um complexo: o símbolo do metal primeiramente, seguidos dos ligantes aniônicos, em ordem alfabética. Por fim os ligantes neutros são então indicados em ordem alfabética dos seus símbolos químicos. Porém em muitas revistas e artigos científicos é comum encontrar o nome do metal no meio da escrita sem a indicação do seu número de oxidação, por exemplo o Benzeno(tricarbonil)molibdênio(0) as vezes é chamado de Benzenomolibdêniotricarbonil.[5]
É comum que um ligante com carbonos doadores possa apresentar mais de um modo de ligação ao metal, necessitando assim de uma indicação adicional. A chamada notação da hapticidade, η (eta), é o número de átomos do ligante que efetivamente estão ligados ao átomo metálico. Por exemplo, um grupo CH3 ligado como M--C é mono-hapto, η1, e se são dois átomos de carbonos ligados ao metal, o ligante é di-hapto, η2.[5]
Compostos de coordenação com ligandos orgânicos
[editar | editar código-fonte]Muitos complexos exibem ligações covalentes entre um metal e ligandos orgânicos. Os ligandos orgânicos ligam-se frequentemente ao metal através de um heteroátomo tais como oxigênio ou nitrogênio, caso em que tais compostos são considerados compostos de coordenação. No entanto, se algum dos ligandos formar uma ligação direta M-C, então o complexo é usualmente considerado ser organometálico, e.g., [(C6H6)Ru(H2O)3]2+. Além disso, muitos compostos lipofílicos como acetilacetonatos e alcóxidos metálicos são chamados "metalorgânicos".
Um naturalmente ocorrente complexo de alquil metal de transição é metilcobalamina (uma forma de Vitamina B12), com uma ligação cobalto-metil. Este subconjunto de complexos é frequentemente discutido dentro do subcampo da química bio-organometálica.[6] Ilustrativo das muitas funções das enzimas B12-dependentes, a enzima MTR catalisa a transferência de um grupo metil de um nitrogênio em N5-metil-tetraidrofolato ao enxofre de homocisteína para produzir metionina .
O estado dos compostos em que o ânion canônico possui uma estrutura deslocalizada em que a carga negativa é compartilhada com um átomo mais eletronegativo que o carbono, como em enolatos, pode variar com a natureza da fração aniônica, o íon metálico e possivelmente o meio; na ausência de evidência estrutural direta para uma ligação carbono–metal, tais compostos não são considerados como sendo organometálicos.
Estrutura e propriedades
[editar | editar código-fonte]A ligação metal-carbono em compostos organometálicos é geralmente altamente covalente. Para elementos altamente eletropositivos, tal como lítio e sódio, o carbono ligando exibe caráter carbaniônico, mas os ânions livres baseados em carbono são extremamente raros, sendo cianeto um exemplo.
Conceitos e técnicas
[editar | editar código-fonte]Como em outras áreas da química, contagem de elétrons é útil para organizar a química organometálica. A regra dos 18 elétrons é útil para prever as estabilidades de carbonilos metálicos e compostos relacionados. A maioria dos compostos organometálicos, porém, não segue a regra dos 18 elétrons. Ligação química e reatividade em compostos organometálicos são frequentemente discutidas a partir da perspectiva do princípio isolobal.
Assim como difração de raio X, espectroscopia NMR e em infravermelho são técnicas comuns para determinar estruturas. As propriedades dinâmicas de compostos organometálicos são frequentemente sondadas com NMR de temperatura variável e cinética química.
Compostos organometálicos sofrem várias reações importantes:
- Adição oxidativa e eliminação redutiva
- transmetalação
- carbometalação
- hidrometalação
- transferência de elétrons
- beta-hidreto eliminação
- reação de substituição organometálica
- Ativação da ligação carbono-hidrogênio
- ciclometalação
- inserção migratória
- abstração nucleofílica
História
[editar | editar código-fonte]Os primeiros desenvolvimentos em química organometálica incluem a síntese de Louis Claude Cadet dos compostos metil arsênico relacionados ao cacodilo, em 1827 o complexo platina-etileno (complexo de eteno com platina II) de William Christopher Zeise,[7][8] em 1868 por P. Schützenberger (primeiras carbonilas metálicas), a descoberta de Edward Frankland do dimetilzinco, a descoberta em 1890 por Ludwig Mond do Ni(CO)4,[1] seguido por C. Langer e F. Quinke com outras carbonilas metálicas,[9][10][11] campo que se tornou mais interessante após uma grande variedade de compostos, muitos deles aniônicos, sintetizados por W. Hieber, e os compostos organomagnésio de Victor Grignard. Os produtos abundantes e diversos do carvão e do petróleo levaram à catálises de Ziegler-Natta, Fischer-Tropsch, hidroformilação as quais empregam CO, H2, e alquenos como matérias-primas e ligandos. Porém foi necessário a espera de avanços na tecnologia (difração de raio x e espectroscopia no infravermelho e de RMN) para mais informações das estruturas em amostras sólidas e em soluções.[5]
A partir da década de 1950 esta área cresceu muito com novos tipos de reações, estruturas incomuns e aplicações em síntese orgânica e catálise industrial.[5]
Algumas características como a estabilidade, estrutura e a ligação do composto ferroceno, Fe(C5H5)2 (sintetizado em 1951) não se encaixava na descrição de Lewis e a partir daí levou a um rápido desenvolvimento da química organometálica do bloco d após um movimento de síntese, caracterização e abordagens teóricas pelos pesquisadores. Destacaram-se nessa área Ernst Fischer (Alemanha) e Geoffrey Wilkinson (Londres), ganhadores do prêmio Nobel em 1973 pelas suas contribuições. Assim como os do bloco d, a química dos organometálicos do bloco f se desenvolveu de forma similar após a década de 1970.[5]
Em 2005, Yves Chauvin, Robert H. Grubbs e Richard R. Schrock dividiram o Prêmio Nobel pela metátese de olefina catalisada por metal.[12]
Linha do tempo da química organometálica
[editar | editar código-fonte]- 1760 Louis Claude Cadet de Gassicourt pesquisa tintas com base em sais de cobalto e isola cacodilo de mineral de cobalto contendo arsênico.
- 1827 William Christopher Zeise produz sal de Zeise; o primeiro complexo platina / olefina.
- 1848 Edward Frankland descobre o dietilzinco.
- 1863 Charles Friedel e James Crafts preparam organoclorosilanos.
- 1890 Ludwig Mond descobre o níquel carbonilo.
- 1899 Introdução da reação de Grignard.
- 1899 John Ulric Nef descobre a alquinilação usando acetiletos de sódio.
- 1900 Paul Sabatier trabalha em hidrogenação de compostos orgânicos com catalisadores metálicos. Hidrogenação de gorduras inicia avanços na indústria de alimentos, ver margarina.
- 1909 Paul Ehrlich introduz Salvarsan para o tratamento de sífilis, um composto organometálico baseado em arsênico primordial.
- 1912 Prêmio Nobel Victor Grignard e Paul Sabatier.
- 1930 Henry Gilman trabalha em cupratos de lítio, ver reagente de Gilman.
- 1951 Walter Hieber foi agraciado com o prêmio Alfred Stock por seu trabalho com a química de carbonilos metálicos.
- 1951 O ferroceno é descoberto.
- 1963 Prêmio Nobel para Karl Ziegler e Giulio Natta em catalisador Ziegler-Natta.
- 1965 Descoberta do ciclobutadienoferro tricarbonilo.
- 1968 Reação de Heck.
- 1973 Prêmio Nobel para Geoffrey Wilkinson e Ernst Otto Fischer pelo desenvolvimento dos compostos sanduíche.
- 1981 Prêmio Nobel para Roald Hoffmann e Kenichi Fukui pela criação das regras de Woodward-Hoffman.
- 2001 Prêmio Nobel para W. S. Knowles, R. Noyori e Karl Barry Sharpless pelas pesquisas em hidrogenação assimétrica.
- 2005 Prêmio Nobel para Yves Chauvin, Robert Grubbs, e Richard Schrock sobre metátese de alqueno catalisado por metal
- 2010 Prêmio Nobel para Richard F. Heck, Ei-ichi Negishi e Akira Suzuki pelas reações de acoplamento cruzado catalisado com paládio.
Escopo
[editar | editar código-fonte]Áreas de subespecialidade da química organometálica incluem:
- Elementos do período 2: química organolítio, química organoberílio, química organoborano
- Elementos do período 3: química organomagnésio, química organoalumínio, química organosilício
- Elementos do período 4: química organotitânio, química organocromo, química organomanganês química organoferro, química organocobalto, química organoníquel, química organocobre, química de organozinco, química de organogálio, química de organogermânio
- Elementos do período 5: química de organorutênio, química de organopaládio, química de organoprata, química de organocádmio, química de organoíndio, química de organoestanho
- Elementos do período 6: química de organolantanídeo, química de organo-ósmio, química de organoirídio, química de organoplatina, química de organo-ouro, química de organomercúrio, química de organotálio, química de organochumbo
- Elementos do período 7: química de organourânio
Aplicações industriais
[editar | editar código-fonte]Compostos organometálicos encontram amplo uso em reações comerciais, tanto em catálise homogênea e como reagentes estequiométricos Por exemplo, compostos organolítio, organomagnésio e organoalumínio, exemplos dos quais são altamente básicos e altamente redutores, são úteis estequiometricamente, mas também catalisam muitas reações de polimerização.[2]
Quase todos os processos envolvendo monóxido de carbono dependem de catalisadores, notáveis exemplos sendo descritos como carbonilações.[13] A produção de ácido acético a partir do metanol e monóxido de carbono é catalisada via complexos de carbonilos metálicos no processo Monsanto e processo Cativa. A maioria dos aldeídos sintéticos são produzidos via hidroformilação. A maior parte dos álcoois sintéticos, pelo menos aqueles maiores do que etanol, são produzidos por hidrogenação de aldeídos derivados de hidroformilação. Similarmente, o processo Wacker é usado na oxidação de etileno a acetaldeído.[14]
Quase todos os processos industriais envolvendo polímeros derivados de alquenos baseiam-se em catalisadores organometálicos. Mundialmente polietileno e polipropileno são produzidos tanto via catálise heterogênea como via catálise Ziegler-Natta e homogeneamente, e.g., via complexos de geometria restrita.[15]
A maioria dos processos envolvendo hidrogênio dependem de catalisadores baseados em metal, enquanto aplicações de hidrogenações em escala, e.g. produção de margarina, se baseiam em catalisadores heterogêneos. Para a produção de produtos químicos finos, tais hidrogenações baseiam-se em complexos organometálicos solúveis ou envolvem intermediários organometálicos.[16] Complexos organometálicos permitem essas hidrogenações serem efetuadas assimetricamente.

Muitos semicondutores são produzidos a partir de compostos trimetilgálio, trimet-índio, trimetil-alumínio e trimetil-antimônio. Estes compostos voláteis são decompostos juntamente com amônia, arsina, fosfina e hidretos relacionados em um substrato aquecido via deposição de vapor mediante processos químicos organometálicos (MOVPE, metalorganic vapor phase epitaxy) na produção de diodos emissores de luz (LEDs).
Riscos ao meio ambiente
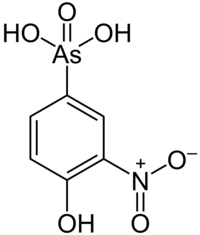
[editar | editar código-fonte]Os compostos organometálicos naturais e contaminantes são encontrados no ambiente. Alguns são remanescentes de uso humano, como compostos organochumbo e organomercúrio, apresentam perigos de toxicidade. Tetraetilchumbo foi produzido para uso como um aditivo para gasolina mas caiu em desuso por causa da toxicidade do chumbo. Seus substituintes são outros compostos organometálicos, tais como ferroceno e metilciclopentadienil tricarbonilo de manganêsl (MMT).[17] O composto organoarsênico roxarsona é um aditivo de alimentos para animais controverso. Em 2006, aproximadamente um milhão de quilogramas dele foram produzidos apenas nos EUA.[18]
Referências
- ↑ a b Crabtree, Robert H. (2009). The Organometallic Chemistry of the Transition Metals 5th ed. New York, NY: John Wiley and Sons. pp. 2, 560, and passim. ISBN 0470257628. Consultado em 23 de maio de 2016
- ↑ a b Oliveira, José; Elschenbroich, Christoph (2006). Organometallics 3., completely rev. and extended ed. Weinheim: Wiley-VCH-Verl. ISBN 978-3-527-29390-2
- ↑ MAHAN, Bruce M.; MAYERS, Rollie J.. Química: Um Curso Universitário. São Paulo: Edgard Blücher, 1978. Tradutores Koiti Araki, Denise de Oliveira Silva, Flávio Massao Matsumoto.
- ↑ D. F. Shriver, P. W. Atkins and C. H. Langford, "Inorganic Chemistry", 2nd ed., p. 412-452.
- ↑ a b c d e SHRIVER, Duward F.; ATKINS, Peter W. Química Inorgânica. 4. ed. Porto Alegre: Bookman, 2008.
- ↑ Berg, Jeremy M.; Lippard, Stephen J. (1994). Principles of bioinorganic chemistry [Pbk. ed.]. ed. Mill Valley: University Science Books. ISBN 0-935702-73-3
- ↑ Hunt, L. B. (1984). «The First Organometallic Compounds: William Christopher Zeise and his Platinum Complexes» (PDF). Platinum Metals Rev. 28 (2): 76–83
- ↑ Zeise, W. C. (1831). «Von der Wirkung zwischen Platinchlorid und Alkohol, und von den dabei entstehenden neuen Substanzen». Annalen der Physik. 97 (4): 497–541. Bibcode:1831AnP....97..497Z. doi:10.1002/andp.18310970402
- ↑ R. Bruce King; Transition-Metal Organometallic Chemistry: An Introduction; Elsevier, 2012. pg 3
- ↑ Florian P. Pruchnik; Organometallic Chemistry of the Transition Elements; Springer Science & Business Media, 2013. pg 23
- ↑ Robert H. Crabtree; The Organometallic Chemistry of the Transition Metals; John Wiley & Sons, 2014. pg 176
- ↑ Dragutan, V.; Dragutan, I.; Balaban, A. T. (2006). «2005 Nobel Prize in Chemistry». Platinum Metals Review. 50 (1): 35–37. ISSN 0032-1400. doi:10.1595/147106706X94140

- ↑ Paul N. Rylander, "Hydrogenation and Dehydrogenation" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a13 487
- ↑ Leeuwen, Piet W.N.M. van (2004). Homogeneous catalysis : understanding the art. Dordrecht: Springer. ISBN 978-1-4020-3176-2
- ↑ Klosin, Jerzy; Fontaine, Philip P.; Figueroa, Ruth (2015). «Development of Group IV Molecular Catalysts for High Temperature Ethylene-α-Olefin Copolymerization Reactions». Accounts of Chemical Research. 48 (7): 2004–2016. ISSN 0001-4842. doi:10.1021/acs.accounts.5b00065
- ↑ Paul N. Rylander, "Hydrogenation and Dehydrogenation" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:487 10.1002/14356007.a13 487
- ↑ Seyferth, D. (2003). «The Rise and Fall of Tetraethyllead. 2». Organometallics. 22 (25): 5154–5178. doi:10.1021/om030621b
- ↑ Hileman, B. (9 de abril de 2007). «Arsenic in Chicken Production». Chemical and Engineering News. pp. 34–35
Leitura adicional
[editar | editar código-fonte]- Clayden, Jonathan ; Greeves, Nick & Warren, Stuart (2012). Organic Chemistry 2nd ed. Oxford, UK: Oxford University Press. pp. 132f 182–196, 218ff. 444f, 509f, 656–693 passim, 858, 1009, 1069–1101, 1107–1131 passim. ISBN 0199270295. Consultado em 2 de fevereiro de 2016
- Crabtree, Robert H. (2009). The Organometallic Chemistry of the Transition Metals 5th ed. New York, NY: John Wiley and Sons. ISBN 0470257628. Consultado em 23 de maio de 2016
- Elschenbroich, Christoph (2016). Organometallics 3rd ed. New York, NY: John Wiley and Sons. ISBN 3527805141. Consultado em 23 de maio de 2016
- Jenkins, Paul R. (1992). Organometallic Reagents in Synthesis. Col: Oxford Chemistry Primers, No. 3 5th ed. Oxford, UK: Oxford University Press. ISBN 0198556667. ISSN 1367-109X. Consultado em 23 de maio de 2016
- Pearson, Anthony J. (1985). Metallo-organic Chemistry. New York, NY: John Wiley and Sons. ISBN 0471904465. Consultado em 23 de maio de 2016


 French
French Deutsch
Deutsch




