Danio rerio – Wikipédia, a enciclopédia livre
| Danio rerio | |
|---|---|
 | |
| Fêmea adulta | |
| Classificação científica | |
| Domínio: | Eukaryota |
| Reino: | Animalia |
| Filo: | Chordata |
| Classe: | Actinopterygii |
| Ordem: | Cypriniformes |
| Família: | Cyprinidae |
| Subfamília: | Danioninae |
| Gênero: | Danio |
| Espécies: | D. rerio |
| Nome binomial | |
| Danio rerio (F. Hamilton, 1822) | |
| Sinónimos | |
| |
O peixe-zebra (Danio rerio) é um peixe tropical de água doce, teleósteo, cipriniforme, da família dos ciprinídeos. É uma espécie ovípara ornamental, muito apreciada por aquariófilos, com tempo de vida médio entre três e cinco anos. Também é conhecido pelos nomes de bandeirinha, danio-zebra, paulistinha e bandeira-paulista. É um importante organismo modelo, frequentemente utilizado na investigação científica, por exemplo em pesquisas genéticas, criação de medicamentos e análises voltadas para a biologia do desenvolvimento. [2] Sua notável capacidade de regeneração tem sido importante para a criação de muitas linhagens transgênicas.[3][4]
É nativo dos córregos da região sudeste do Himalaia,[5] incluindo Índia, Paquistão, Bangladesh, Nepal e Myanmar.[6]
Taxonomia
[editar | editar código-fonte]O peixe-zebra pertence ao gênero Danio, da família Cyprinidae. A espécie está intimamente relacionada ao gênero Devario, como demonstrado por uma árvore filogenética de espécies próximas.[7]
Por muitos anos o peixe-zebra foi citado na literatura científica como Brachydanio rerio, até sua transferência para o gênero Danio.[8]
Reprodução
[editar | editar código-fonte]O peixe zebra, em condições de biotério, costuma atingir a maturidade sexual entre 3 e 6 meses após a fertilização, podendo variar de acordo com as condições ambientais, incluindo densidade populacional, temperatura e disponibilidade de alimentos. Devido a essas possíveis variações, é mais apropriado relacionar a maturidade reprodutiva ao tamanho do que à idade. Um tamanho de aproximadamente 23mm corresponde à maturidade reprodutiva da espécie.
O Danio rerio exibe rituais de acasalamento antes e durante a desova. Durante a corte, os machos nadam em círculos com as nadadeiras levantadas, próximos ao local de desova, para que as fêmeas os vejam. No momento da desova, o macho nada em paralelo com a fêmea e envolve o seu corpo, provocando a liberação de óvulos e liberando o esperma simultaneamente. Os machos competem pelas fêmeas, estabelecendo e defendendo territórios. Os peixes parecem preferir locais com cascalho, vegetação e com águas pouco profundas para a reprodução. Em biotério, pode-se adicionar plantas de plástico aos tanques de reprodução, com a intenção de simular o ambiente natural encontrado nas margens de rios.
As fêmeas são capazes de produzir centenas de ovos a cada fecundação. Após a liberação, o desenvolvimento embrionário se inicia, sendo os ovos transparentes logo após a postura (característica importante para a utilização da espécie como modelo de pesquisa).[9]
Organismo modelo
[editar | editar código-fonte]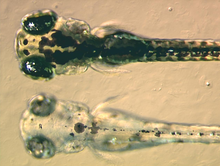
D. rerio é um organismo modelo muito utilizado em estudos genéticos e de desenvolvimento de vertebrados. O seu uso como animal de laboratório foi iniciado pelo biólogo molecular norte-americano americano George Streisinger e seus colegas da Universidade de Oregon nas décadas de 1970 e 1980. Os clones de peixe-zebra de Streisinger foram dos primeiros clones de vertebrados criados com êxito. [10]
O peixe tem um banco de dados on-line próprio, onde são depositadas informações genéticas, embriológicas, genômicas e de desenvolvimento, o ZFIN (Zebrafish Information Network). O Zebrafish International Resource Center (ZIRC) é um repositório de recursos genéticos com 29.250 alelos disponíveis para distribuição à comunidade de pesquisa.
O peixe-zebra foi também uma das poucas espécies de peixe que foram enviadas ao espaço.
Como um organismo biológico modelo, o peixe-zebra possui inúmeras características que favorecem o seu estudo em diversas áreas do conhecimento. O seu genoma foi completamente sequenciado e é amplamente estudado por apresentar muitos genes com funções semelhantes ao da espécie humana; comportamentos de desenvolvimento facilmente observáveis e testáveis. O seu desenvolvimento embrionário é muito rápido, e seu embrião é relativamente grande, transparente e com desenvolvimento externo. [11]
Outra vantagem inclui o tamanho das espécies quase constante durante o desenvolvimento precoce, o que permite o uso de técnicas de coloração simples. O peixe-zebra também é conhecidamente semelhante aos modelos de mamíferos e dos seres humanos em ensaios de toxicidade, e exibe um ciclo de sono diurno semelhante ao dos mamíferos.[12]
Zebrafish: Modelo em biologia do desenvolvimento
[editar | editar código-fonte]O Danio rerio apresenta grande similaridade anatômica com outros vertebrados durante seu estágio embrionário, sendo passível de utilização como modelo para o estudo de tópicos relacionados à biologia do desenvolvimento. Origem e morfologia de orgãos e tecidos são algumas das frentes de pesquisa abordadas, assim como o surgimento e desenvolvimento de doenças em humanos.[13][14]

A transparência do embrião, aliada a facilidade de obtenção e manutenção da espécie são fatores que explicam o rápido aumento da demanda deste organismo nas ultimas décadas, havendo ainda diversas linhagens mutantes que não desenvolvem melanócitos a medida que se maturam, mantendo assim a transparência do embrião e expandindo o tempo de visualização das estruturas de interesse.[15]
Existem bancos de dados robustos acerca da morfologia de D. rerio (FishNet) partindo do embrião, através de todas as fases do desenvolvimento até o indivíduo adulto[13] Além do genoma completo sequenciado.[14]
O surgimento e aprimoramento de métodos que fazem uso de fluorescência projetaram D. rerio para a popularidade entre os organismos modelos utilizados em biologia do desenvolvimento, permitindo a visualização detalhada em todos os níveis estruturais do embrião. A possibilidade de perturbação em pontos chave do ciclo embrionário, através de técnicas como silenciamento por RNAi ou Knockout deram abertura para o estudo do surgimento e da dinâmica celular na formação de orgãos, capacidade regenerativa e atividade neuronal.[16]
Dentre algumas contribuições de D.rerio como organismo modelo, podem ser citadas:
- Descoberta de novos genes relacionados a aspectos de doenças cardiovasculares, associados a má formação do orgão devido a defeitos em vias de sinalização atuantes na organização de cardiomiócitos.
- Elucidação do desenvolvimento vascular e desordens associadas a aspectos decorrentes da formação destes tecidos a partir de linhagens celulares mesodérmicas.
- Descoberta de aspectos associados a desordem no Rim[17]
- Estudos acerca da capacidade de regeneração do coração, retina, e sistema nervoso central (SNC)nesta espécie.[18]
Embriologia
[editar | editar código-fonte]
O embrião de peixe-zebra se desenvolve rapidamente, com precursores de todos os principais órgãos aparecendo dentro de 36 horas após a fecundação. O embrião de D. rerio e da maioria dos peixes, assim como o embrião de aves, apresenta grande quantidade de vitelo, substância responsável por garantir o aporte de alimento na fase embrionária. Após a fecundação, o embrião começa como uma gema que possui uma única e enorme célula na parte superior ou polo animal, que se divide em dois e continua dividindo até que existam milhares de pequenas células. As células, em seguida, migram para baixo e para os lados da gema e começam a formar a cabeça e cauda. A cauda cresce e, em seguida, separa-se do corpo. A gema, composta principalmente de vitelo, encolhe ao longo do tempo, pois o peixe a utiliza para se alimentar à medida que amadurece durante os primeiros dias. Depois de alguns meses, o peixe adulto atinge a maturidade reprodutiva.[19]
Formação do eixo Antero-posterior
[editar | editar código-fonte]A organização eixo Antero-posterior em peixes zebra (Danio rerio) ocorre logo nos primeiros estágios do desenvolvimento, anterior a formação da gastrula, sendo possível notar primeiramente a formação de estruturas da parte anterior do animal assim determinando sua posição. 10 horas após a fecundação já é possível identificar a estrutura como também o eixo dorsal ventral e, através de marcadores, outras regiões organizacionais, seu desenvolvimento segue um padrão similar as de anfíbios (xenopus) com a formação do centro de organização de Nieuwkoop.[20]
Este centro organizador deriva de produções genicas do zigoto, e por sua vez induzirá a formação do organizador de Spemman, esta estrutura sinaliza a formação dos eixos através da indução da diferenciação de estruturas como a notocorda.[21]
A sinalização do processo ocorre também similar aos anfíbios com beta-cateina em altas concentrações no plano nodal e estimulando a expressão de Squint e Bozozok estimulando a formação do escudo embrionário.
Referências
- ↑ Vishwanath, W. (2010). «Danio rerio». Lista Vermelha de Espécies Ameaçadas. 2010: e.T166487A6219667. doi:10.2305/IUCN.UK.2010-4.RLTS.T166487A6219667.en
 . Consultado em 19 de novembro de 2021
. Consultado em 19 de novembro de 2021 - ↑ van Wijk, Rob C.; Krekels, Elke H. J.; Hankemeier, Thomas; Spaink, Herman P.; van der Graaf, Piet H. (1 de dezembro de 2016). «Systems pharmacology of hepatic metabolism in zebrafish larvae». Science Direct. Drug Discovery Today: Disease Models 2016 ( Vol. 22, No. 2016). Computational Models of Liver Disease 2016 (em inglês): 27–34. ISSN 1740-6757. doi:10.1016/j.ddmod.2017.04.003
- ↑ «Fudan scientists turn fish into estrogen alerts». XinHua (Arq, em WayBack Machine). 12 de janeiro de 2007
- ↑ White, Richard Mark (e outros) (7 de fevereiro de 2008). «Transparent adult zebrafish as a tool for in vivo transplantation analysis» (PDF). National Center for Biotechnology Information
- ↑ Mayden, Richard L.; Tang, Kevin L.; Conway, Kevin W.; Freyhof, Jörg; Chamberlain, Sarah; Haskins, Miranda; Schneider, Leah; Sudkamp, Mitchell; Wood Robert M.; Agnew, Mary; Bufalino, Angelo; Sulaiman, Zohrah; Miya, Masaki; Saitoh, Kenji; He, Shunping (2007). «Phylogenetic relationships of Danio within the order Cypriniformes: a framework for comparative and evolutionary studies of a model species». J. Exp. Zool. (Mol. Dev. Evol.). 308B (5): 642–654. PMID 17554749. doi:10.1002/jez.b.21175
- ↑ USGS NAS - Nonindigenous Aquatic Species
- ↑ Parichy, D M (2006). "Evolution of danio pigment pattern development". Heredity 97 (3): 200–10.
- ↑ "The Zebrafish Book". ZFIN. Retrieved July 3, 2013.
- ↑ Spence, Rowena; Gerlach, Gabriele; Lawrence, Christian; Smith, Carl (2007). "The behaviour and ecology of the zebrafish, Danio rerio". Biological Reviews 83 (1): 13–34.
- ↑ «George Streisinger». web.archive.org. 29 de setembro de 2015. Consultado em 25 de julho de 2023
- ↑ Dahm, Ralf (2006). «The Zebrafish Exposed». American Scientist 94 (5): 446–453 (Arq. em WayBack Machine)
- ↑ Jones, Rachel (2007). "Let Sleeping Zebrafish Lie: A New Model for Sleep Studies". PLoS Biology 5(10): e281.
- ↑ a b Bryson-Richardson, Robert J.; Berger, Silke; Schilling, Thomas F.; Hall, Thomas E.; Cole, Nicholas J.; Gibson, Abigail J.; Sharpe, James; Currie, Peter D. (1 de janeiro de 2007). «FishNet: an online database of zebrafish anatomy». BMC Biology. 5. 34 páginas. ISSN 1741-7007. PMID 17705855. doi:10.1186/1741-7007-5-34
- ↑ a b Bier, Ethan; Mcginnis, William. «Model Organisms in the Study of Development and Disease» (em inglês): 23–40. doi:10.1093/med/9780199934522.003.0003
- ↑ Selman, Kelly; Wallace, Robin A.; Sarka, Andrew; Qi, Xiaoping (1 de novembro de 1993). «Stages of oocyte development in the zebrafish, Brachydanio rerio». Journal of Morphology (em inglês). 218 (2): 203–224. ISSN 1097-4687. doi:10.1002/jmor.1052180209
- ↑ Chow, Renee Wei-Yan; Vermot, Julien (11 de abril de 2017). «The rise of photoresponsive protein technologies applications in vivo: a spotlight on zebrafish developmental and cell biology». F1000Research. 6. PMID 28413613. doi:10.12688/f1000research.10617.1
- ↑ Paw, Barry H. «Zebrafish a genetic model for vertebrate organogenesis and human disorders». Frontiers in Bioscience. 8 (4): d1227–1253. doi:10.2741/1092
- ↑ Shi, WenChao; Fang, ZhiBing; Li, Li; Luo, LingFei (1 de abril de 2015). «Using zebrafish as the model organism to understand organ regeneration». Science China Life Sciences (em inglês). 58 (4): 343–351. ISSN 1674-7305. doi:10.1007/s11427-015-4838-z
- ↑ Gilbert, S. F., Bitondi, M. M. G., & Simoes, Z. L. P. (1994). Biologia do desenvolvimento. Sociedade Brasileira de Genética.
- ↑ Schier, Alexander F.; Talbot, William S. (1 de janeiro de 2005). «Molecular genetics of axis formation in zebrafish». Annual Review of Genetics. 39: 561–613. ISSN 0066-4197. PMID 16285872. doi:10.1146/annurev.genet.37.110801.143752
- ↑ Saúde, L.; Woolley, K.; Martin, P.; Driever, W.; Stemple, D. L. (1 de agosto de 2000). «Axis-inducing activities and cell fates of the zebrafish organizer». Development (Cambridge, England). 127 (16): 3407–3417. ISSN 0950-1991. PMID 10903167


 French
French Deutsch
Deutsch