Aromaticitate

Caracterul aromatic este un concept în chimia organică ce explică stabilitatea foarte mare a majorității structurilor ciclice. Stabilitatea acestora se datorează prezenței sistemelor electronice conjugate, a electronilor de valență liberi, sau a orbitalilor liberi, fapt ce conduce la o mai mare stabilitate față de cea așteptată prin simpla conjugare. Caracterul aromatic poate fi considerat și o consecință a delocalizării ciclice și a rezonanței.[1][2][3]
Aceasta se explică prin faptul că electronii liberi au o circulație liberă la nivelul aranjamentului de tip circular care este adoptat de atomi, structură circulară în care alternează simplele și dublele legături. Aceste legături sunt identice între ele, acest model fiind foarte asemănător cu cel al benzenului propus de Friedrich Kekulé. Acesta a propus pentru benzen 2 formule de rezonanță care corespund alternării dublelor și a simplelor legături 1,3,5 ciclohexatrienică. Contrar acestei structuri benzenul este mult mai stabil, mai ales din punct de vedere termic.
Teorii
[modificare | modificare sursă]
Teoria rezonanței
[modificare | modificare sursă]Formulele de rezonanță se indică prin săgeată dublu sens, tocmai pentru a arăta ca structurile de rezonanță nu sunt compuși diferiți ci mai mult ipotetici. Prin cristalografie în raze s-a constatat ca legăturile simple C-C au valoare de 140 pm mai mari fața de legăturile C=C (valoare 1.35m) dar mai mici față de legăturile C-C simple din alcani 147pm. Teoretic legătura dublă ar deforma structura planară a benzenului, lucru contrazis de structura perfect plan hexagonală a benzenului. Acest fapt dovedește toate 6 legături C-C au aceeași lungime și au o valoare intermediară intre valoarea unei duble legături și a uneia simple.
Teoria orbitalilor
[modificare | modificare sursă]O reprezentare mai exactă este cea circulară a orbitalilor π (inelul sau ciclul Armstrong), în care densitatea electronică este distribuită în mod uniform deasupra și dedesubtul planului moleculei. Prin acest model se reprezintă mult mai bine localizarea electronică. Se explică astfel și stabilitatea nucleului benzenic și echivalența legăturilor C-C care se datorează delocalizării celor 6 electroni π, dar și a distribuirii lor uniforme pe suprafața ciclului. Legăturile simple sunt de tip σm, în timp ce legăturile duble au la bază σ și π.

Datorită distribuirii uniforme a electronilor neparticipanți pe întreg ciclul aromatic, cei 6 orbitali π nehibridizați vor fuziona dînd naștere la un orbital molecular extins.
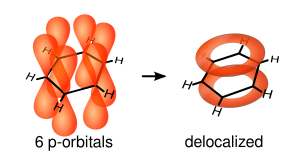
Istoric
[modificare | modificare sursă]S-a observat că prin degradarea a diferiți compuși plăcut mirositori se obțineau molecule cu schelet format din 6 atomi de carbon. Prima utilizare a cuvântului aromatic este făcută de către August Wilhelm Hofmann într-un articol apărut în 1855.[4]. Curios este că la acea vreme singurele substanțe "aromatice" (puternic aromatice) erau terpenele, care în sens strict chimic nu sunt compuși aromatici. Asemănarea dintre aceste 2 clase de substanțe este dat gradul mare de nesaturare consecința numărului de duble legături. La acea vreme însă Hofman nu putea face distincția între cele 2 clase de compuși.
Formula Kekulé
[modificare | modificare sursă]Elaborată pentru prima dată de Augustus Kekule în 1865, ține cont de formula moleculară a benzenului, de valențele atomilor de carbon și hidrogen astfel încât acesta atribuie benzenului o formulă 1,3,5 ciclohexatrienică. Aceasta formulă a fost mult timp unanim acceptată deoarece era în concordanță cu izomeria și cu o parte a reacțiilor chimice datorate acestei structuri. Însă pe parcursul timpului au fost observate anumite comportări chimice în dezacord cu această structură:
- Suferă mai ușor reacții de substituție decât de polimerizare și adiție;
- Se degradează (oxidează) numai în condiții energice;
- Prin oxidarea omologilor rezultă întotdeauna acid benzoic ceea ce demonstrează stabilitatea nucleului comparativ cu catena laterală;
- Reacțiile de adiție ale hidrogenului, halogenilor au loc doar în condiții energice.
Teoria sextetului
[modificare | modificare sursă]Descoperirea electronului de către J. J. Thomson, 1897-1906, a dus la o îmbunătățire a teoriei privind structura benzenului, prin alocarea fiecărui atom de carbon a unui electron.
O posibilă explicație referitoare la stabilitatea foarte mare e benzenului este oferită de Robert Robinson care în anul 1925[5] definește pentru prima oară denumirea de sextet aromatic , un grup de 6 electroni ce conferă stabilitatea ciclului aromatic. Conceptul de sextet aromatic este însă introdus în anul 1922 de Ernest Crocker în 1922,[6] iar înaintea lui de Henry Edward Armstrong, care în anul 1890, într-un articol intitulat The structure of cycloid hydrocarbons (Structura cicloidă a hidrocarburilor), arată:
„...the (six) centric affinities act within a cycle...benzene may be represented by a double ring (sic) ... and when an additive compound is formed, the inner cycle of affinity suffers disruption, the contiguous carbon-atoms to which nothing has been attached of necessity acquire the ethylenic condition.[7]”
„...cei șase centri ai afinității acționează în interiorul unui inel ... benzenul poate fi reprezentat printr-un inel dublu (sic) iar când are loc formarea unui compus prin adiție inelul interior al afinității este distrus, atomii de carbon vecini liberi vor trece în starea etilenică.[7]”
Armstrong anticipează astfel cel puțin 4 concepte moderne. Primul este afinitatea de fapt electronul de mai târziu descoperit de J. J. Thomson. Al doilea concept este descrierea substituției electrofile prin intermediarul de tip Wheland (ion benzenoniu) (concept 3), proces ce are loc cu distrugerea sistemului conjugat al inelului aromatic (al 4-lea concept). El introduce simbolul C centrat în mijlocul inelului interior, anticipând astfel notarea Eric Clar. Prin aceasta se anticipează principiile mecanicii cuantice, de vreme ce recunoaște că afinitățile (electronii) au aceeași orientare, nu sunt punctiforme la nivel de atom, au o distribuție uniformă ce poate fi alterată prin introducerea unei substituenți pe nucleul aromatic.
Condiții de apariție a stării aromatice
[modificare | modificare sursă]Prin intermediul mecanicii cuantice Hückel explică stabilitatea, caracterul aromatic, separînd pentru prima dată electronii de legătură în electroni sigma și electroni pi.
Regula lui Hückel
[modificare | modificare sursă]
În cadrul chimiei organice prin regula lui Hückel se estimează care moleculă plană poate avea caracter aromatic. Prin mecanica cuantică, folosind teoria orbitalilor moleculari Erich Hückel în 1931[8][9] arată că structurile de tip polienic ce conțin un număr de 4n+2 electroni pi (n = 0, 1, 2) au energie de conjugare mare ceea ce le conferă stabilitate aromatică. Înaintea lui se pare că această regulă de 4n +2 este atribuită lui von Doering (1951),[10] Prin hidrogenarea benezenului se degajă o energie egală cu -210kj/mol iar la hidrogenarea ciclohexenei -120kj/mol. Prin hidrogenarea 1,3, ciclohexatrienei (cf formula Kekule) se degajă 360kj. Diferența dintre energia 1,3,5 ciclohexatrienei și a molecului de benzen este dată de energia de rezonanță. Aceasta este cea care conferă stabilitate moleculei de benzen fiind numită și energie de stabilizare sau de conjugare. Astfel criteriile pentru apariția stării aromatice sunt:
- orice hidrocarbură care are 4n+2 electroni delocalizați sub forma norului electronic;
- este monociclică plană;
- fiecare atom este capabil să participe la delocalizarea electronilor prin orbitalii pi.
Regula Hückel a dat posibilitatea de a evalua caracterul aromatic al unei molecule. Conform acestei reguli teoretic ciclobutadiena și ciclooctatetraena (anulene) nu au caracter aromatic. Ca urmare o hidrocarbura care are este monociclică, plană și care are 4n electroni delocalizabili este antiaromatică. Regula nu se aplică pentru compuși aromatici policiclici. Pirenul, de exemplu, cu 16 electroni 8 legături conjugate și coronenul (24 electroni 12 legături conjugate), conform regulii Huckel ar trebui să nu aibă caracter aromatici lucru care nu se întâmplă.
Regula tridimensională
[modificare | modificare sursă]În 2000, Andreas Hirsch și colaboratorii au emis o regulă aplicabilă fulerenelor pentru determinarea caracterului (ne)aromatic al acestora. În particular aceștia au arătat că existența a 2(n+1)2 π-electroni, și a unei simetrii icosaedrice. În particular buckminsterfulerenele cu 60 electroni π, nu au caracter aromatic, din moment ce 60/2 = 30, care nu este un pătrat perfect.[11]
Excepții
[modificare | modificare sursă]Pentru ca o moleculă să aibă caracter aromatic trebuie să îndeplinească anumite condiții:
- Simetrie coplanară;
- Atomii aranjați în unul sau mai multe inele;
- Un număr de electroni π delocalizați 4n + 2, unde n=0, 1, 2, 3... (regula Hückel).

Conform acestor reguli în timp ce benzenul are caracter aromatic (6 electroni, 3 duble legături), ciclobutadiena nu manifestă caracter aromatic (numărul de electroni π delocalizați este 4). Există sisteme așa zise aromatice, în care fiecare atom al sistemului aromatic are electroni neparticipanți care nu participă la sistemul aromatic, electroni care nu se supun regulii 4n+2. De exemplu furanul, un complex ciclic cu heteroatom oxigen, acesta adoptă o hibridizare sp2. Ca urmare o pereche de electroni participă al sistemul π iar cealaltă se regăsește în orbitalii din inelul aromatic (legătură omoloagă C-H). Ca urmare sunt 6 electroni π deci furanul are caracter aromatic. Caracterul aromatic imprimă moleculei o stabilitate chimică, stabilitate care influențează proprietățile chimice ale moleculei. Astfel compușii aromatici suferă mult mai ușor reacții de substituție electrofilă și substituție nucleofilă, dar nu dă reacții de genul adiție electrofilă, caracteristică compușilor cu duble legături C=C. Electronii pi liberi în cîmp magnetic absorb la valori mai mici față de protonii de tip vinilic (C=C). Moleculele monociclice ce au 4n electroni π sunt numite antiaromatice și sunt în general destabilizate din punct de vedere electronic, din această cauză ele tinzând să iasă din această stare si structură.
Anulenele
[modificare | modificare sursă]Anulenele sunt o clasă de compuși cu formula (CH)n unde n este un număr întreg par. Ele respectă cel puțin teoretic regula lui Huckel pentru n=6,10,14,18.

Cicluri
[modificare | modificare sursă]Nu numai benzenul și omologii săi manifestă caracter aromatic. Heterociclii aromatici (piridină, pirazină, imidazol, pirazol, oxazol, tiofen) au un atom de carbon substituit cu un heteroatom. Această substituție poate avea drept efect o scădere a caracterului aromatic, concomitent cu o creștere a reactivității. O serie de alți compuși de tipul ciclopropenei (ion ciclopropenil 2e electroni) ciclopentadiena (ion ciclopentadienură), ionul tropiliu. Un caz special de aromaticitate o constituie homoaromaticitatea, în care conjugarea este întreruptă de un singur atom hibridizat sp3. Este cazul unor compuși ai benzenului: borabenzenul, silabenzenul, germanabenzenul, stanabenzenul, fosforină sau sărurile de piriliu în care caracterul aromatic este păstrat. Caractrerul aromatic se manifestă și la compușii anorganici cu structură similară benzenului de tipul silicazinei (Si6H6) și borazinului B3N3H6). Un alt tip de aromaticitate este cel întâlnit la metale de tipul aluminiului și poartă denumirea de aromaticite metalică, acest tip fiind întâlnit mai ales la compușii de tip cluster ai aluminiului. Aromaticitate Möbius, un al tip este întâlnită în cazul sistemelor ciclice în care orbitalii pπ sunt populați de 4n electroni, ce formează un singlet pe jumătate răsucit care corespunde benzii Möbius. Deoarece această răsucire poate fi fie spre stînga fie spre dreapta, rezultă că astfel de molecule sunt chirale.
Note
[modificare | modificare sursă]- ^ P. v. R. Schleyer, "Aromaticity (Editorial)", Chemical Reviews, 2001, 101, 1115-1118. DOI: 10.1021/cr0103221 Abstract.
- ^ A. T. Balaban, P. v. R. Schleyer and H. S. Rzepa, "Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons", Chemical Reviews, 2005, 105, 3436-3447. DOI: 10.1021/cr0103221 Abstract.
- ^ P. v. R. Schleyer, "Introduction: Delocalization-π and σ (Editorial)", Chemical Reviews, 2005, 105, 3433-3435. DOI: 10.1021/cr030095y Abstract.
- ^ A. W. Hofmann, "On Insolinic Acid," Proceedings of the Royal Society, 8 (1855), 1-3.
- ^ "CCXI.—Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases" James Wilson Armit and Robert Robinson Journal of the Chemical Society, Transactions, 1925, 127, 1604–1618 Abstract.
- ^ APPLICATION OF THE OCTET THEORY TO SINGLE-RING AROMATIC COMPOUNDS Ernest C. Crocker J. Am. Chem. Soc.; 1922; 44(8) pp 1618–1630; Abstract
- ^ a b The structure of cycloid hydrocarbons Henry Edward Armstrong Proceedings of the Chemical Society (London), 1890, 6, 95 - 106 Abstract
- ^ Hückel, Erich (), „Quantentheoretische Beiträge zum Benzolproblem I. Die Elektronenkonfiguration des Benzols und verwandter Verbindungen”, Z. Phys., 70 (3/4): 204–86, doi:10.1007/BF01339530. Hückel, Erich (), „Quanstentheoretische Beiträge zum Benzolproblem II. Quantentheorie der induzierten Polaritäten”, Z. Phys., 72 (5/6): 310–37, doi:10.1007/BF01341953. Hückel, Erich (), „Quantentheoretische Beiträge zum Problem der aromatischen und ungesättigten Verbindungen. III”, Z. Phys., 76 (9/10): 628–48, doi:10.1007/BF01341936.
- ^ Hückel, E. (), Grundzüge der Theorie ungesättiger und aromatischer Verbindungen, Berlin: Verlag Chem, pp. 77–85.
- ^ Doering, W. v. E. (septembrie 1951), Abstracts of the American Chemical Society Meeting, New York, p. 24M Lipsește sau este vid:
|title=(ajutor). - ^ Hirsch, Andreas; Chen, Zhongfang; Jiao, Haijun (), „Spherical Aromaticity in Ih Symmetrical Fullerenes: The 2(N+1)2 Rule”, Angew. Chem., Int. Ed. Engl., 39 (21): 3915–17, doi:10.1002/1521-3773(20001103)39:21<3915::AID-ANIE3915>3.0.CO;2-O.
| |||||


 French
French Deutsch
Deutsch