Нитрат меди(II) — Википедия
| Нитрат меди(II) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | Нитрат меди(II) |
| Традиционные названия | Медь азотнокислая |
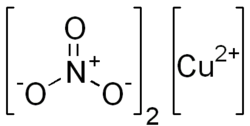
| Хим. формула | Cu(NO3)2 |
| Физические свойства | |
| Молярная масса | безводный: 187,57 г/моль; тригидрат: 241.63 г/моль; гексагидрат: 295,69 г/моль |
| Плотность | безводный: 3,05 г/см³; тригидрат: 2,32 г/см³; гексагидрат: 2,074 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | безводный: 255 °C[1]; тригидрат: 114,5 °C; гексагидрат: 24,4 °C |
| • разложения | безводный: 170 °C |
| Энтальпия | |
| • образования | безводный: −310 кДж/моль; тригидрат: −1217 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 124,7 г/100 мл |
| Структура | |
| Кристаллическая структура | безводный: ромбическая; тригидрат: ромбическая; гексагидрат: триклинная; 1,5- и 2,5-гидраты: моноклинная |
| Классификация | |
| Рег. номер CAS | 10031-43-3 |
| PubChem | 18616 |
| Рег. номер EINECS | 221-838-5 |
| SMILES | |
| InChI | |
| RTECS | GL7875000 |
| ChEBI | 78036 |
| Номер ООН | 1477 |
| ChemSpider | 17582 и 21607768 |
| Безопасность | |
| ЛД50 | тригидрат: 940 мг/кг |
| Фразы риска (R) | R8, R22, R34 |
| Фразы безопасности (S) | S17, S26, S36/37/39, S45, S60 |
| Краткие характер. опасности (H) | H272, H314, H318, H302 |
| Меры предостор. (P) | P221, P210, P303+P361+P353, P305+P351+P338, P405, P501 |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т ме́ди(II) — неорганическое вещество с формулой , является солью двухвалентной меди и азотной кислоты. Безводный нитрат меди(II) представляет собой бесцветные гигроскопичные кристаллы. При поглощении влаги образует кристаллогидраты голубого цвета.
Нахождение в природе
[править | править код]Нитрат меди(II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Герхардтит[2] | Руаит[3] | |
|---|---|---|
| Состав | Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства
[править | править код]Безводный нитрат меди(II) при нормальных условиях — твёрдое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО[4].
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов[5]:
- Cu(NO3)2·6H2O: триклинная сингония, пространственная группа P1, параметры ячейки a = 0,591 нм, b = 0,777 нм, c = 0,543 нм, α = 97,65°, β = 93,88°, γ = 72,53°, Z = 1.
- Cu(NO3)2·3H2O: ромбическая сингония, пространственная группа Pmn21, параметры ячейки a = 1,12 нм, b = 0,505 нм, c = 0,528 нм, Z = 4.
- Cu(NO3)2·2,5H2O: моноклинная сингония, пространственная группа I2/a, параметры ячейки a = 1,64539 нм, b = 0,49384 нм, c = 1,59632 нм, β = 93,764°, Z = 8.
- Cu(NO3)2·1,5H2O: моноклинная сингония, пространственная группа C2/c, параметры ячейки a = 2,22 нм, b = 0,490 нм, c = 1,54 нм, β = 48°, Z = 8.
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C[6].
Химические свойства
[править | править код]Разложение
[править | править код]Нитрат меди(II) при нагревании разлагается с образованием оксида меди(II) и диоксида азота:
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты. Реакция протекает в горячей воде:
Гидролиз
[править | править код]Нитрат меди(II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Катион тетрааквамеди(II) подвергается обратимому гидролизу:
В упрощённом виде:
Обменные реакции
[править | править код]В водных растворах нитрат меди(II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)
с фосфатом натрия (выпадает синий осадок)
с жёлтой кровяной солью (выпадает красный осадок)
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
с азидами щелочных металлов (выпадает коричневый осадок азида меди(II))
Прочие реакции
[править | править код]Нитрат меди(II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди(I):
Нитрат меди(II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка (аддукта):
Получение
[править | править код]Нитрат меди(II) может быть получен растворением в азотной кислоте металлической меди, оксида меди(II) или гидроксида меди(II):
Безводный нитрат меди(II) может быть получен при взаимодействии меди с тетраоксидом диазота. Реакция протекает при 80 °C в этилацетате):
Применение
[править | править код]Нитрат меди(II) используют для получения чистого оксида меди(II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей[5].
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»)[7].
Токсичность
[править | править код]Нитрат меди(II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — LC50 для рыб 0,29 мг/л в течение 96 ч.[8]
Примечания
[править | править код]- ↑ При быстром нагревании или избыточном давлении.
- ↑ Герхардтит на webmineral.com. Дата обращения: 28 июля 2010. Архивировано 2 мая 2012 года.
- ↑ Руаит на webmineral.com. Дата обращения: 28 июля 2010. Архивировано 2 мая 2012 года.
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 147. — 637 с. — ISBN 978-5-358-01303-2.
- ↑ 1 2 [www.xumuk.ru/encyklopedia/2460.html Нитрат меди на xumuk.ru]. Дата обращения: 15 июля 2010.
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 104. — 685 с. — ISBN 5-7107-8085-5.
- ↑ Menke J. B. Nitration with nitrates (неопр.) // Recueil des Travaux Chimiques des Payes-Bas. — 1925. — Т. 44. — С. 141.
- ↑ Merck Safety Data Sheet — Copper(II) nitrate trihydrate (pdf)
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. |


 French
French Deutsch
Deutsch



![{\displaystyle {\mathsf {Cu(NO_{3})_{2}+4\ H_{2}O\longrightarrow \ [Cu(H_{2}O)_{4}]^{2+}+2\ NO_{3}^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a457d67525be6380e626c568ac672651c9425f92)
![{\displaystyle {\mathsf {[Cu(H_{2}O)_{4}]^{2+}+\ H_{2}O\rightleftarrows \ [Cu(H_{2}O)_{3}(OH)]^{+}+\ H_{3}O^{+}}},\ pK_{a}\ =7,34}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fefdc2299ff5aef0f5c6b593ce7a73b6c875f02f)



![{\displaystyle {\mathsf {2Cu(NO_{3})_{2}+\ K_{4}[Fe(CN)_{6}]\longrightarrow \ Cu_{2}[Fe(CN)_{6}]\!\downarrow +4\ KNO_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eddab57b9e1e9d8024fc40eb39595deef0c5c416)
_{2}+4\ H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b0b3ef50bc9653a0e1d20c8134cde299de3e397b)








