Аминотрансферазы — Википедия

Аминотрансфера́зы (трансаминазы) — ферменты из группы трансфераз, катализирующие перенос аминогрупп от аминокислот на кетокислоты без образования свободного аммиака. Эти реакции трансаминирования осуществляют связь между белковым и углеводным обменом. Аминотрансферазы также называют трансаминазами, а реакцию — трансаминированием. Ферменты относятся к подклассу КФ 2.6.
Биохимические реакции аминотрансфераз
[править | править код]Для аминотрансфераз донором аминогрупп являются аминокислоты, а акцептором — кетокислоты:
AK1 + KK2 ↔ KK1 + AK2
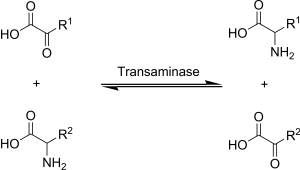
В составе простетической группы аминотрансферазы содержат производные витамина B6. Во время переноса аминогруппы простетическая группа переходит из пиридоксаль-5-фосфатной формы в пиридосамино-5-фосфатную форму.
Механизм реакции трансаминирования (переаминирования) открыт в 1937 году советскими учеными А. Е. Браунштейном и М. Г. Крицман[1][2].
Процесс протекает в две стадии.
- Альдегидная группа пиридоксальфосфата (-СНО) взаимодействует с аминогруппой аминокислоты с образованием иминной связи в основании Шиффа: сначала α-аминогруппа аминокислоты-донора замещает ε-аминогруппу апофермента, а затем происходит перегруппировка через кетимин и в результате гидролиза образуется пиридосамино-5-фосфат и α-кетокислота.
- Реакции повторяются в обратном порядке
Аминотрансферазы являются каталитически совершенными ферментами.
Аминотрансферазы содержатся практически во всех органах, но наиболее активно реакции трансаминирования идут в печени.
К этой группе ферментов относятся используетмые в клинической лабораторной диагностике ферменты аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ). Эти фeрменты были открыты в 1954 году, а в 1955 описана их роль в организме и значение для клинической диагностики[3].
Примечания
[править | править код]- ↑ Браунштейн, А. Е. Образование и распад аминокислот путем интермолекулярного переноса аминогруппы / А. Е. Браунштейн, М. Г. Крицман // Биохимия : журн. — 1937. — № 2. — С. 242–259.
- ↑ Браунштейн // Брасос — Веш. — М. : Советская энциклопедия, 1971. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 4).
- ↑ Karmen, A. Transaminase activity in human blood : [англ.] / A. Karmen, F. Wroblewski, J. S. Ladue // The Journal of Clinical Investigation. — 1955. — Vol. 34, no. 1. — P. 126–131. — doi:10.1172/JCI103055. — PMID 13221663. — PMC 438594.
Литература
[править | править код]- Комов В.П. Биохимия: Учеб. для вузов / В.П.Комов, В.Н.Шведова. - М.:Дрофа, 2004. - 640 с.: ил. - (Высшее образование: Современный учебник)


 French
French Deutsch
Deutsch