Фавипиравир — Википедия
| Фавипиравир | |
|---|---|
 | |
| Химическое соединение | |
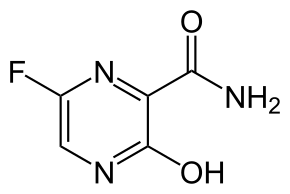
| ИЮПАК | 6-фторо-3-гидроксипиразин-2-карбоксамид |
| Брутто-формула | C5H4FN3O2 |
| Молярная масса | 157,104 г/моль |
| CAS | 259793-96-9 |
| PubChem | 492405 |
| DrugBank | DB12466 |
| Состав | |
| Классификация | |
| АТХ | J05AX27 |
| МКБ-10 | B34.2 |
| Фармакокинетика | |
| Связывание с белками плазмы | Около 54% |
| Метаболизм | Метаболизируется в основном альдегидоксидазой и частично ксантиноксидазой, в клетках метаболизируется рибозилтрифосфат (РТФ) фавипиравира (активный метаболит) |
| Период полувывед. | Около 5 ч |
| Экскреция | Почками |
| Лекарственные формы | |
| таблетки, покрытые плёночной оболочкой (200 мг; 400 мг); порошок (лиофилизат) для приготовления концентрата для приготовления раствора для инфузий (400мг; 800мг); концентрат для приготовления раствора для инфузий (40 мг/мл) | |
| Способы введения | |
| перорально, внутривенно (капельно) | |
| Другие названия | |
| Арепливир, Фавибирин, Авифавир, Фавипиравир, Ковидолек, Коронавир | |
Фавипирави́р — нуклеозидный аналог, разработанный японской компанией «Fujifilm Toyama Chemical» в 2002 году[1][2][3]
Срок патента на фавипиравир истек в 2019 году. С 2021 года в некоторых странах препарат исследуется на применимость против гриппа и других заболеваний[4][5].
Препарат лицензирован в Японии для лечения только атипичного (несезонного) гриппа[6] в условиях новых пандемий[2][3], в клинической практике он там не применялся[7].
В подавляющем большинстве стран мира фавипиравир не используется для лечения COVID-19[8]. В России фавипиравир включён в рекомендации по лечению COVID-19 и в список жизненно необходимых и важнейших лекарственных препаратов Минздрава России[9].
В июле 2020 года результаты клинических испытаний в Японии препарата по лечению COVID-19, по словам самого исследователя Yohei Doi, «не достигли статистической значимости»; несмотря на это, Минздрав РФ уже одобрил его для использования в этом качестве[10][11][12].
На конец 2021 года доказано, что фавипиравир неэффективен для лечения COVID-19, не сокращает время до клинического выздоровления и продолжительность пребывания в стационаре[1][13][14][15]. Не превосходит другие противовирусные препараты, вызывая при этом более тяжёлые симптомы, больше сопутствующих заболеваний, больше осложнений, а также неэффективен при контроле цитокинового шторма[13][15].
Мутагенное действие фавипиравира несёт угрозу появления новых опасных вирусных штаммов, в том числе с повышенной патогенностью и с повышенной устойчивостью к препарату[16].
До получения международного непатентованного названия фавипиравир обозначался индексом разработчика T-705[3]. Фавипиравир продаётся под торговыми марками Avigan (アビガン, Abigan), Avifavir, Areplivir, FabiFlu[17] и Favipira[18].
Фармакологические свойства
[править | править код]Фармакодинамика
[править | править код]In vitro фавипиравир обладает широким спектром активности против РНК-содержащих вирусов, включая вирусы гриппа, риновирус, респираторно-синцитиальный вирус, а также опасных для жизни вирусов. Не работает против ДНК-содержащих вирусов, в числе которых аденовирус, вирус простого герпеса первого типа и цитомегаловирус[3].
Механизм действия
[править | править код]О механизме действия фавипиравира есть разные мнения. Одни исследователи считают, что фавипиравир селективно ингибирует вирусную РНК-зависимую РНК-полимеразу[19]. Другие исследования показывают, что фавипиравир индуцирует летальные мутации РНК-трансверсии, производя нежизнеспособный вирусный фенотип[20] путём терминирования удлинения формирующейся цепи РНК[3].
Также есть мнение, что фавипиравир как в пероральной, так и внутривенной формах является пролекарством, которое метаболизируется до его активной формы, фавипиравир-рибофуранозил-5'-трифосфат (фавипиравир-RTP)[21][22]. Считается, что человеческая гипоксантин-гуанин-фосфорибозилтрансфераза (HGPRT) играет ключевую роль в процессе его активации[23].
Применение в медицине
[править | править код]К 2020 году фавипиравир был одобрен только в Японии исключительно для лечения атипичного гриппа, то есть был показан только для нового гриппа (штаммы, вызывающие более тяжёлые заболевания), а не для сезонного гриппа[24]. Однако, фактически, на практике не применялся[7]. По состоянию на 2020 год вероятность развития резистентности представляется низкой[24].
В России фавипиравир включен в рекомендации по лечению COVID-19[9], несмотря на несогласия экспертов и учёных, некоторые из которых заявляли об этом как о «преступлении против здоровья россиян».[7][25]
Побочные эффекты
[править | править код]Ранние исследования показали проаритмогенное действие этого препарата при лечении лихорадки Эбола[6].
Фавипиравир токсичен при беременности и планировании беременности, он способен нарушить эмбриональное развитие плода.
Исследования, опубликованные в 2020 году, показали, что фавипиравир оказывает тератогенное и эмбриотоксическое действие, вследствие чего его использование противопоказано у беременных женщин. Также он оказывает влияние на морфогенез сперматозоидов[6][26]. Из-за этого в 2019 году японское агентство по лекарственным средствам включило в инструкцию к фавипиравиру предупреждение о необходимости обязательного применения барьерной контрацепции во время терапии и в течение как минимум 7 дней после её окончания мужчинами, получающими препарат[26]. У женщин фертильного возраста необходимо обязательное проведение теста на беременность перед назначением фавипиравира и соблюдение эффективной контрацепции[6][26]. Частым осложнением терапии фавипиравиром у пациентов с COVID-19 являлось увеличение концентрации мочевой кислоты в крови вплоть до 2,5 раз[27] — гиперурикемия[26], гиперчувствительность, диарея, нейтропения, лейкопения, гипертриглицеридемия и гипертрансаминаземия. К числу побочных эффектов препарата также относятся фибрилляция предсердий, тошнота, рвота, головная боль, головокружение, сыпи, боль в груди, лейкоцитоз, моноцитоз, ретикулоцитопения, глюкозурия, гипокалиемия, повышение активности щелочной фосфатазы, повышение концентрации билирубина в крови, боль в животе, аномальное поведение, повышение активности креатинфосфокиназы, гематурия, полип гортани, гиперпигментация, нарушение вкусовой чувствительности, гематома, нечёткость зрения, боль в глазу, вертиго, наджелудочковые экстрасистолы, боль в грудной клетке, язва двенадцатиперстной кишки, кровянистый стул, гастрит, бронхиальная астма, боль в горле, ринит, назофарингит, экзема, зуд, астения, энантема, запор, глоссит, развитие злокачественного нейролептического синдрома.[26][28] Известны случаи острого приступа подагрического артрита.[6]
Препарат противопоказан при печёночной недостаточности тяжёлой степени (класс С по Чайлд-Пью)[26], повышенной чувствительности к фавипиравиру, почечной недостаточности тяжелой и терминальной степени тяжести (СКФ < 30 мл/мин); беременности или планировании беременности; в период грудного вскармливания; детский возраст до 18 лет.[28] Вероятно, вызывает холестатическое поражение печени.[29]
Приём фавипиравира во время беременности может нанести вред будущему ребёнку[7][30]. Эксперименты на 4 видах животных показали замедленное развитие эмбриона и его смерть в первом триместре, однако исследования на людях, включающие беременных или кормящих женщин, отсутствуют. В связи с риском тератогенности Японское бюро по безопасности лекарственных средств (англ. Pharmaceuticals and Medical Devices Agency) ввело строгие ограничения для использования препарата среди женщин репродуктивного возраста и предписало производителю указывать предупреждение об этом на упаковках и в инструкциях. Фавипиравир разрешено использовать в Японии только при отсутствии альтернатив[31][32].
Фавипиравир обнаруживается в грудном молоке, при использовании препарата грудное вскармливание должно быть приостановлено[26] .
Пациентам до 18 лет препарат противопоказан, поскольку не изучен в клинических исследованиях[26].
Группы высокого риска развития побочных эффектов: пожилые пациенты, пациенты с нарушениями вестибулярного аппарата, пациенты, управляющие транспортными средствами и работающие с механизмами.[26]
На основе заключения Японского агентства по лекарственным средствам, в последний пересмотр инструкции к оригинальному японскому препарату «Авиган» включено предупреждение о нежелательных эффектах в виде неспецифических моторных нарушений, способных привести к падениям[26].
Вызывает лекарственную лихорадку в некоторых случаях.[33][34]
В 2021 году исследования показали, что применение фавипиравира несёт угрозу появления новых опасных вирусных штаммов с повышенной патогенностью для человека и животных и приобретённой устойчивостью к химиопрепарату[35].
Другие исследования также показали, что фавипиравир вызывает значительное повышение мочевой кислоты в крови и обратно пропорционален уровню ферритина в крови[31][36].
Была обнаружена фототоксичность: желто-зеленая флуоресценция на лице, волосах и ногтевых лунках пациентов, принимавших фавипиравир.[37][38]
В январе 2022 года также стало известно о случаях появления сыпи, отеков, включая ангионевротический отек (отек Квинке) у пациентов при пероральном применении фавипиравира.[39][40]
Также наблюдались одновременно лейкопения и повышение уровня креатинина у пациентов с почечными трансплантантами.[41]
В сочетании с метотрексатом приводил к гепатотоксичности.[42] C пиразинамидом — к гиперурикемии (дополнительно повышается реабсорбция мочевой кислоты в почечных канальцах). С репаглинидом — может повыситься концентрация репаглинида в крови, возможно развитие нежелательных реакций на репаглинид (ингибирование CYP2C8 приводит к повышению концентрации репаглинида в крови). С теофиллином — концентрация фавипиравира в крови может повыситься, возможно развитие нежелательных реакций на фавипиравир (взаимодействие с ксантиноксидазой может привести к повышению концентрации фавипиравира в крови). С фамцикловиром, сулиндаком — эффективность данных препарата может быть снижена (ингибирование фавипиравиром альдегидоксидазы может привести к снижению концентрации активных форм данных ЛС в крови).[28]
Стал известен случай транзиторной синусовой брадикардии, вызванной фавипиравиром.[43]
Известны смертельные случаи пациентов на фоне терапии фавипиравиром.[27]
История
[править | править код]Фавипиравир разработан в 2002 году японской компанией Fujifilm Toyama Chemical Co.[1]. В разработавшей препарат компании Toyama Chemical тогда надеялись, что фавипиравир станет новым лекарством от гриппа, которое может заменить осельтамивир, но эксперименты на животных показали, что он может негативно влиять на ДНК будущего ребёнка с риском повреждения плода, поэтому одобрение данного препарата Министерством здравоохранения, труда и социального обеспечения Японии было отложено на неопределённый срок[44].
Первые научные публикации о препарате появились в 2002 году[45].
В 2014 году фавипиравир был одобрен в Японии в качестве препарата против гриппа[46] — ограниченно разрешён для лечения гриппа A и B, вызванного резистентными к противовирусным препаратам штаммами[47], он не предназначен для лечения сезонного гриппа. По состоянию на 2020 год вероятность развития резистентности вируса гриппа к препарату остаётся низкой[30].
В Японии после регистрации фавипиравира в клинической практике он не применялся[7].
15 марта 2020 года препарат был разрешён к продаже в Китае для лечения гриппа[48]. 30 мая 2020 года фавипиравир, выпускаемый под торговым наименованием «Авифавир» на совместном предприятии «ХимРара» и РФПИ, зарегистрирован в России как лекарство от коронавирусной инфекции[49]. До 17 сентября 2020 года[50] фавипиравир в России не был предназначен для продажи в розницу, а разрешён к применению только в условиях стационара[51]. Немецкое правительство также закупило некоторое количество фавипиравира, чтобы поставлять его в клиники по запросам врачей, но спросом у них он не пользуется. Немецкие специалисты отмечают, что в России, относительно европейских стран, ниже требования к клиническим исследованиям, необходимым для сертификации (регистрации) лекарств, а сама процедура регистрации менее строгая, чем у них[51].
В октябре 2020 года фавипиравир включен в список «Жизненно необходимые и важнейшие лекарственные препараты» (ЖНВЛП) Минздрава РФ[9].
Фавипиравир исследовался как возможное средство против SARS-CoV-2 (для лечения коронавирусной инфекции COVID-19)[52][53][54], попал в руководства по лечению некоторых стран[53][54]. Он не оправдал ожиданий: в исследовании, выполненном по стандартам доказательной медицины, завершённом в середине 2020 года, значимый терапевтический эффект у него не обнаружен[55]. В 2021 году завершилось другое исследование фавипиравира при лечении COVID-19, в котором клинический эффект этого препарата не был обнаружен. Проводившая исследование канадская компания Appili Therapeutics, ранее вступившая в консорциум производителей фавипиравира, опубликовала заявление, в котором признала ошибочность своих надежд на эффективность фавипиравира, прекратила финансирование проектов по фавипиравиру и пообещала сосредоточиться на разработках других лекарств против COVID-19[1][56].
В 2020 году фавипиравир зарегистрирован в России и включен в список жизненно необходимых и важнейших лекарственных препаратов Минздрава России[9], несмотря на то, что в доклинических исследованиях, он показал способность оказывать тератогенное и эмбриотоксическое действие, а также влияние на морфогенез сперматозоидов.[6]
На 2020 год Фавипиравир изучается как потенциальное средство для лечения ряда других вирусных инфекций[52].
Правовой статус
[править | править код]Министерство обороны США разработало фавипиравир в партнёрстве с MediVector, Inc. в качестве противовирусного препарата широкого спектра действия и спонсировало его в рамках клинических испытаний фазы II и III FDA, в которых он продемонстрировал безопасность для людей и эффективность против вируса гриппа[57]. Несмотря на демонстрацию безопасности более чем у 2000 пациентов и ускорение выведения вируса гриппа на 6-14 часов в неопубликованных исследованиях фазы III, фавипиравир по-прежнему не одобрен в Великобритании и США[58]. В 2014 году Япония одобрила фавипиравир для лечения штаммов гриппа, не реагирующих на современные противовирусные препараты[59]. Первоначально компания Toyama Chemical надеялась, что фавипиравир станет новым лекарством от гриппа, которое сможет заменить осельтамивир (торговая марка Тамифлю). Однако эксперименты на животных показывают потенциал тератогенных эффектов, и одобрение производства Министерством здравоохранения, труда и социального обеспечения было сильно задержано, а условия производства ограничены только в случае чрезвычайной ситуации в Японии[60].
Из-за пандемии COVID-19 фавипиравир был быстро одобрен в Китае в феврале 2020 года для розничной продажи[61][62].
20 июня 2020 года препарат был вначале одобрен в Индии для лечения пациентов с COVID-19 под торговой маркой Fabiflu[63], однако 11 апреля 2022 года его исключили из списка препаратов для лечения Covid-19.[64]
В России
[править | править код]
29 мая 2020 года первый препарат фавипиравира зарегистрирован Минздравом РФ[65].
30 мая 2020 года Минздрав России зарегистрировал дженерик фавипиравира под названием «Авифавир»[66][67][68].
25 июня 2020 года Минздрав России одобрил второй препарат фавипиравира — «Арепливир»[69].
С июня-июля 2020 года фавипиравир доступен в России под торговыми марками «Авифавир», «Арепливир», «Коронавир» и «Фавибирин»[65][70].
Эффективность и безопасность
[править | править код]В 2009 году фавипиравир считался нетоксичным для млекопитающих, поскольку он не ингибирует синтез их собственных РНК или ДНК[71]. Инструкции к российским препаратам фавипиравира приводят данные об ингибировании β- и γ- ДНК-полимераз человека, а также полимеразы II РНК человека[72]. На 2014 год некоторые стандартные[73] тесты на генотоксичность (способность вызывать мутации/повреждения ДНК) на клетках и на животных дали положительный результат, однако эти результаты были объяснены непрямыми эффектами, и риск генотоксичности фавипиравира считался низким[74].
На 2020 год утверждения об эффективности фавипиравира при лечении любых болезней людей ничем не обоснованы[75][55], на август-октябрь 2021 года для него также нет доказательств эффективности[5][53].
Из-за тератогенности и эмбриотоксичности для животных фавипиравир противопоказан беременным женщинам[3].
На конец 2021 года доказано, что фавипиравир неэффективен для лечения COVID-19[1][13][14][15] , а его мутагенное действие несёт угрозу появления новых опасных вирусных штаммов, в том числе с повышенной патогенностью и с повышенной устойчивостью к препарату.[16]
По данным живого систематического обзора с метаанализом безопасность лечения фавипиравиром не отличается от стандартной терапии[76]
Исследования
[править | править код]Препарат показал активность против многих вирусов в лабораторных условиях in vitro и некоторую эффективность в испытаниях на животных. На людях испытывался против опасных для жизни вирусов лихорадок Эбола и Ласса, вирусов бешенства и тяжелой лихорадки с синдромом тромбоцитопении[англ.]. Пока отсутствуют штаммы, выработавшие устойчивость к препарату[3].
При выдаче разрешения на ограниченное использование в Японии в 2014 году PMDA[англ.] указало на отсутствие полного спектра исследований препарата и предписало производителю провести их и опубликовать результаты[77].
В 2014 году некоторые исследователи высказывали предположение о потенциале фавипиравира для лечения геморрагической лихорадки Эболы[78][79]. Но проведённое впоследствии клиническое исследование в Гвинее имеет серьёзные недостатки методики и ничего не доказывает[80].
К середине 2020 года были завершены 14 клинических испытаний фавипиравира как лекарства для лечения разных заболеваний, при этом результаты опубликованы только в одном испытании 2 фазы и одном — третьей, у 12 исследований результаты недоступны для анализа. В одном исследовании второй фазы показано, что препарат клинически эффективен против вирусов гриппа, при этом отсутствовали смертность и серьёзные побочные эффекты. В другом исследовании (третьей фазы) сделан вывод, что препарат может облегчать симптомы и снижать лихорадку[81].
Ретроспективный анализ спонтанных сообщений о нежелательных реакциях при применении лекарственных средств (ЛС) для лечения COVID-19 в период с 28.04.2020 по 11.07.2021, зарегистрированных в национальных базе РФ (АИС РЗН), показал следующее распределение сообщений по ЛС : фавипиравир — 96, олокизумаб — 86, гидроксихлорохин — 77, лопинавир + ритонавир — 52, азитромицин — 46, тоцилизумаб — 29, мефлохин — 4 и барицитиниб — 3.[82][83]
COVID-19
[править | править код]Фавипиравир изучался в качестве потенциального средства лечения COVID-19 с февраля 2020[84][85][86][87][88]. В апреле 2020 года специалисты ВОЗ отложили обсуждение включения фавипиравира в исследование Solidarity из-за недостаточности доказательств его эффективности[89].
В июле 2020 года, после завершения клинического испытания на 89 пациентах, японские исследователи в интервью сообщили, что не смогли обнаружить у фавипиравира терапевтический эффект при лечении им COVID-19[55].
В исследовании по стандартам доказательной медицины, завершившемся в Японии в 2020 году, значимый эффект применения фавипиравира в лечении COVID-19 не обнаружен[55].
Статья египетских исследователей, опубликовавших выводы о фавипиравире как о безопасной эффективной альтернативе гидроксихлорохину у пациентов с COVID-19 легкой или средней степени тяжести, была позднее отозвана редакцией и признана фальсификацией.[90][91]
На ноябрь 2021 года, по данным исследования PRESECO, фавипиравир не ускоряет выздоровление пациентов с COVID-19. Проводившая исследование канадская биотехнологическая компания признала его бесперспективным против COVID-19[1].
Семь систематических обзоров, подкрепленных метаанализами, выявили очень слабую доказательную базу в отношении терапевтической эффективности фавипиравира, указывая на то, что в целом он не несёт особой пользы для пациентов при лечении COVID-19[8].
По состоянию на июль 2022 года фавипиравир не имеет доказательств эффективности по критериям сокращения летальности и риска ИВЛ[53]. По данным низкой достоверности, фавипиравир может снижать время до клинического выздоровления (разрешения симптомов), а также срок госпитализации при COVID-19[76].
Эбола
[править | править код]Клинические испытания по изучению использования фавипиравира против болезни, вызванной вирусом Эбола, начались в гвинейском Гекеду, в декабре 2014 года[92]. Предварительные результаты, представленные в 2016 году на Конференции по ретровирусам и оппортунистическим инфекциям (CROI), опубликованные позднее, показали снижение смертности у пациентов уровень вируса в крови от низкого до среднего, но не влияет на пациентов с высоким уровнем (группа с более высоким риском смерти)[93][94]. Это исследование недостоверно из-за его дизайна — использовался только исторический контроль[95].
Критика
[править | править код]Руководитель лаборатории геномной инженерии МФТИ к. б. н. Павел Волчков заявлял, что фавипиравир — это яд, «поэтому его не стали массово применять против вируса гриппа». Применение фавипиравира для легких и среднетяжелых форм, как это прописано в инструкциях к разрешенным отечественным «Коронавиру» и «Арепливиру», неоправданно, уверен Павел Волчков.[25][96]
Доктор медицинских наук Василий Власов, профессор НИУ ВШЭ, выступил против применения этого препарата для терапии COVID-19, выразил свои сомнения в эффективности этого препарата и дженериков на его основе[7][97].
О. П. Жирнов и А. И. Чернышова указывают, что мутагенное действие фавипиравира несёт угрозу появления новых опасных вирусных штаммов, в том числе с повышенной патогенностью и с повышенной устойчивостью к препарату[16].
Примечания
[править | править код]- ↑ 1 2 3 4 5 6 Appili Therapeutics Provides Update on Phase 3 PRESECO Clinical Trial Evaluating Avigan/Reeqonus : [англ.] : [арх. 12 ноября 2021] // Appili Therapeutics. — 2021. — 12 November.
- ↑ 1 2 Goldhill, D. H. Favipiravir-resistant influenza A virus shows potential for transmission : [англ.] / D. H. Goldhill, A. Yan, R. Frise … [et al.] // PLoS pathogens. — 2021. — Vol. 17, no. 6. — Art. e1008937. — ISSN 1553-7374. — doi:10.1371/journal.ppat.1008937. — PMID 34061908.
- ↑ 1 2 3 4 5 6 7 Shiraki, K. Favipiravir, an anti-influenza drug against life-threatening RNA virus infections : [англ.] : [арх. 2 июня 2020] / K. Shiraki, T. Daikoku // Pharmacology & Therapeutics : j. — 2020. — Vol. 209 (May). — Art. 107512. — ISSN 0163-7258. — doi:10.1016/j.pharmthera.2020.107512. — PMID 32097670. — PMC 7102570.
- ↑ Ibrahim, N. K. Effect of Favipiravir on some epidemic infections: A mini review : [англ.] : [арх. 8 октября 2021] / N. K. Ibrahim, Z. S. Al-Garawi // Journal of Physics: Conference Series. — 2021. — Vol. 1853. — doi:10.1088/1742-6596/1853/1/012067.
- ↑ 1 2 Łagocka, R. Favipiravir in Therapy of Viral Infections : [англ.] / R. Łagocka, V. Dziedziejko, P. Kłos … [et al.] // Journal of Clinical Medicine. — 2021. — Vol. 10, no. 2. — P. 273. — doi:10.3390/jcm10020273. — PMID 33451007. — PMC 7828521.
- ↑ 1 2 3 4 5 6 Матвеев А.В., Киселёв Ю.Ю., Сычёв Д.А. Возможность и перспективы применения препарата фавипиравир у пациентов с COVID-19 // Качественная клиническая практика. — 2020. — № S4. — С. С.106-114.
- ↑ 1 2 3 4 5 6 Заякин, А. Фавипиравир. Неэффективен и очень опасен. : [арх. 13 июля 2020] // Новая газета. — 2020. — № 75 (17 июля). — С. 14.
- ↑ 1 2 Р. Дмитриев. Лечение коронавируса. Помогает ли фавипиравир при ковиде так, как хотелось бы? Какую пользу следует ожидать от фавипиравира в борьбе с коронавирусом. Mosmedpreparaty.ru. «Мосмедпрепараты» (15 ноября 2021). Дата обращения: 15 ноября 2021. Архивировано 15 ноября 2021 года.
- ↑ 1 2 3 4 Фавипиравир внесен в России в список жизненно необходимых препаратов : [арх. 15 октября 2020] // Интерфакс. — 2020. — 14 октября.
- ↑ Reuters Staff. Fujifilm's Avigan inconclusive in COVID-19 patients in Japan trial. Reuters. Дата обращения: 12 июля 2020. Архивировано 12 июля 2020 года.
- ↑ "Фавипиравир оказался неэффективен при лечении коронавирусной инфекции". Информационное агентство ТАСС. 10 июля 2020. Архивировано 27 февраля 2022. Дата обращения: 15 июля 2022.
- ↑ "Avigan study fails to demonstrate benefit in COVID-19 treatment". KYODO NEWS. 10 июля 2020. Архивировано 14 июля 2022. Дата обращения: 15 июля 2022.
- ↑ 1 2 3 Safety and efficacy of Favipiravir in moderate to severe SARS-CoV-2 pneumonia // Int Immunopharmacol.. — 2021. — doi:10.1016/j.intimp.2021.107522. Архивировано 4 марта 2022 года.
- ↑ 1 2 Efficacy of favipiravir in adults with mild COVID-19: a randomized, double-blind, multicentre, placebo-controlled clinical trial // Clin Microbiol Infect.. — 2022. — doi:10.1016/j.cmi.2021.12.026.. Архивировано 4 марта 2022 года.
- ↑ 1 2 3 Overview of Clinical Outcome and Therapeutic Effectiveness of Favipiravir in Patients with COVID-19 Admitted to Intensive Care Unit, Riyadh, Saudi Arabia // Journal of Infection and Public Health. — 2022. — doi:10.1016/j.jiph.2022.01.013. Архивировано 5 марта 2022 года.
- ↑ 1 2 3 Жирнов О. П. Фавипиравир: скрытая опасность мутагенного действия. Журнал микробиологии, эпидемиологии и иммунобиологии. Дата обращения: 16 февраля 2022. Архивировано 16 февраля 2022 года.
- ↑ 'FabiFlu is the most economical COVID-19 treatment option' : Glenmark's reply to Centre on alleged 'overpricing' : [англ.] : [арх. 23 июля 2020] // DNA India. — 2020. — 21 July.
- ↑ Favipira — Tablet — 200 mg — Beacon Pharmaceuticals Ltd. : Indications, Pharmacology, Dosage, Side Effects & other Generic Info : [англ.] : [арх. 11 сентября 2020] // Medex.
- ↑ Jin Z. et al. The ambiguous base-pairing and high substrate efficiency of T-705 (Favipiravir) Ribofuranosyl 5'-triphosphate towards influenza A virus polymerase (англ.) // PLOS One : journal. — Public Library of Science, 2013. — Vol. 8, no. 7. — P. e68347. — doi:10.1371/journal.pone.0068347. — . — PMID 23874596.
- ↑ Baranovich, T. T-705 (favipiravir) induces lethal mutagenesis in influenza A H1N1 viruses in vitro : [англ.] / T. Baranovich, et al. // Journal of Virology[англ.]. — 2013. — Vol. 87, no. 7. — P. 3741–3751. — doi:10.1128/JVI.02346-12. — PMID 23325689.
- ↑ Guedj, J. Antiviral efficacy of favipiravir against Ebola virus: A translational study in cynomolgus macaques : [англ.] / J. Guedj, et al. // PLOS Medicine[англ.] : j. — 2018. — Vol. 15, no. 3. — Art. e1002535. — doi:10.1371/journal.pmed.1002535. — PMID 29584730.
- ↑ Smee, D. F. Intracellular metabolism of favipiravir (T-705) in uninfected and influenza A (H5N1) virus-infected cells : [англ.] / D. F. Smee, et al. // Journal of Antimicrobial Chemotherapy[англ.]. — 2009. — Vol. 64, no. 4. — P. 741–746. — doi:10.1093/jac/dkp274. — PMID 19643775.
- ↑ Naesens, L. Role of human hypoxanthine guanine phosphoribosyltransferase in activation of the antiviral agent T-705 (favipiravir) : [англ.] / L. Naesens, et al. // Molecular Pharmacology[англ.] : j. — 2013. — Vol. 84, no. 4. — P. 615–629. — doi:10.1124/mol.113.087247. — PMID 23907213.
- ↑ 1 2 Shiraki, K. Favipiravir, an anti-influenza drug against life-threatening RNA virus infections : [англ.] / K. Shiraki, T. Daikoku // Pharmacology & Therapeutics. — 2020. — Vol. 209. — P. 107512. — doi:10.1016/j.pharmthera.2020.107512. — PMID 32097670.
- ↑ 1 2 Танцы в темноте: у фавипиравира нашли новые побочные эффекты (9 октября 2020). Дата обращения: 26 февраля 2022. Архивировано 26 февраля 2022 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 Киселёв, Ю. Ю. Мониторинг безопасности применения фавипиравира: управление рисками развития нежелательных лекарственных реакций в клинической практике : [арх. 26 февраля 2022] / Ю. Ю. Киселёв, А. В. Матвеев, К. Б. Мирзаев … [и др.] // Качественная клиническая практика. — 2020. — № 4S. — С. 115—119. — doi:10.37489/2588-0519-2020-S4-115-119.
- ↑ 1 2 Evaluation of risk factors for uric acid elevation in COVID-19 patients treated with favipiravir // Diagnostic Microbiology and Infectious Disease. — 2022. Архивировано 5 марта 2022 года.
- ↑ 1 2 3 Фавипиравир (Favipiravirum). Регистр лекарственных средств России, Росминздрав (2020). Дата обращения: 1 декабря 2021. Архивировано 1 декабря 2021 года.
- ↑ Suspected cholestatic liver injury induced by favipiravir in a patient with COVID-19 // Journal of Infection and Chemotherapy. — 2021. — Февраль (т. 27, № 2). — С. 390—392. — doi:10.1016/j.jiac.2020.12.021. Архивировано 5 марта 2022 года.
- ↑ 1 2 Kimiyasu Shiraki, Tohru Daikoku. Favipiravir, an anti-influenza drug against life-threatening RNA virus infections (англ.) // Pharmacology & therapeutics : journal. — 2020. — 22 February (vol. 209). — P. 107512. — doi:10.1016/j.pharmthera.2020.107512. — PMID 32097670.
- ↑ 1 2 Pilkington, V. A review of the safety of favipiravir — a potential treatment in the COVID-19 pandemic? : [англ.] / V. Pilkington, V. Pilkington, T. Pepperrell … [et al.] // Journal of Virus Eradication. — 2020. — Vol. 6, no. 2 (30 April). — P. 45–51. — ISSN 2055-6640. — doi:10.1016/S2055-6640(20)30016-9. — PMID 32405421. — PMC 7213073.
- ↑ FMDA, 2011, p. 3,45: «…favipiravir has the risk of teratogenicity, etc.».
- ↑ Favipiravir-induced fever in coronavirus disease 2019: A report of two cases // International Journal of Infectious Diseases. — 2020. — Декабрь (т. 101). — С. 188—190. — doi:10.1016/j.ijid.2020.09.1450. Архивировано 5 марта 2022 года.
- ↑ A case of COVID-19 diagnosed with favipiravir-induced drug fever based on a positive drug-induced lymphocyte stimulation test // International Journal of Infectious Diseases. — 2021. — Май (т. 106). — С. 33—35. — doi:10.1016/j.ijid.2021.03.048. Архивировано 5 марта 2022 года.
- ↑ Жирнов, О. П. Фавипиравир: скрытая опасность мутагенного действия : [арх. 26 февраля 2022] / О. П. Жирнов, А. И. Чернышова // Журнал микробиологии, эпидемиологии и иммунобиологии. — 2021. — Т. 98, № 2. — С. 213–220. — doi:10.36233/0372-9311-114.
- ↑ Elevated blood favipiravir levels are inversely associated with ferritin levels and induce the elevation of uric acid levels in COVID-19 treatment: A retrospective single-center study // J Infect Chemother.. — 2022. — Январь (т. 28, № 1). — С. 73–77. — doi:10.1016/j.jiac.2021.10.011. Архивировано 4 марта 2022 года.
- ↑ Çağrı Turan, Nurcan Metin, Zeynep Utlu, Türkan Tuğba Yıldız, Selcen Caferoğlu Sakat. Evaluation of the frequency and intensity of favipiravir-associated yellow-green fluorescence in lunulae, hair, and face // Journal of Cosmetic Dermatology. — 2021. — doi:10.1111/jocd.14189. Архивировано 4 марта 2022 года.
- ↑ Fluorescence of nails and hair on Wood's lamp examination in Covid pandemic; undefined effect of Favipiravir in humans // Dermatologic Therapy Weley. — 2020. — 30 декабря. — doi:10.1111/dth.14740.
- ↑ Mehmet Sami Islamoglu, Mehmet Dokur, Betul Borku Uysal, Burak Onal. Angioedema after favipiravir treatment: Two cases // J Cosmet Dermatol.. — 21.01.2022. — ISSN 10.1111/jocd.14790 DOI: 10.1111/jocd.14790. Архивировано 4 марта 2022 года.
- ↑ P. Punyaratabandhu, S. Vanitchpongphan. Favipiravir-induced cutaneous adverse reactions in patients infected with COVID-19 // Clin Exp Dermatol. — 03.2022. Архивировано 4 марта 2022 года.
- ↑ Cristina Cismaru, Alina Daciana Elec, Adriana Muntean, Tudor Moisoiu, Mihaela Lupșe, Oana Antal, Florin Ioan Elec. Favipiravir in Kidney Transplant Recipients With COVID-19: A Romanian Case Series // Transplant Proc.. — 2022. Архивировано 4 марта 2022 года.
- ↑ Emre Demir, Osman Sütcüoğlu, Beril Demir, Oktay Ünsal, Ozan Yazıcı. A possible interaction between favipiravir and methotrexate: Drug-induced hepatotoxicity in a patient with osteosarcoma // J Oncol Pharm Pract.. — 2022. — doi:10.1177/10781552211031304. Архивировано 4 марта 2022 года.
- ↑ József Szigeti. Sinusbradycardia mint lehetséges favipiravir-mellékhatás // Orvosi Hetilap : Journal. — 2022. — 13 февраля (т. 163, № 7). — С. 267–270. — doi:10.1556/650.2022.32455. Архивировано 4 марта 2022 года.
- ↑ 条件付き承認で普及に足かせ 富山化学インフル薬の"無念" (яп.). diamond.jp. Дата обращения: 25 февраля 2014. Архивировано 28 февраля 2014 года.
- ↑ Furuta, Y. In Vitro and In Vivo Activities of Anti-Influenza Virus Compound T-705 : [англ.] / Y. Furuta, K. Takahashi, Y. Fukuda … [et al.] // Antimicrobial Agents and Chemotherapy. — 2002. — Vol. 46, no. 4. — P. 977—981. — doi:10.1128/AAC.46.4.977-981.2002. — PMID 11897578. — PMC 127093.

- ↑ Koons, Cynthia. Ebola Drug From Japan May Emerge Among Key Candidates : [англ.] : [арх. 7 января 2015] // Bloomberg. — 2014. — 7 August.
- ↑ Hayden F. G., Shindo N. Influenza virus polymerase inhibitors in clinical development (англ.) // Current Opinion in Infectious Diseases[англ.]. — Lippincott Williams & Wilkins[англ.], 2019. — Vol. 32, no. 2. — P. 176—186. — doi:10.1097/QCO.0000000000000532. — PMID 30724789.

- ↑ Zhang Yangfei. Potential coronavirus drug approved for marketing (англ.). China Daily. Дата обращения: 21 марта 2020. Архивировано 30 марта 2020 года.
- ↑ Константин Журавлёв. Минздрав одобрил препарат РФПИ и «ХимРара» от коронавируса. Газета.ру (30 мая 2020). Дата обращения: 31 мая 2020. Архивировано 8 июня 2020 года.
- ↑ Государственный реестр лекарственных средств. Дата обращения: 21 сентября 2020. Архивировано 8 ноября 2020 года.
- ↑ 1 2 Гончаренко Р. Авифавир — новое российское лекарство от коронавируса? : [арх. 22 июня 2020] / Роман Гончаренко // DW. — 2020. — 11 июня.
- ↑ 1 2 Du,, Y.‐X. Favipiravir : pharmacokinetics and concerns about clinical trials for 2019-nCoV infection : [англ.] / Y.‐X. Du,, X.‐P. Chen // Clinical pharmacology and therapeutics[англ.] : j. — 2020. — 4 April. — doi:10.1002/cpt.1844. — PMID 32246834.
- ↑ 1 2 3 4 Özlüşen, B. Effectiveness of favipiravir in COVID-19 : a live systematic review : [англ.] / B. Özlüşen, Ş. Kozan, R. E. Akcan … [et al.] // European Journal of Clinical Microbiology & Infectious Diseases. — 2021. — 4 August. — P. 1–9. — ISSN 1435-4373. — doi:10.1007/s10096-021-04307-1. — PMID 34347191. — PMC 8335450.
- ↑ 1 2 Hassanipour, S. The efficacy and safety of Favipiravir in treatment of COVID-19 : a systematic review and meta-analysis of clinical trials : [англ.] / S. Hassanipour, M. Arab-Zozani, B. Amani … [et al.] // Scientific Reports. — 2021. — Vol. 11 (26 May). — P. 11022. — ISSN 2045-2322. — doi:10.1038/s41598-021-90551-6. — PMID 34040117. — PMC 8155021.
- ↑ 1 2 3 4 Swift R. Fujifilm's Avigan inconclusive in COVID-19 patients in Japan trial : [англ.] : [арх. 10 июля 2020] / Reporting by Rocky Swift; Editing by Chris Gallagher and Chang-Ran Kim // Reuters. — 2020. — 10 July.
- ↑ Appili Therapeutics Reports Financial and Operational Results for Third Quarter of Fiscal Year 2022 // Appili Therapeutics. — February 14, 2022. Архивировано 1 марта 2022 года.
- ↑ MediVector Completes Patient Enrollment In Two Phase 3 Studies Of Favipiravir For Influenza. BioSpace. Дата обращения: 5 мая 2020. Архивировано 4 ноября 2020 года.
- ↑ Lumby, Casper (3 марта 2020). "Favipiravir and Zanamivir Cleared Infection with Influenza B in a Severely Immunocompromised Child". Clinical Infectious Diseases. 71 (7): e191 – e194. doi:10.1093/cid/ciaa023. PMID 32124919.
- ↑ Hayden FG, Shindo N (April 2019). "Influenza virus polymerase inhibitors in clinical development". Current Opinion in Infectious Diseases. 32 (2): 176–186. doi:10.1097/QCO.0000000000000532. PMC 6416007. PMID 30724789.

- ↑ Conditional approval hampers popularization Toyama Chemical's flu drug "remorse" (яп.). Дата обращения: 25 февраля 2014. Архивировано 9 апреля 2020 года.
- ↑ Coronavirus, il Veneto sperimenta l'antivirale giapponese Favipiravir. Ma l'Aifa: "Ci sono scarse evidenze scientifiche su efficacia" (итал.). Il Fatto Quotidiano (22 марта 2020). Дата обращения: 23 марта 2020. Архивировано 14 июля 2020 года.
- ↑ Yangfei, Z. Potential coronavirus drug approved for marketing : [англ.] : [арх. 30 марта 2020] // China Daily. — 2020. — 17 March.
- ↑ Glenmark Launches COVID-19 Drug Favipiravir At ₹ 103 Per Tablet : [англ.] : [арх. 8 октября 2021] // NDTV. — 2020. — 21 June.
- ↑ "Govt drops Ivermectin, HCQ and favipiravir from Covid-19 treatment list". 12 апреля 2022. Архивировано 12 апреля 2022. Дата обращения: 12 апреля 2022.
- ↑ 1 2 Первый препарат против COVID-19 «Авифавир» поступил в клиники семи регионов РФ. Интерфакс (11 июня 2020). Дата обращения: 15 ноября 2020. Архивировано 16 ноября 2020 года.
- ↑ "Russian Ministry of Health approves the first COVID-19 drug Avifavir produced by JV of RDIF and ChemRar". RDIF. 30 мая 2020. Архивировано 6 октября 2020. Дата обращения: 31 мая 2020.
- ↑ "Russian Health Ministry approves anti-coronavirus drug Avifavir". BNN Bloomberg. 31 мая 2020. Архивировано 9 октября 2020. Дата обращения: 31 мая 2020.
- ↑ "Russia plans coronavirus vaccine clinical trials in two weeks - report". Reuters. 30 мая 2020. Архивировано 6 октября 2020. Дата обращения: 31 мая 2020.
- ↑ Минздрав одобрил препарат от коронавируса «Арепливир» : [арх. 26 июня 2020] // Интерфакс. — 2020. — 25 июня.
- ↑ Минздрав РФ одобрил третий препарат для лечения коронавируса. Интерфакс (8 июля 2020). Дата обращения: 15 ноября 2020. Архивировано 13 ноября 2020 года.
- ↑ T-705 (favipiravir) and related compounds: Novel broad-spectrum inhibitors of RNA viral infections (англ.) // Antiviral Research[англ.] : journal. — 2009. — June (vol. 82, no. 3). — P. 95—102. — doi:10.1016/j.antiviral.2009.02.198. — PMID 19428599.
- ↑ Фавипиравир (Favipiravirum)- описание вещества, инструкция, применение, противопоказания и формула. www.rlsnet.ru. Дата обращения: 1 декабря 2021. Архивировано 1 декабря 2021 года.
- ↑ Center for Food Safety and Applied Nutrition. Redbook 2000: IV.C.1. Short-Term Tests for Genetic Toxicity (англ.). U.S. Food and Drug Administration (11 апреля 2019). Дата обращения: 14 января 2022. Архивировано 14 января 2022 года.
- ↑ FMDA, 2011, p. 44.
- ↑ Khambholja & Asudani, 2020.
- ↑ 1 2 Siemieniuk, R. A. C. Drug treatments for covid-19: living systematic review and network meta-analysis : [англ.] / R. A. C. Siemieniuk, J. J. Bartoszko, L. Ge … [et al.] // BMJ. — 2020. — Vol. 370 (30 July). — M2980. — ISSN 1756-1833. — doi:10.1136/bmj.m2980. — PMID 32732190. — PMC 7390912.
- ↑ FMDA, 2011, p. 1,172.
- ↑ Gatherer D. The 2014 Ebola virus disease outbreak in West Africa (англ.) // Journal of General Virology[англ.]. — Microbiology Society[англ.], 2014. — August (vol. 95, no. Pt 8). — P. 1619—1624. — doi:10.1099/vir.0.067199-0. — PMID 24795448.

- ↑ Smither S. J. et al. Post-exposure efficacy of oral T-705 (Favipiravir) against inhalational Ebola virus infection in a mouse model (англ.) // Antiviral Research[англ.]. — 2014. — April (vol. 104). — P. 153—155. — doi:10.1016/j.antiviral.2014.01.012. — PMID 24462697.
- ↑ Cohen J. Results from encouraging Ebola trial scrutinized : [англ.] : [арх. 19 февраля 2020] // Science Insider. — 2015. — 26 February. — doi:10.1126/science.aaa7912.
- ↑ Khambholja & Asudani, 2020, Table 1.
- ↑ Сыраева Г. И., Колбин А. С., Сергеева Т. А., Мишинова C. А. Регистрация сообщений о нежелательных лекарственных реакциях при лечении COVID-19 в Российской Федерации и США. (Ru) // Клин фармакол тер 2022; 31(1). — 2022. — С. 91—96.
- ↑ Sirayeva GI, Kolbin AS, Sergeeva TA, Mishinova SA. Reporting of drug adverse reactions during treat ment of COVID-19 in the Russian Federation and the United States. ((Russ.)) // Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2022; 31(1). — 2022. — С. 91—96. — doi:10.32756/0869-5490-2022-1-91-96.
- ↑ Zhejiang Hisun Pharma gets approval for clinical trial to test flu drug Favipiravir for pneumonia caused by new coronavirus Архивная копия от 18 марта 2020 на Wayback Machine. Reuters Healthcare, February 16, 2020.
- ↑ Fujifilm Announces the Start of a Phase III Clinical Trial of Influenza Antiviral Drug Avigan (favipiravir) on COVID-19 in Japan and Commits to Increasing Production (англ.). Drugs.com. Дата обращения: 12 апреля 2020. Архивировано 28 июля 2020 года.
- ↑ Coronavirus, il Veneto sperimenta l'antivirale giapponese Favipiravir. Ma l'Aifa: "Ci sono scarse evidenze scientifiche su efficacia" (итал.). Il Fatto Quotidiano (22 марта 2020). Дата обращения: 23 марта 2020. Архивировано 14 июля 2020 года.
- ↑ Яланская А. Что известно о зарегистрированном для лечения COVID-19 препарате «Авифавир» : [арх. 3 июня 2020] / Анастасия Яланская // Парламентская газета. — 2020. — 1 июня.
- ↑ «Р-Фарм» и «Промомед» начали КИ фавипиравира от COVID-19. Vademecum (22 мая 2020). Дата обращения: 29 июня 2020. Архивировано 25 июня 2020 года.
- ↑ COVID-19 : Informal consultation on the potential inclusion of Favipiravir in a clinical trial : Draft : [англ.] : [арх. 30 июля 2020]. — Geneva : WHO, 2020. — 10 April. — 19 p. — (WHO R&D Blueprint).
- ↑ Retraction Note: Safety and efficacy of favipiravir versus hydroxychloroquine in management of COVID-19: A randomised controlled trial // Nature Public Health Emergency Collection. — 2021. — 1 сентября. — doi:10.1038/s41598-021-85227-0. Архивировано 7 апреля 2022 года.
- ↑ д.м.н. М.Ю. Дробижев. COVID-19. Выбираем фавипиравир или флувоксамин. Психфарм ТВ. Дата обращения: 6 марта 2022. Архивировано 6 марта 2022 года.
- ↑ Guinea: Clinical Trial for Potential Ebola Treatment Started in MSF Clinic in Guinea. AllAfrica – All the Time. Дата обращения: 28 декабря 2014. Архивировано 23 марта 2016 года.
- ↑ Sissoko D, Laouenan C, Folkesson E, et al. (March 2016). "Experimental Treatment with Favipiravir for Ebola Virus Disease (the JIKI Trial): A Historically Controlled, Single-Arm Proof-of-Concept Trial in Guinea". PLOS Medicine. 13 (3): e1001967. doi:10.1371/journal.pmed.1001967. PMC 4773183. PMID 26930627.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Fink S (4 февраля 2015). "Ebola Drug Aids Some in a Study in West Africa". The New York Times. Архивировано 8 ноября 2020. Дата обращения: 4 декабря 2020.
- ↑ Cohen, Jon (26 февраля 2015). "Results from encouraging Ebola trial scrutinized". Science. doi:10.1126/science.aaa7912. Архивировано 19 февраля 2020. Дата обращения: 21 января 2016.
- ↑ «Это препарат для экстремальных ситуаций». «Известия»: у препарата от COVID-19 обнаружили новые побочные эффекты. Дата обращения: 26 февраля 2022. Архивировано 26 февраля 2022 года.
- ↑ «Это бизнес, это не имеет отношения к науке и фармацевтике»: доктор медицины о препарате от COVID-19 : [видео]. : [арх. 29 сентября 2020] // Навальный Лайф. — 2020. — 25 сентября.
Литература
[править | править код]- Khambholja, K. Potential repurposing of Favipiravir in COVID-19 outbreak based on current evidence : [англ.] / Kapil Khambholja, Deepak Asudani // Travel Medicine and Infectious Disease. — 2020. — Vol. 35. — P. 101710. — 2 p. — ISSN 1477-8939. — doi:10.1016/j.tmaid.2020.101710. — PMID 32360327. — PMC 7252084.
- Report on the deliberation results – avigan : [англ.] / Evaluation and Licensing Division, Pharmaceutical and Food Safety Bureau. — Japan : Pharmaceuticals and Medical Devices Agency, 2011. — 172 p.
Ссылки
[править | править код]- Регистрационное удостоверение ЛП-006225 : Авифавир // Государственный реестр лекарственных средств. — Минздрав РФ, 2020. — 29 мая.
- Регистрационное удостоверение ЛП-006288 : Арепливир // Государственный реестр лекарственных средств. — Минздрав РФ, 2020. — 23 июня.
- Блинов, А. А. Инструкция по медицинскому применению лекарственного препарата Авифавир : ЛП-006225-290520 / ООО «Кромис». — Министерство здравоохранения Российской Федерации, 2020. — 29 мая. — 8 с.
- Drug Name: Favipiravir [USAN:INN:JAN] (англ.). Drug Information Portal. U. S. National Library of Medicine.


 French
French Deutsch
Deutsch