Дыхательная цепь переноса электронов — Википедия
Дыхательная цепь переноса электронов, также электрон-транспортная цепь (сокр. ЭТЦ, англ. ETC, Electron transport chain) — система трансмембранных белков и переносчиков электронов, необходимых для поддержания энергетического баланса. ЭТЦ поддерживает баланс за счёт переноса электронов и протонов из НАД∙Н и ФАДН2 в акцептор электронов. В случае аэробного дыхания акцептором может быть молекулярный кислород (О2). В случае анаэробного дыхания акцептором могут быть NO3−, NO2−, Fe3+, фумарат, диметилсульфоксид, сера, SO42−, CO2 и т. д. ЭТЦ у прокариот локализована в ЦПМ, у эукариот — на внутренней мембране митохондрий.[1] Переносчики электронов расположены в порядке увеличения сродства к электрону, то есть по своему окислительно-восстановительному потенциалу, где у акцептора самое сильное сродство к электрону. Поэтому транспорт электрона на всём протяжении цепи протекает самопроизвольно с выделением энергии. Выделяющаяся энергия расходуется на перенос протонов (H+) через мембрану (см. Протонный насос), в результате чего на мембране наводится электрохимический градиент (протонный потенциал). Протонный потенциал преобразуется АТФ-синтазой в энергию химических связей АТФ. Сопряжённая работа ЭТЦ и АТФ-синтазы носит название окислительного фосфорилирования.
Цепь переноса электронов митохондрий
[править | править код]
В митохондриях эукариот цепь переноса электронов начинается с окисления НАДН и восстановления убихинона Q комплексом I. Далее комплекс II окисляет сукцинат до фумарата и восстанавливает убихинон Q. Убихинон Q окисляется и восстанавливается цитохром с комплексом III. В конце цепи комплекс IV катализирует перенос электронов с цитохрома с на кислород с образованием воды. В результате реакции, на каждые условно выделившиеся 6 протонов и 6 электронов выделяются 2 молекулы воды за счёт траты 1 молекулы О2 и 10 молекул НАД∙Н.
НАДН-дегидрогеназный комплекс
[править | править код]Основная статья: НАДН-дегидрогеназный комплекс
Комплекс I (НАДН-дегидрогеназный комплекс) окисляет НАД-Н. Этот комплекс играет центральную роль в процессах клеточного дыхания и окислительного фосфорилирования. Почти 40 % протонного градиента необходимого для синтеза АТФ создаются именно этим комплексом[2]. НАДН-дегидрогеназный комплекс отбирает у НАДН два электрона и переносит их на кофермент Q. Другими словами, комплекс I окисляет НАДН и восстанавливает одну молекулу кофермента Q, которая высвобождается во внутреннюю мембрану митохондрии (у эукариотов). Поскольку кофермент Q растворим в липидах, он затем свободно диффундирует по мембране к комплексу III. Вместе с тем, на каждую окисленную молекулу НАДН комплекс переносит через мембрану (из матрикса в межмембранное пространство[англ.] митохондрии) четыре протона.
Кофакторы
[править | править код]
Все простетические группы НАДН-дегидрогеназного комплекса (один флавинмононуклеотид (ФАД) и от 8 до 9 железосерных кластеров) находятся в периферическом водорастворимом домене. У млекопитающих, как и у всех позвоночных, их восемь[3]. Семь кластеров образуют электрон-транспортную цепь длинной в ~96 Å от ФМН до места связывания убихинона. На основе современных данных считается, что перенос электрона происходит по следующему пути: НАДН → ФМН → N3 → N1b → N4 → N5 → N6a → N6b → N2 → Q.
Сначала происходит передача двух электронов на флавин, а затем они по одному передаются через цепочку кластеров к сайту связывания хинона и восстанавливают его до состояния Q−2. Кластер N1a располагается недалеко от флавинового кофактора и на некотором расстоянии от магистральной цепи переноса электрона. Этот кластер высококонсервативен у разных видов; полагают, что он осуществляет контроль скорости транспорта электрона внутри комплекса, перебрасываясь электроном с ФМН[4]. Существует модель, согласно которой один из электронов с флавина идёт по магистральному пути на хинон, а другой запасается в кластере N1a и позже возвращается в основную цепь, через флавосемихинон. Возможно, такой механизм позволяет снизить образование активных форм кислорода на восстановленном флавине. К тому же, это позволяет стабилизировать (до миллисекунды) состояние, когда последний кластер N2 восстановлен, но нет второго электрона, чтобы завершить восстановление убихинона. Такое состояние может быть необходимым для конформационных изменений, сопряжённых с транспортом протонов.
Часть кластеров в цепи (N3, N4 и N6a) имеют высокий окислительно-восстановительный потенциал(редокс-потенциал) на уровне —0,25 В, в то время как три других (N1b, N5 и N6b) имеют более низкие потенциалы. В результате редокс-потенциал на пути электрона меняется наподобие американских горок. Такая кривая изменения энергетического состояния характерна для многих окислительно-восстановительных ферментов: она позволяет оптимизировать скорость транспорта электрона и добиться эффективного переноса энергии[4].
Кластер N5 имеет очень низкий потенциал и лимитирует скорость общего потока электронов по всей цепи. Вместо обычных для железосерных центров лигандов (четырёх остатков цистеина) он скоординирован тремя остатками цистеина и одним остатком гистидина, а также окружён заряженными полярными остатками, хотя и находится в глубине фермента[4].
Необычные лиганды имеет и терминальный кластер цепи — N2. Его редокс-потенциал самый высокий из всех кластеров (от —0,1 до —0,15 В). Он связан с четырьмя последовательно расположенными в полипептидной цепи остатками цистеина, что создаёт напряжённую конформацию. Из-за этого при его восстановлении происходят конформационные изменения соседних цепей, возможно, связанные с транспортом протона[4].
Кластер N7 присутствует только в комплексе I некоторых бактерий. Он значительно удалён от остальных кластеров и не может обмениваться с ними электронами, так что по-видимому, является реликтом. В некоторых бактериальных комплексах, родственных комплексу I, между N7 и остальными кластерами обнаружены четыре консервативных остатка цистеина, а комплексе I бактерии Aquifex aeolicus был обнаружен дополнительный Fe4S4 кластер, соединяющий N7 с остальными кластерами. Из этого следует вывод, что у A. aeolicus комплекс I, кроме НАДН, может использовать иной донор электронов, который передаёт их через N7[5].
Реакция
[править | править код]НАДН-дегидрогеназный комплекс окисляет НАДН, образовавшийся в матриксе в ходе цикла трикарбоновых кислот. Электроны от НАДН используются для восстановления мембранного переносчика, убихинона Q, который переносит их к следующему комплексу электрон-транспортной цепи митохондрий, комплексу III или цитохром-bc1-комплексу [21].
НАДН-дегидрогеназный комплекс работает как протонная помпа: на каждый окисленный НАДН и восстановленный Q через мембрану в межмембранное пространство перекачиваются четыре протона[6]:
- НАДН + H+ + Q + 4H+in → НАД+ + QH2 + 4H+out
Образовавшийся в ходе реакции электрохимический потенциал используется для синтеза АТФ. Реакция, катализируемая комплексом I, обратима, этот процесс называется аэробное сукцинат-индуцированное восстановление НАД+. В условиях большого потенциала на мембране и избытка восстановленных убихинолов комплекс может восстанавливать НАД+ с использованием их электронов и пропускать протоны обратно в матрикс. Этот феномен обычно наблюдается, когда много сукцината, но мало оксалоацетата или малата. Восстановление убихинона осуществляется ферментами сукцинатдегидрогеназой, глицерол-3-фосфатдегидрогеназой[англ.] или митохондриальной дигидрооротатдегидрогеназой[англ.]. В условиях высокого протонного градиента сродство комплекса к убихинолу повышается, а редокс-потенциал убихинола снижается благодаря росту его концентрации, что и делает возможным обратный транспорт электронов по электрическому потенциалу внутренней мембраны митохондрий к НАД[7]. Данный феномен удалось наблюдать в лабораторных условиях, но неизвестно, имеет ли он место в живой клетке.
Механизм транспорта протонов
[править | править код]
На начальных этапах исследования комплекса I широко обсуждалась модель, основанная на предположении, что в комплексе оперирует система, похожая на Q-цикл[англ.]. Однако позднейшие исследования не обнаружили в комплексе I каких-либо внутренне связанных хинонов и полностью опровергли эту гипотезу[8].

НАДН-дегидрогеназный комплекс, по-видимому, имеет уникальный механизм транспорта протонов посредством конформационных изменений самого фермента. Субъединицы ND2, ND4 и ND5 называются антипорт-подобными, поскольку они гомологичны друг другу и бактериальным Mrp Na+/H+ антипортам. Эти три субъединицы образуют три основных протонных канала, которые состоят из консервативных остатков заряженных аминокислот (в основном лизина и глутамата). Четвёртый протонный канал образован частью субъединицы Nqo8 и малыми субъединицами ND6, ND4L и ND3. Канал сходен по строению с аналогичными каналами антипорт-подобных субъединиц, но содержит необычно много плотно упакованных остатков глутамата со стороны матрикса, за что и получил название E-канал (латинское E используется как стандартное обозначение глутамата). От С-конца субъединицы ND5 отходит удлинение, состоящее из двух трансмембранных спиралей, соединённых необычно протяжённой (110 Å) α-спиралью[4](HL), которая, проходя по стороне комплекса, обращённой в матрикс, физически соединяет все три антипорт-подобные субъединицы, и возможно, участвует в сопряжении транспорта электронов с конформационной перестройкой. Ещё один сопрягающий элемент, βH, образован серией перекрывающихся β-шпилек и α-спиралей, он расположен на противоположной, периплазматической стороне комплекса[9]. До сих пор окончательно неизвестно, как именно транспорт электронов сопряжён с переносом протонов. Полагают, что мощный отрицательный заряд кластера N2 может расталкивать окружающие полипептиды, вызывая тем конформационные изменения, которые неким образом распространяются на все антипорт-подобные субъединицы, расположенные довольно далеко друг от друга. Другая гипотеза предполагает, что изменение конформации вызывает в необычно длинном сайте связывания убихинона стабилизированный убихинол Q−2 с крайне низким редокс-потенциалом и отрицательным зарядом. Неизвестными остаются и многие детали кинетики конформационных изменений и сопряжённого с ними транспорта протонов[9].
Ингибиторы
[править | править код]Наиболее изученный ингибитор комплекса I — ротенон (широко применяемый как органический пестицид). Ротенон и ротеноиды — это изофлавоноиды, которые присутствуют в корнях нескольких родов тропических растениях таких как Антония (Loganiaceae), Derris и Lonchocarpus (Fabaceae). Ротенон давно используется как инсектицид и рыбный яд, так как митохондрии насекомых и рыб особенно к нему чувствительны. Известно, что коренные жители Французской Гвианы и другие индейцы Южной Америки использовали ротенон-содержащие растения для рыболовства уже в XVII веке[10]. Ротенон взаимодействует с сайтом связывания убихинона и конкурирует с основным субстратом. Было показано, что долгосрочное системное подавление комплекса I ротеноном может индуцировать селективное отмирание дофаминергических нейронов (секретирующих в качестве нейротрансмиттера дофамин)[11]. Схожим образом действует и пиерицидин А, ещё один мощный ингибитор комплекса I, структурно схожий с убихиноном. К этой же группе относится и амитал натрия — производное барбитуровой кислоты[12].
Несмотря на более чем 50-летнее изучение комплекса I, так и не удалось обнаружить ингибиторы, блокирующие перенос электронов внутри комплекса. Гидрофобные ингибиторы, такие как ротенон или пиерицидин, просто прерывают перенос электрона с терминального кластера N2 на убихинон[11].

Ещё одно вещество, блокирующее комплекс I — это аденозиндифосфатрибоза, конкурентный ингибитор[англ.] в реакции окисления НАДН. Он связывается с ферментом в сайте связывания нуклеотида (ФАД)[13].
К одним из самых сильных ингибиторов комплекса I относится семейство ацетогенинов. Показано, что эти вещества образуют химические сшивки с субъединицей ND2, что косвенно указывает на роль ND2 в связывании убихинона[14]. Ацетогенин роллиниастатин-2 стал первым из обнаруженных ингибиторов комплекса I, который связывается в другом месте, нежели ротенон[15].
Умеренным ингибиторным эффектом обладает антидиабетический препарат метформин; по-видимому, данное свойство препарата лежит в основе механизма его действия[16].
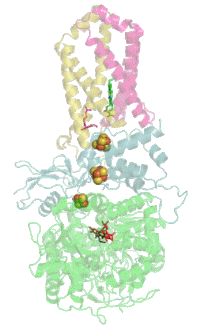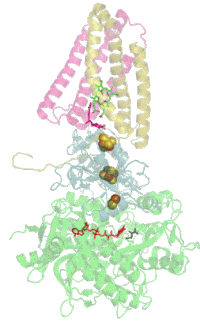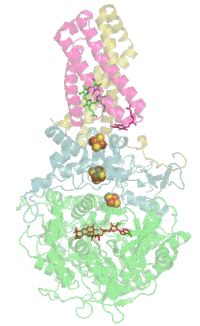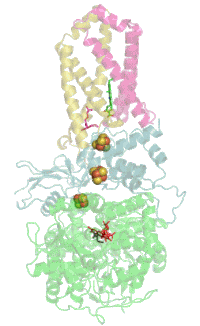
Сукцинатдегидрогеназа
[править | править код]Основная статья: Сукцинатдегидрогеназа
| Сукцинатдегидрогеназа | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | нет данных[заполнить] |
Механизм реакции
[править | править код]Комплекс II окисляет сукцинат до фумарата и восстанавливает убихинон:
- Сукцинат + Q → Фумарат + QH2
Электроны от сукцината сначала переносятся на ФАД, а затем через Fe-S кластеры на Q. Электронный транспорт в комплексе не сопровождается генерацией протонного градиента. Образовавшиеся при окислении сукцината 2H+ остаются на той же стороне мембраны, то есть в матриксе, и затем снова поглощаются при восстановлении хинона. Таким образом комплекс II не вносит вклада в создание протонного градиента на мембране и работает только как переносчик электронов от сукцината к убихинону[17][18].
Окисление сукцината
[править | править код]

О точном механизме окисления сукцината известно довольно мало. Рентгеноструктурный анализ выявил, что ФАД, глутамат-255, аргинин-286, и гистидин-242 субъединицы A могут быть кандидатами для осуществления реакции депротонирования. Существует два возможных механизма этой реакции элиминирования (отщепления): E2 и E1cb. В случая E2 — это согласованный механизм. Основные остатки или кофактор депротонируют альфа углерод, а ФАД принимает гидрид-анион от бета углерода, окисляя сукцинат до фумарата. В случае механизма E1cb, прежде чем ФАД присоединит гидрид-анион, образуется енольная форма сукцината. Что бы определить какой механизм имеет место на самом деле, требуется провести дополнительные исследования сукцинатдегидрогеназы.
После завершения реакции фумарат, который слабо связан с активным центром фермента, легко диссоциирует. Существуют данные из которых следует, что цитозольный субстратсвязывающий домен сукцинатдегидрогеназы претерпевает конформационные изменения: после ухода продукта фермент находится в открытом виде, а связав новый субстрат, переходит в закрытое состояние, плотно смыкаясь вокруг него[19].
Перенос электронов
[править | править код]

В результате окисления сукцината его электроны переносятся на ФАД, а затем передаются по цепи из железосерных кластеров от кластера [Fe-S] к [3Fe-4S]. Там эти электроны переносятся на ожидающую в сайте связывания молекулу убихинона.
Восстановление убихинона
[править | править код]В активном сайте убихинон стабилизирован за счёт водородных связей между его карбонильным атомом кислорода в первом положении и тирозином-83 субъединицы D. Переход электронов на железосерный кластер [3Fe-4S] заставляет убихинон перейти в другое положение. В результате образуется вторая водородная связь между карбонильной группой убихинона в четвёртом положении и серином-27 субъединицы C. После того как в процессе восстановления убихинон принимает первый электрон, он превращается в активный радикал семихинон, который после связывания второго электрона от [3Fe-4S] кластера полностью восстанавливается до убихинола[20].
Гем b
[править | править код]Хотя точная функция гема сукцинатдегидрогеназы всё ещё не известна, некоторые исследователи утверждают, что первый электрон, поступающий к убихинону через [3Fe-4S] может быстро перемещаться вперёд-назад между гемом и связанным убихиноном. Таким образом гем играет роль стока электронов, предотвращая их взаимодействие с молекулярным кислородом, которое привело бы к образованию активных форм кислорода.
Так же есть предположение, что для того что бы не давать электрону напрямую попадать с [3Fe-4S] кластера на гем действует специальный воротный механизм. Вероятный кандидат на роль ворот — гистидин-207 субъединицы B, который расположен прямо между железосерным кластером и гемом, неподалёку от связанного убихинона, вероятно, он может управлять потоком электронов между этими редокс-центрами[20].
Ингибиторы
[править | править код]Существует два класса ингибиторов комплекса II: одни блокируют карман для связывания сукцината, а другие — карман для связывания убихинола. К ингибиторам, имитирующем убихинол, относятся карбоксин и теноилтрифторацетон. К ингибиторам-аналогам сукцината принадлежит синтетическое соединение малонат, а также компоненты цикла Кребса, малат и оксалоацетат. Интересно, что оксалоацетат является одним из самых сильных ингибиторов комплекса II. По какой причине обычный метаболит цикла трикарбоновых кислот ингибирует комплекс II остаётся не ясным, хотя предполагают, что таким образом он может выполнять защитную роль, сводя к минимуму обратный транспорт электронов в комплексе I, в результате которого происходит образование супероксида[21].
Ингибиторы, имитирующие убихинол, использовались как фунгициды в сельском хозяйстве начиная с 1960-х годов. Например, карбоксин в основном использовался для заболеваний вызванных базидиомицетами, такими как стеблевы ржавчины и заболевания вызванные Rhizoctonia. В последнее время им на смену пришли другие соединения с более широким спектром подавляемых патогенов. К таким соединениям относятся боскалид, пентиопирад и флуопирам[22]. Некоторые сельскохозяйственно значимые грибы не восприимчивы к действию этого нового поколения ингибиторов[23].
Цитохром-bc1-комплекс
[править | править код]| Убихинол-цитохром с-оксидоредуктаза | |
|---|---|
![Структура митохондриальной убихинол-цитохром с-оксидоредуктазы в комплексе с убихиноном[24].](http://upload.wikimedia.org/wikipedia/commons/thumb/7/70/Cytochrome1ntz.PNG/250px-Cytochrome1ntz.PNG) Структура митохондриальной убихинол-цитохром с-оксидоредуктазы в комплексе с убихиноном[24]. | |
| Идентификаторы | |
| Шифр КФ | нет данных[заполнить] |
Основная статья: Цитохром-bc1-комплекс
Цитохро́м-bс1-ко́мплекс (комплекс цитохромов bc1) или убихинол-цитохром с-оксидоредуктаза, или комплекс III — мультибелковый комплекс дыхательной цепи переноса электронов и важнейший биохимический генератор протонного градиента на мембране митохондрий. Этот мультибелковый трансмембранный комплекс кодируется митохондриальным (цитохром b) и ядерным геномами[25].
Комплекс III был выделен из митохондрий сердца быка, цыпленка, кролика и митохондрий дрожжей. Он присутствует в митохондриях всех животных, растений и всех аэробных эукариот, а также на внутренней мембранах большинства эубактерий. Известно, что комплекс образует в целом 13 белковых петель, пересекающих мембрану[25].
Реакция
[править | править код]
Цитохром-bс1-комплекс окисляет восстановленный убихинон и восстанавливает цитохром c (Е°'=+0,25 В) согласно уравнению:
QH2 + 2 цит. с+3 + 2Н+внут →Q + 2 цит. с+2 + 4H+out
Электронный транспорт в комплексе сопряжен с переносом протонов из матрикса (in) в межмембранное пространство (out) и генерацией на мембране митохондрий протонного градиента. На каждые два электрона, проходящие по цепи переноса от убихинона до цитохрома с, два протона поглощается из матрикса, и ещё четыре высвобождаются в межмембранное пространство. Восстановленный цитохром c движется вдоль мембраны в водной фракции и переносит один электрон к следующему дыхательному комплексу — цитохромоксидазе[26][27].
Q-цикл
[править | править код]События, которые при этом происходят, известны как Q-цикл, который был постулирован Питером Митчеллом в 1976 году. Принцип Q-цикла состоит в том, что перенос Н+ через мембрану происходит в результате окисления и восстановления хинонов на самом комплексе. При этом хиноны соответственно отдают и забирают 2Н+ из водной фазы избирательно с разных сторон мембраны.
В структуре комплекса III есть два центра, или два «кармана», в которых могут связываться хиноны. Один из них, Qout-центр, расположен между железосерным кластером 2Fe-2S и гемом bL вблизи внешней (out) стороны мембраны, обращённой в межмембранное пространство. В этом кармане связывается восстановленный убихинон (QH2). Другой, Qin-карман, предназначен для связывания окисленного убихинона(Q) и расположен вблизи внутренней (in) стороны мембраны, контактирующей с матриксом.

Первая часть Q-цикла
- QH2 связывается в Qout-сайте, окисляется до семихинона (Q•) железосерным центром белка Риске и отдаёт два протона в люмен.
- Восстановленный железосерный центр передаёт один электрон на пластоцианин через цитохром c.
- Q связывается в Qin-сайте.
- Q• передаёт электроны к гему bL цитохрома b по низкопотенциальной ЭТЦ.
- Гем bL передаёт электрон на bH.
- Гем bH восстанавливает Q до состояния Q•.
Вторая часть Q-цикла
- Второй QH2 связывается с Qout-сайтом комплекса.
- Пойдя по высокопотенциальной ЭТЦ, один электрон восстанавливает ещё один пластоцианин. Ещё два протона поступают в люмен.
- По низкопотенциальной ЭТЦ электрон от bH передаётся на Q•, и полностью восстановленный Q2− связывает два протона их стромы, превращаясь в QH2.
- Окисленный Q и восстановленный QH2 диффундируют в мембрану[28].
Необходимым и парадоксальным условием работы Q-цикла является тот факт, что время жизни и состояние семихинонов в двух центрах связывания разное. В Qout-центре Q• нестабилен и действует как сильный восстановитель, способный отдать е- на низкопотенциальный гем by. В Qin-центре образуется относительно долгоживущий Q•−, потенциал которого позволяет ему действовать в качестве окислителя, принимая электроны с гема bH. Ещё один ключевой момент Q-цикла связан с расхождением двух электронов, входящих в комплекс, по двум разным путям. Изучение кристаллической структуры комплекса показало, что позиция 2Fe-2S-центра относительно других редокс-центров может смещаться. Оказалось, что белок Риске имеет подвижный домен, на котором собственно и расположен 2Fe-2S кластер. Принимая электрон и восстанавливаясь, 2Fe-2S центр меняет своё положение, отдаляясь от Qout-центра и гем bL на 17 Å с поворотом на 60° и тем самым приближаясь к цитохрому c. Отдав электрон цитохрому, 2Fe-2S центр, наоборот, сближается с Qout-центром для установления более тесного контакта. Таким образом, функционирует своеобразный челнок (шаттл), гарантирующий уход второго электрона на гемы bL и bH. Пока это единственный пример, когда электронный транспорт в комплексах связан с подвижным доменом в структуре белка[29].
Активные формы кислорода
[править | править код]Небольшая часть электронов покидает цепь переноса до того как достигнет Комплекса IV. Постоянные утечки электронов на кислород приводят к образованию супероксида. Эта небольшая побочная реакция приводит к образованию целого спектра активных форм кислорода, которые весьма токсичны и играют значительную роль в развитии патологий и старения)[30]. Электронные протечки в основном происходят в Qin-сайте. Этому процессу способствует антимицин A. Он блокирует гемы b в их восстановленном состоянии не давая им сбросить электроны на семихинон Q•, что в свою очередь приводит к повышению его концентрации. Семихинон реагирует к кислородом, что и приводит к образованию супероксида. Образовавшийся супероксид поступает в митохондриальный матрикс и межмембранное пространство, откуда он может попасть в цитозоль. Этот факт можно объяснить тем, что Комплекс III, возможно, производит супероксид в форме незаряженного HOO•, которому легче проникнуть сквозь внешнюю мембрану по сравнению с заряженным Супероксидом (O2-)[31].
Ингибиторы Комплекса III
[править | править код]Все ингибиторы Комплекса III можно разделить на три группы:
- Антимицин A связывается с Qвнут-сайтом и блокирует транспорт электронов от гема bH к окисленному убихинону Q (ингибитор Qin-сайта).
- Миксотиазол и стигмателлин связываются с Qвнеш-сайтом и блокируют перенос электрона с восстановленного QH2 на железосерный кластер белка Риске. Оба ингибитора связываются с Qвнеш-сайтом, но в разных, хотя и перекрывающихся, местах.
- Миксотиазол связывается ближе к гему bL и потому именуется «проксимальным» ингибитором.
- Стигмателлин связывается дальше от гема bL и ближе к белку Риске, с которым он взаимодействует.
Некоторые из этих веществ используются как фунгициды (например, производные стробилурина, наиболее известным из которых является азоксистробин, ингибитор сайта Qвнеш) и противомалярийные препараты (атовакуон)[1].
Цитохром c оксидаза
[править | править код]Основная статья: Цитохром c оксидаза
| Цитохром с-оксидаза | |
|---|---|
 Цитохром с-оксидаза быка. | |
| Идентификаторы | |
| Шифр КФ | нет данных[заполнить] |
Цитохром с оксида́за (цитохромоксидаза) или цитохром с-кислород-оксидоредуктаза, также известная как цитохром aa3 и комплекс IV — терминальная оксидаза аэробной дыхательной цепи переноса электронов, которая катализирует перенос электронов с цитохрома с на кислород с образованием воды[1]. Цитохромоксидаза присутствует во внутренней мембране митохондрий всех эукариот, где её принято называть комплекс IV, а также в клеточной мембране многих аэробных бактерий[32].
Комплекс IV последовательно окисляет четыре молекулы цитохрома с и, принимая четыре электрона, восстанавливает O2 до H2O. При восстановлении O2 четыре H+ захватываются из митохондриального матрикса для образования двух молекул H2O, а ещё четыре H+активно перекачиваются через мембрану. Таким образом, цитохромоксидаза вносит свой вклад в создание протонного градиента для синтеза АТФ и является частью пути окислительного фосфорилирования[33]. Кроме того, этот мультибелковый комплекс играет ключевую роль в регуляции активности всей дыхательной цепи и производстве энергии эукариотической клеткой[34].
Реакция
[править | править код]Комплекс IV цитохром c оксидаза катализирует перенос 4 электронов с 4 молекул цитохрома на O2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди.
Кислород, поступающий в митохондрии из крови, связывается с атомом железа в геме цитохрома a3 в форме молекулы O2. Каждый из атомов кислорода присоединяет по два электрона и два протона и превращается в молекулу воды.
Суммарная реакция, катализируемая комплексом, описывается следующим уравнением:
- 4цит. c2+ + O2 + 8H+in → 4цит. c3+ + 2H2O + 4H+out
Путь электрона в комплексе известен. Цитохром с связывается на субъединице II при посредничестве субъединиц I, III и VIb и восстанавливает CuA-центр, расположенный вблизи поверхности мембраны. С CuA-центра электрон уходит на гем а и далее на биядерный центр a3-CuB, расположенные в толще мембраны. Именно в биядерном центре происходит связывание О2 и его восстановление до Н2О[33]. Поскольку кислород обладает высоким сродством к электронам, то в процессе восстановления до воды он высвобождает большое количество свободной энергии. Благодаря этому аэробные организмы способны получать гораздо большее количество энергии, чем можно выработать исключительно анаэробным способом.
Механизм восстановления кислорода
[править | править код]Механизм восстановления кислорода уже давно является предметом интенсивного изучения, но ясен не до конца. Каталитический цикл цитохромоксидазы состоит из шести стадий, обозначаемых A (аддукт, англ. Adduct)[35], P (пероксиинтермедиат от англ. Peroxy intermediate), F (феррилоксоинтермедиат от англ. Ferryl-oxo intermediate)[35], OH (полностью окисленное высокоэнергетическое состояние от англ. Fully-Oxidized High-Energy state), E (одноэлектронно-восстановленное состояние от англ. One-electron reduced state) и R (восстановленное состояние от англ. Reduced state) и названных так по состоянию биядерного центра[36]. Номенклатура каталитических состояний значительно устарела, не всегда отражает реальное химическое состояние биядерного центра и сохраняется во многом по историческим причинам. Так например, на стадии P кислород в биядерном центре находится совсем не в пероксидой форме, как то полагали 30 лет назад, а в оксоферрильном состоянии, где связь между атомами кислорода уже разорвана[35]. Согласно современным представлениям, восстановление кислорода в цитохром с-оксидазе происходит путём быстрого и полного восстановления с попарным переносом электронов, что исключает образование активных форм кислорода. Происходит следующая последовательность событий[35][37][38]:

- A Полностью восстановленный биядерный центр быстро связывает O2 c образование кислородного аддукта, что приводит к конформационным перестройкам (обозначены тонкими чёрными стрелочками).
- PM Происходит быстрый перенос четырёх электронов на кислород: два поставляются железом гема а3 (FeII→FeIV), ещё один расположенным рядом CuB (CuI→CuII), а четвёртый приходит от остатка тирозина-244, он же отдаёт протон, необходимый для разрыва двойной связи O2. Образовавшийся нейтральный тирозиновый радикал восстанавливается до состояния аниона за счёт электрона от цитохрома с.
- PR Происходит протонирование Cu(II)-OH− с образованием молекулы воды.
- F Образовавшаяся молекула воды связывается с CuB координационной связью. Железо Fe(IV)=О2- восстанавливается до FeIII, а связанный с ним кислород протонируется. Высвобождается первая молекула воды.
- OH Тирозиновый анион протонируется, а CuB восстанавливается до CuI за счёт электрона от цитохрома с.
- EH Железо восстанавливается до FeII, после чего связанная с ним OH- группа протонируется с образованием второй молекулы воды.
- R В этом состоянии биядерный центр полностью восстановлен и комплекс готов к связыванию новой молекулы кислорода.
Механизм транспорта протонов
[править | править код]
Известно, что эукариотическая цитохромоксидаза переносит через мембрану по одному протону на каждый электрон, полученный от цитохрома с. За один раз комплекс закачивает один «субстратный» протон, используемый для образования воды, через канал К и переносит один дополнительный протон через мембрану по каналу D. В ходе одного каталитического цикла акт транслокации приходятся на четыре относительно стабильных стадии: PM, F, OH, и EH.
Точный механизм транспорта протонов до сих пор остаётся не ясным: за последние годы было предложено множество моделей, в которых предпринимались попытки детально описания этого процесса[38]. Не понятно и то, каким образом осуществляется сопряжение энергии электрона с перемещением протонов. Тем не менее, в общем виде это можно описать следующим образом[36]:
- В начальной стадии цикла протонные каналы комплекса закрыты, затем цитохром с передаёт электрон на CuA-центр.
- Электрон быстро перемещается c CuA-центра на гем a, что ведёт к изменению окислительно-восстановительного потенциала и заставляет молекулы воды в канале D переориентироваться, делая его открытым для протона. В результате перемещения электрона с CuA на гем a происходит перемещение протона через канал D и его загрузка в сайт загрузки протона PLS (англ. proton loading site).
- Электрон переходит на биядерный центр к гему a3, в результате чего через канал K входит один субстратный протон. При этом протон в PLS испытывает значительное увеличение его кислотности (с pK=11 до pK=5).
- На завершающей стадии цикла предзагруженный в PLS протон выбрасывается наружу, как полагают, по причине электростатического отталкивания от субстратного протона, который участвует в восстановлении кислорода в биядерном центре.
Ингибиторы
[править | править код]Цианиды, сульфиды, азиды, монооксид углерода и монооксид азота[39] связываются с окисленным или восстановленным биядерным центром фермента и конкурируют с кислородом, ингибируя при этом фермент, что приводит к смерти клеток от химической асфиксии. Метанол, который входит в состав технического спирта, в организме преобразуется в муравьиную кислоту, которая тоже может ингибировать цитохромоксидазу[40].
Влияние окислительного потенциала
[править | править код]Основная статья: Окислительно-восстановительный потенциал
| Восстановитель | Окислитель | Ео´, В |
|---|---|---|
| Н2 | 2H+ | — 0,42 |
| НАД • Н + Н+ | НАД+ | — 0,32 |
| НАДФ • Н + Н+ | НАДФ+ | — 0,32 |
| Флавопротеин (восстановленный) | Флавопротеин (окисленный) | — 0,12 |
| Кофермент Q • Н2 | Кофермент Q | + 0,04 |
| Цитохром B (Fe2+) | Цитохром B (Fe3+) | + 0,07 |
| Цитохром C1 (Fe2+) | Цитохром C1 (Fe3+) | + 0,23 |
| ЦитохромыA (Fe2+) | ЦитохромыA(Fe3+) | + 0,29 |
| ЦитохромыA3 (Fe2+) | Цитохромы A3 (Fe3+) | +0,55 |
| H2O | ½ О2 | + 0,82 |
Система с более низким окислительно-восстановительным потенциалом обладает большей способностью отдавать электроны системе с большим потенциалом. Например, пара НАД•Н+/НАД+ , редокс-потенциал которой равен — 0,32 В будет отдавать свои электроны окислительно-восстановительной паре флавопротеин (восстановл.) / флавопротеин (окислен.), имеющей больший потенциал −0,12 В. Бо́льшая величина редокс-потенциала окислительно-восстановительной пары вода/кислород (+0,82 В) указывает на то, что у этой пары способность отдавать электроны выражена очень слабо[41].
Электрон-транспортные цепи бактерий
[править | править код]Бактерии, в отличие от митохондрий, используют большой набор доноров и акцепторов электронов, а также разные пути переноса электрона между ними. Эти пути могут осуществляться одновременно, например, E.coli при выращивании на среде, содержащей глюкозу в качестве основного источника органического вещества, использует две НАДН дегидрогеназы и две хинолоксидазы, что означает наличие 4 путей транспорта электрона. Большинство ферментов ЭТЦ индуцибельны и синтезируются только в случае, если путь, в который они входят, востребован.
Донором электрона помимо органического вещества у бактерий могут выступать молекулярный водород, угарный газ, аммоний, нитрит, сера, сульфид, двухвалентное железо. Вместо НАДН и сукцинатдегидрогеназы могут присутствовать формиат-, лактат-, глицеральдегид-3-фосфатдегидрогеназа, гидрогеназа и т. д. Вместо оксидазы, использующейся в аэробных условиях, в отсутствие кислорода бактерии могут использовать редуктазы, восстанавливающие различные конечные акцепторы электрона: фумаратредуктазу, нитрат- и нитритредуктазу и т. д.
См. также
[править | править код]- Окислительное фосфорилирование
- НАДН-дегидрогеназный комплекс
- Сукцинатдегидрогеназа
- Цитохром-bc1-комплекс
- Цитохром c оксидаза
- Клеточное дыхание
- АТФ-синтаза
- Цепь переноса электронов фотосинтеза
- Обратный транспорт электронов
Примечания
[править | править код]- ↑ 1 2 3 J. H. Holmes, N. Sapeika, H. Zwarenstein. Inhibitory effect of anti-obesity drugs on NADH dehydrogenase of mouse heart homogenates // Research Communications in Chemical Pathology and Pharmacology. — August 1975. — Т. 11, вып. 4. — С. 645—646. — ISSN 0034-5164. Архивировано 23 июня 2018 года.
- ↑ Rouslan G. Efremov, Rozbeh Baradaran, Leonid A. Sazanov. The architecture of respiratory complex I (англ.) // Nature. — 2010/05. — Т. 465, вып. 7297. — С. 441—445. — ISSN 1476-4687. — doi:10.1038/nature09066.
- ↑ Donald Voet, Judith G. Voet. Biochemistry. — Wiley, 2004. — ISBN 047119350X, 9780471193500.
- ↑ 1 2 3 4 5 Leonid A. Sazanov. A giant molecular proton pump: structure and mechanism of respiratory complex I (англ.) // Nature Reviews Molecular Cell Biology. — 2015/06. — Т. 16, вып. 6. — С. 375—388. — ISSN 1471-0080. — doi:10.1038/nrm3997.
- ↑ Rouslan G. Efremov, Leonid A. Sazanov. The coupling mechanism of respiratory complex I — A structural and evolutionary perspective // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — Т. 1817, вып. 10. — С. 1785—1795. — doi:10.1016/j.bbabio.2012.02.015.
- ↑ Ulrich Brandt. Energy Converting NADH: Quinone Oxidoreductase (Complex I) // Annual Review of Biochemistry. — 2006-06-01. — Т. 75, вып. 1. — С. 69—92. — ISSN 0066-4154. — doi:10.1146/annurev.biochem.75.103004.142539. Архивировано 2 мая 2021 года.
- ↑ Vera G. Grivennikova, Alexander B. Kotlyar, Joel S. Karliner, Gary Cecchini, Andrei D. Vinogradov. Redox-dependent change of nucleotide affinity to the active site of the mammalian complex I // Biochemistry. — 2007-09-25. — Т. 46, вып. 38. — С. 10971—10978. — ISSN 0006-2960. — doi:10.1021/bi7009822. Архивировано 20 марта 2018 года.
- ↑ Ермаков, 2005, с. 238.
- ↑ 1 2 Rozbeh Baradaran, John M. Berrisford, Gurdeep S. Minhas, Leonid A. Sazanov. Crystal structure of the entire respiratory complex I (англ.) // Nature. — 2013/02. — Т. 494, вып. 7438. — С. 443—448. — ISSN 1476-4687. — doi:10.1038/nature11871.
- ↑ Moretti C., Grenand P. [The "nivrées", or ichthyotoxic plants of French Guyana] (фр.) // J Ethnopharmacol[англ.]. — 1988. — Сентябрь (т. 6, № 2). — С. 139—160. — doi:10.1016/0378-8741(82)90002-2. — PMID 7132401.
- ↑ 1 2 Watabe M., Nakaki T. Mitochondrial complex I inhibitor rotenone inhibits and redistributes vesicular monoamine transporter 2 via nitration in human dopaminergic SH-SY5Y cells (англ.) // Molecular Pharmocology : journal. — 2008. — July (vol. 74, no. 4). — P. 933—940. — doi:10.1124/mol.108.048546. — PMID 18599602.
- ↑ Ермаков, 2005, с. 237.
- ↑ Zharova T.V., Vinogradov AD. A competitive inhibition of the mitochondrial NADH-ubiquinone oxidoreductase (complex I) by ADP-ribose (англ.) // Biochimica et Biophysica Acta[англ.] : journal. — 1997. — July (vol. 1320, no. 3). — P. 256—264. — doi:10.1016/S0005-2728(97)00029-7. — PMID 9230920.
- ↑ Nakamaru-Ogiso E., Han H., Matsuno-Yagi A., Keinan E., Sinha S.C., Yagi T., Ohnishi T. The ND2 subunit is labeled by a photoaffinity analogue of asimicin, a potent complex I inhibitor. (англ.) // FEBS Letters[англ.] : journal. — 2010. — January (vol. 584, no. 5). — P. 883—888. — doi:10.1016/j.febslet.2010.01.004. — PMID 20074573. — PMC 2836797.
- ↑ Degli Esposti M., Ghelli A., Ratta M., Cortes D., Estornell E. Natural substances (acetogenins) from the family Annonaceae are powerful inhibitors of mitochondrial NADH dehydrogenase (complex I) (англ.) // The Biochemical Journal[англ.] : journal. — 1994. — July (vol. 301). — P. 161—167. — PMID 8037664. — PMC 1137156.
- ↑ Viollet B., Guigas B., Sanz Garcia N., Leclerc J., Foretz M., Andreelli F. Cellular and molecular mechanisms of metformin: an overview (англ.) // Clinical Science (London)[англ.] : journal. — 2012. — March (vol. 122, no. 6). — P. 253—270. — doi:10.1042/CS20110386. — PMID 22117616. Архивировано 23 июля 2018 года.
- ↑ Нельсон, Кокс, 2012, с. 331-333.
- ↑ Ермаков, 2005, с. 240.
- ↑ T.M. Iverson. Catalytic mechanisms of complex II enzymes: A structural perspective // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — Т. 1827, вып. 5. — С. 648—657. — doi:10.1016/j.bbabio.2012.09.008.
- ↑ 1 2 Quang M. Tran, Richard A. Rothery, Elena Maklashina, Gary Cecchini, Joel H. Weiner. The Quinone Binding Site in Escherichia coli Succinate Dehydrogenase Is Required for Electron Transfer to the Heme b (англ.) // Journal of Biological Chemistry. — 2006-10-27. — Vol. 281, iss. 43. — P. 32310—32317. — ISSN 1083-351X 0021-9258, 1083-351X. — doi:10.1074/jbc.M607476200. Архивировано 3 июня 2018 года.
- ↑ Florian L. Muller, Yuhong Liu, Muhammad A. Abdul-Ghani, Michael S. Lustgarten, Arunabh Bhattacharya. High rates of superoxide production in skeletal-muscle mitochondria respiring on both complex I- and complex II-linked substrates // The Biochemical Journal. — 2008-01-15. — Т. 409, вып. 2. — С. 491—499. — ISSN 1470-8728. — doi:10.1042/BJ20071162. Архивировано 20 марта 2018 года.
- ↑ Hervé F. Avenot, Themis J. Michailides. Progress in understanding molecular mechanisms and evolution of resistance to succinate dehydrogenase inhibiting (SDHI) fungicides in phytopathogenic fungi // Crop Protection. — Т. 29, вып. 7. — С. 643—651. — doi:10.1016/j.cropro.2010.02.019.
- ↑ Tiphaine Dubos, Matias Pasquali, Friederike Pogoda, Angèle Casanova, Lucien Hoffmann. Differences between the succinate dehydrogenase sequences of isopyrazam sensitive Zymoseptoria tritici and insensitive Fusarium graminearum strains // Pesticide Biochemistry and Physiology. — Т. 105, вып. 1. — С. 28—35. — doi:10.1016/j.pestbp.2012.11.004.
- ↑ PDB 1ntz; Gao X., Wen X., Esser L., Quinn B., Yu L., Yu C.A., Xia D. Structural basis for the quinone reduction in the bc1 complex: a comparative analysis of crystal structures of mitochondrial cytochrome bc1 with bound substrate and inhibitors at the Qi site (англ.) // Biochemistry : journal. — 2003. — August (vol. 42, no. 30). — P. 9067—9080. — doi:10.1021/bi0341814. — PMID 12885240.
- ↑ 1 2 Ермаков, 2005, с. 240.
- ↑ David M. Kramer, Arthur G. Roberts, Florian Muller, Jonathan Cape, Michael K. Bowman. Q-cycle bypass reactions at the Qo site of the cytochrome bc1 (and related) complexes // Methods in Enzymology. — 2004. — Т. 382. — С. 21—45. — ISSN 0076-6879. — doi:10.1016/S0076-6879(04)82002-0. Архивировано 23 июня 2018 года.
- ↑ Antony R. Crofts. The Cytochrome bc1 Complex: Function in the Context of Structure // Annual Review of Physiology. — 2004-02-12. — Т. 66, вып. 1. — С. 689—733. — ISSN 0066-4278. — doi:10.1146/annurev.physiol.66.032102.150251. Архивировано 14 октября 2019 года.
- ↑ David G. Nicholls, Stuart John Ferguson. Bioenergetics 3. — Gulf Professional Publishing, 2002. — ISBN 0125181213, 9780125181211.
- ↑ Ермаков, 2005, с. 243.
- ↑ Florian L. Muller, Michael S. Lustgarten, Youngmok Jang, Arlan Richardson, Holly Van Remmen. Trends in oxidative aging theories // Free Radical Biology and Medicine. — Т. 43, вып. 4. — С. 477—503. — doi:10.1016/j.freeradbiomed.2007.03.034.
- ↑ Florian L. Muller, Yuhong Liu, Holly Van Remmen. Complex III Releases Superoxide to Both Sides of the Inner Mitochondrial Membrane (англ.) // Journal of Biological Chemistry. — 2004-11-19. — Vol. 279, iss. 47. — P. 49064—49073. — ISSN 1083-351X 0021-9258, 1083-351X. — doi:10.1074/jbc.M407715200. Архивировано 3 июня 2018 года.
- ↑ Elena A. Gorbikova, Ilya Belevich, Mårten Wikström, Michael I. Verkhovsky. The proton donor for O O bond scission by cytochrome c oxidase (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 2008-08-05. — Vol. 105, iss. 31. — P. 10733—10737. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.0802512105. Архивировано 20 марта 2018 года.
- ↑ 1 2 Ермаков, 2005, с. 244.
- ↑ Denis Pierron, Derek E. Wildman, Maik Hüttemann, Gopi Chand Markondapatnaikuni, Siddhesh Aras. Cytochrome c oxidase: Evolution of control via nuclear subunit addition // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — Т. 1817, вып. 4. — С. 590—597. — doi:10.1016/j.bbabio.2011.07.007.
- ↑ 1 2 3 4 Cytochrome c oxidase: Intermediates of the catalytic cycle and their energy-coupled interconversion (англ.) // FEBS Letters. — 2012-03-09. — Vol. 586, iss. 5. — P. 630—639. — ISSN 0014-5793. — doi:10.1016/j.febslet.2011.08.037.
- ↑ 1 2 Home Page of the Molecular Biophysics Group. www.biocenter.helsinki.fi. Дата обращения: 20 марта 2018. Архивировано 6 марта 2016 года.
- ↑ Vivek Sharma, Giray Enkavi, Ilpo Vattulainen, Tomasz Róg, Mårten Wikström. Proton-coupled electron transfer and the role of water molecules in proton pumping by cytochrome c oxidase (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 2015-02-17. — Vol. 112, iss. 7. — P. 2040—2045. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.1409543112. Архивировано 20 марта 2018 года.
- ↑ 1 2 Elisa Fadda, Ching-Hsing Yu, Régis Pomès. Electrostatic control of proton pumping in cytochrome c oxidase // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — Т. 1777, вып. 3. — С. 277—284. — doi:10.1016/j.bbabio.2007.11.010.
- ↑ Jose-Ramon Alonso, Francesc Cardellach, Sònia López, Jordi Casademont, Oscar Miró. Carbon monoxide specifically inhibits cytochrome c oxidase of human mitochondrial respiratory chain // Pharmacology & Toxicology. — September 2003. — Т. 93, вып. 3. — С. 142—146. — ISSN 0901-9928. Архивировано 23 июля 2018 года.
- ↑ Chris E. Cooper, Guy C. Brown. The inhibition of mitochondrial cytochrome oxidase by the gases carbon monoxide, nitric oxide, hydrogen cyanide and hydrogen sulfide: chemical mechanism and physiological significance (англ.) // Journal of Bioenergetics and Biomembranes. — 2008-10-01. — Vol. 40, iss. 5. — P. 533. — ISSN 1573-6881 0145-479X, 1573-6881. — doi:10.1007/s10863-008-9166-6. Архивировано 26 февраля 2018 года.
- ↑ Королёв А. П., Гридина С. Б., Зинкевич Е. П. «Основы биохимии, часть 4: учебное пособие Кемеровского технологического института пищевой промышленности» Кемерово, 2004. Архивная копия от 5 марта 2016 на Wayback Machine- 92с
Литература
[править | править код]- Физиология растений / Под ред. И. П. Ермакова. — М. : Академия, 2005. — 634 с.
- Berg, J, Tymoczko, J, and L Stryer. Biochemistry. — 6th. — New York: WH Freeman & Company, 2006. — P. 509–513.
- Дэвид Л. Нельсон, Майкл М. Кокс. Основы биохимии Ленинджера. Биоэнергетика и метаболизм = Leninger Principles of Biochemistry. — М. : Бином. Лаборатория знаний, 2012. — Т. 2. — 692 с. — ISBN 978-5-94774-365-4.
Ссылки
[править | править код]- MRC MBU Sazanov group
- Complex I home page at The Scripps Research Institute
- MeSH Electron+Transport+Complex+I
- Instituto Gulbenkian de Ciência & Universidade Nova de Lisboa. Heme-copper oxygen reductases (HCOs) classifier (2009—2010).
- UMich Orientation of Proteins in Membranes families/superfamily-4
- MeSH Cytochrome-c+Oxidase
- cytochrome bc1 complex site (Antony R. Crofts) at uiuc.edu
- UMich Orientation of Proteins in Membranes families/superfamily-3 — Calculated positions of bc1 and related complexes in membranes
- MeSH Coenzyme+Q-Cytochrome-c+Reductase
- Instituto Gulbenkian de Ciência & Universidade Nova de Lisboa. Heme-copper oxygen reductases (HCOs) classifier (2009—2010).
- UMich Orientation of Proteins in Membranes families/superfamily-4
- [1]MeSH Cytochrome-c+Oxidase


 French
French Deutsch
Deutsch