Bromtymolblått – Wikipedia
| Bromtymolblått | |
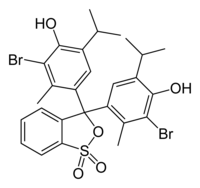  | |
| Systematiskt namn | 3,3-bis[3-brom-4-hydroxy-2-methyl-5-(propan-2-yl)fenyl]-2,1λ6-benzoxatiol-1,1(3H)-dion |
|---|---|
| Kemisk formel | C27H28Br2O5S |
| Molmassa | 624,38 g/mol |
| CAS-nummer | 76-59-5 |
| SMILES | Brc1c(O)c(cc(c1C)C3(OS(=O)(=O)c2ccccc23)c4cc(c(O)c(Br)c4C)C(C)C)C(C)C |
| Egenskaper | |
| Densitet | 1,25 g/cm³ |
| Löslighet (vatten) | Svårlösligt i olja, men lösligt i vatten, eter och vattenlösningar av alkalier.[1] g/l |
| Smältpunkt | 202 °C |
| Faror | |
| Huvudfara |  |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |

Bromtymolblått (även känt som bromtymolsulfonftalein och BTB) är ett färgämne som ofta används för att i en vattenlösning indikera surhetsgrad, pH, där man utnyttjar att bromtymolblått byter färg vid neutralt pH. Det används mest i applikationer som kräver mätning av ämnen som har ett relativt neutralt pH (nära 7). En vanlig användning är för att mäta närvaron av kolsyra i en vätska. Det säljs vanligtvis i fast form som natriumsaltet av syraindikatorn.
Struktur och egenskaper
[redigera | redigera wikitext]Bromtymolblått fungerar som en svag syra i en lösning. Det kan alltså vara i protonerad eller deprotonerad form, och visas gult respektive blått. Det är ljust akvamarin i sig och grönblått i en neutral lösning. Deprotoneringen av den neutrala formen resulterar i en mycket konjugerad struktur, vilken står för skillnaden i färg. En mellanprodukt av deprotoneringsmekanismen är orsak till den grönaktiga färgen i neutral lösning.[2]
Den protonerade formen av bromtymolblått har sin maximala absorption vid 427 nm och transmitterar således gult ljus i sura lösningar, medan den deprotonerade formen har sin maximala absorption vid 602 nm och transmitterar således blått ljus i mer basiska lösningar.[3] Däremot är starkt surt bromtymolblått magentafärgat. Det allmänna kolskelettet av bromtymolblått är gemensamt för många indikatorer som klorfenolrött, tymolblått och bromokresolgrönt.[2] Närvaron av en måttlig elektronbortdragande grupp (bromatom) och två måttliga donerande grupper (alkylsubstituenter) är orsak till bromtymolblåtts aktiva indikationsområde från ett pH på 6,0 till 7,6. Även om konjugationen orsakar längden och naturen av färgändringsintervallet, är dessa substituentgrupper ytterst orsaken till indikatorns aktiva intervall.[2]

Bromtymolblått är svårlösligt i olja, men lösligt i vatten, eter och vattenlösningar av alkalier. Det är mindre lösligt i opolära lösningsmedel som bensen, toluen och xylen, och praktiskt taget olösligt i petroleumeter.[1]
Syntes och preparering
[redigera | redigera wikitext]Bromtymolblått syntetiseras genom tillsats av elementärt brom till tymolblått i en lösning i isättika.[5] För att förbereda en lösning för användning som pH-indikator, lös 0,10 g i 8,0 cm3 N/50 (alias 0,02 normal) NaOH och späd med vatten till 250 cm3. För att förbereda en lösning för användning som indikator vid volymetriskt arbete, lös upp 0,1 g i 100 cm3 50-procentig etanol.[1]
Användning
[redigera | redigera wikitext]
Bromtymolblått kan användas för att observera fotosyntetiska aktiviteter, eller som en andningsindikator (blir gul när CO2 tillsätts).[6][7] En vanlig demonstration av BTB:s pH-indikatoregenskaper innebär att man andas ut genom ett rör till en neutral lösning av BTB. När CO2 absorberas från andningen in i lösningen bildas kolsyra och ändrar lösningens färg från grön till gul. Således används BTB vanligtvis i undervisning i naturvetenskap för att visa att ju mer musklerna används, desto större CO2-utsläpp.
Bromtymolblått har använts i kombination med fenolrött för att övervaka svampasparaginasenzymaktiviteten, där fenolrött blir rosa och bromtymolblått blir blått, vilket signalerar en ökning av pH och därför enzymaktivitet.[8] En nyligen genomförd studie tyder emellertid på att metylrött är mer användbart för att bestämma aktivitet på grund av den ljusgula ringen som bildas i zonen för enzymaktivitet.[9] Den kan också användas i laboratoriet som en biologisk objektglasfärg. Vid denna tidpunkt är bromtymol redan blå, och några droppar BTB appliceras på ett vattenskikt. Provet blandas med blå BTB-lösning och fixeras på ett objektglas med ett täckglas. Det används ibland för att bestämma cellväggar eller kärnor under mikroskopet.
Bromtymol används inom obstetrik för att upptäcka för tidig bristning av hinnor.[10] Fostervattnet har typiskt ett pH >7,2, bromotymol blir därför blått när det kommer i kontakt med vätska som läcker från amnion. Eftersom vaginalt pH normalt är surt indikerar den blå färgen närvaron av fostervatten. Testet kan vara falskt positivt i närvaro av andra alkaliska ämnen som blod eller sperma, eller i närvaro av bakteriell vaginos.
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Bromothymol blue, 26 maj 2024.
Noter
[redigera | redigera wikitext]- ^ [a b c] O'Neil, Maryadele J (2006). The Merck Index. Merck Research Laboratory. sid. 1445. ISBN 978-0-911910-00-1
- ^ [a b c] De Meyer, Thierry (March 2014). ”Substituent effects on absorption spectra of pH indicators: An experimental and computational study of sulfonphthaleine dyes”. Dyes and Pigments 102: sid. 241–250. doi:. https://biblio.ugent.be/publication/4353650. Läst 16 mars 2020.
- ^ Nahhal (18 July 2012). ”Thin film optical BTB pH sensors using sol–gel method in presence of surfactants”. International Nano Letters 2 (16): sid. 3. doi:. Bibcode: 2012INL.....2...16E. http://www.inl-journal.com/content/pdf/2228-5326-2-16.pdf. Läst 18 november 2014.
- ^ Klotz, Elsbeth; Doyle, Robert; Gross, Erin; Mattson, Bruce (2011). ”The Equilibrium Constant for Bromothymol Blue: A General Chemistry Laboratory Experiment Using Spectroscopy”. J. Chem. Educ. 88 (5): sid. 637–639. doi:. Bibcode: 2011JChEd..88..637K. https://doi.org/10.1021/ed1007102. Läst 7 februari 2023.
- ^ ”Bromothymol blue”. Bromothymol blue. https://labsupply.co.za/wp-content/uploads/2018/04/bromothymol-blue.pdf.
- ^ Sabnis R. W. (2007). Handbook of Acid-Base Indicators. CRC Press. ISBN 978-0-8493-8218-5
- ^ Sabnis R. W. (2010). Handbook of Biological Dyes and Stains: Synthesis and Industrial Applications (1st). Wiley. ISBN 978-0-470-40753-0
- ^ ”Isolation and screening of L-asparaginase free of glutaminase and urease from fungal sp.”. researchgate.net. 22 August 2016. https://www.researchgate.net/publication/310049378.
- ^ Dhale, Mohan (July 2014). ”A comparative rapid and sensitive method to screen l-asparaginase producing fungi”. Journal of Microbiological Methods 102: sid. 66–68. doi:. PMID 24794733.
- ^ King, Arthur G. (1935-12-01). ”The determination of rupture of the membranes” (på english). American Journal of Obstetrics & Gynecology 30 (6): sid. 860–862. doi:. ISSN 0002-9378. https://www.ajog.org/article/S0002-9378(35)90429-X/abstract.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Bromtymolblått.
Wikimedia Commons har media som rör Bromtymolblått.- J.T.Baker MSDS
- Bromothymol Blue (Sodium Salt) - Sigma Aldrich


 French
French Deutsch
Deutsch