Fytoen – Wikipedia
| Fytoen | |
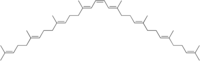 | |
| Systematiskt namn | (6E,10E,14E,16Z,18E,22E,26E)-2,6,10,14,19,23,27,31-oktametyldotriakonta-2,6,10,14,16,18,22,26,30-nonaen |
|---|---|
| Övriga namn | Cis-fytoen |
| Kemisk formel | C40H64 |
| Molmassa | 544,9 g/mol |
| Utseende | Färglös |
| CAS-nummer | 13920-14-4 |
| SMILES | CC(=CCC/C(=C/CC/C(=C/CC/C(=C/C=C\C=C (/C)\CC/C=C(\C)/CC/C=C(\C)/CCC=C(C)C)/C)/C)/C)C |
| SI-enheter & STP används om ej annat angivits | |


Fytoen är en 40-kols tetraterpenoid som utgör det första steget i växternas biosyntes av karotenoider.[1] Det produceras från två molekyler geranylgeranylpyrofosfat (GGPP) under inverkan av enzymet fytoensyntas.[2] De två GGPP-molekylerna kondenseras samman varpå följer ett borttagande av difosfat och ett protonskift, vilket ger fytoen.[3]
Genom födan får människan i sig fytoen och fytofluen som återfinns i många olika vävnader som lever, hjärta och hud.[4] Ackumulation av dessa karotenoider i huden kan skydda denna på flera sätt: som UV-absorbenter, antioxidanter och antiinflammatoriska ämnen.[5][6]
Struktur
[redigera | redigera wikitext]Fytoen är en symmetrisk molekyl som innehåller tre konjugerade dubbelbindningar. Fytoen har ett absorptionsspektrum i UV/visuellt ljus som är typiskt för ett trippelkonjugerat system med maxima i UVB-området vid 277 nm, 286 nm och 300 nm.[7][8] I motsats till andra karotenoider är deras förstadier fytoen och fytofluen färglösa och absorberar i UV-området.
Förekomst
[redigera | redigera wikitext]Analyser av ett flertal frukter och grönsaker har visat att fytoen och fytofluen finns i majoriteten av dem.[9]
Historia
[redigera | redigera wikitext]Fytoens struktur fastställdes och visades genom en fullständig syntes av Basil Weedons grupp 1966.[10]
Referenser
[redigera | redigera wikitext]- ^ ”Carotenoid Biosynthesis”. Arkiverad från originalet den 5 november 2016. https://web.archive.org/web/20161105131635/http://www.chem.qmul.ac.uk/iubmb/enzyme/reaction/terp/carot.html. Läst 20 november 2014.
- ^ ”Phytoene synthase”. Arkiverad från originalet den 28 december 2023. https://web.archive.org/web/20231228000412/https://www.curehunter.com/public/keywordSummaryC073128-phytoene-synthase.do. Läst 20 november 2014.
- ^ Phoi T. Tran, Marina N. Sharifi, Subhajit Poddar, Rachel M. Dent, Krishna K. Niyogi , 2012, Intragenic Enhancers and Suppressors of Phytoene Desaturase Mutations in Chlamydomonas reinhardtii Arkiverad 29 november 2014 hämtat från the Wayback Machine., PLoS ONE 7(8): e42196. doi:10.1371/journal.pone.0042196.
- ^ Khachik F, Carvalho L, Bernstein PS, Muir GJ, Zhao DY, Katz NB. Chemistry, distribution, and metabolism of tomato carotenoids and their impact on human health. Experimental biology and medicine. 2002;227:845-51.
- ^ Aust, W. Stahl, H. Sies, H. Tronnier, U. Heinrich (2005). ”Supplementation with tomato-based products increases lycopene, phytofluene, and phytoene levels in human serum and protects against UV-light-induced erythema”. Int J Vitam Nutr Res. 75 (1): sid. 54–60. doi:. PMID 15830922.
- ^ B. B. Fuller, D. R. Smith, A. J. Howerton, D. Kern (2006). ”Anti-inflammatory effects of CoQ10 and colorless carotenoids”. J. Cos. Derm. 5 (1): sid. 30–38. doi:. PMID 17173569.
- ^ R.K. Hammond D.C. White, 1970, Carotenoid Formation by Staphylococcus aureus Arkiverad 29 november 2014 hämtat från the Wayback Machine., Journal of Bacteriology, July 1970, sid. 191-198.
- ^ ”Figure 3. The colorless carotenoids phytoene and phytofluene absorption spectra”. Arkiverad från originalet den 24 december 2014. https://web.archive.org/web/20141224075053/http://www.cosmeticsandtoiletries.com/articleaddons/215587121.html. Läst 20 november 2014.
- ^ Khachik, F., G.R. Beecher, M.B. Goli, and W.R. Lusby (1991). ”Separation, identifi cation, and quantification of carotenoids in fruits, vegetables and human plasma by high performance liquid chromatography”. Pure & App. Chemistry 63 (1): sid. 71–80. doi:.
- ^ J. B. Davis, L. M. Jackman, P. T. Siddons, B. C. L. Weedon (1966). ”Carotenoids and related compounds. XV. The structure and synthesis of phytoene, phytofluene, zeta-carotene, and neurosporene”. J. Chem. Soc. C: sid. 2154–2165.


 French
French Deutsch
Deutsch