Michaelis–Menten-kinetik – Wikipedia
| Den här artikeln behöver källhänvisningar för att kunna verifieras. (2010-12) Åtgärda genom att lägga till pålitliga källor (gärna som fotnoter). Uppgifter utan källhänvisning kan ifrågasättas och tas bort utan att det behöver diskuteras på diskussionssidan. |
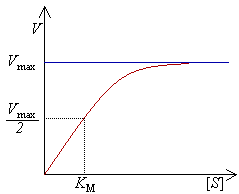
Michaelis–Menten-kinetik beskriver approximativt enzymkinetiken för många enzymer, d.v.s. hur deras arbetstakt är relaterad till koncentrationen av substrat (molekylslag som enzymerna skall omvandla, ofta betecknat "S") och enzymets maximala hastighet (ofta betecknat vmax).
Kinetiken är uppkallad efter biokemisterna Leonor Michaelis och Maud Leonora Menten. Kinetikmodellen är relevant för situationer där väldigt enkel kinetik kan antas, (d.v.s. det finns inga mellansteg, eller inhibering av processen av produkten, samt att det inte förekommer allosteri eller kooperativ bindning). Mer komplexa modeller finns för sådana fall där inte antagandena i Michaelis–Menten-kinetiken längre är tillämpliga.
Michaelis–Menten-ekvationen relaterar initial reaktionshastighet v0 till substratkoncentrationen [S]. Motsvarande graf är en rektangulärt hyperbolisk funktion där maximala hastigheten beskrivs som vmax (en asymptot). KM, kallad Michaelis konstant eller Michaelis-Mentens konstant, anger den substratkoncentration där hastigheten (v) uppgår till halva maxhastigheten för enzymet (d.v.s. v = vmax/2).
Michaelis–Menten-ekvationen beskriver hastigheterna för irreversibla reaktioner. En lösning som gäller vid kemisk jämvikt modellerad med Michaelis–Menten-kinetik, kan fås med Goldbeter–Koshland-ekvationen.
| |||||||||||||||||


 French
French Deutsch
Deutsch![{\displaystyle {\begin{aligned}v_{0}&={\frac {v_{\max }{[}S{]}}{K_{M}+{[}S{]}}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2080a845fd30bd1204e1ca414449256841351b0f)