Анізол — Вікіпедія
| Анізол | |
|---|---|
 |  |
 | |
| Систематична назва | Метоксибензен[1] |
| Інші назви | Метилфеніловий ефір[1] Феноксиметан |
| Ідентифікатори | |
| Номер CAS | 100-66-3 |
| PubChem | 7519 |
| Номер EINECS | 202-876-1 |
| KEGG | C01403 |
| ChEBI | 16579 |
| RTECS | BZ8050000 |
| SMILES | COc1ccccc1 |
| InChI | 1/C7H8O/c1-8-7-5-3-2-4-6-7/h2-6H,1H3 |
| Номер Бельштейна | 506892 |
| Номер Гмеліна | 2964 |
| Властивості | |
| Молекулярна формула | C7H8O |
| Молярна маса | 108,14 г/моль |
| Зовнішній вигляд | Безбарвна рідина |
| Густина | 0.995 г/см3 |
| Тпл | −37°C |
| Розчинність | Нерозчинна |
| Небезпеки | |
| ЛД50 | 3700 мг/кг (щур, перорально) |
| ГГС піктограми |   |
| ГГС формулювання небезпек | 226, 315, 319 |
| ГГС запобіжних заходів | 210, 233, 240, 241, 242, 243, 264, 280, 302+352, 303+361+353, 305+351+338, 321, 332+313, 337+313, 362, 370+378, 403+235, 501 |
| NFPA 704 | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
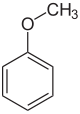
Анізол, або метоксибензен — органічна сполука з хімічною формулою CH3OC6H5. Це безбарвна рідина із запахом, що нагадує насіння анісу, і насправді багато його похідних містяться в природних і штучних ароматизаторах. Сполука в основному виготовляється синтетичним шляхом і є прекурсором інших синтетичних сполук. За структурою це етер (−O−) з приєднаною метильною (−CH3) та фенільною (−C6H5) групами. Анізол є звичним реактивом як для практичного, так і педагогічного значення.[2]
Його можна отримати шляхом реакції Вільямсона; феноксид натрію реагує з галогенідом метилу з утворенням анізолу.
Анізол вступає в реакцію електрофільного ароматичного заміщення більш швидше, ніж бензен, який, у свою чергу, реагує швидше, ніж нітробензен. Підвищена нуклеофільність анізола порівняно з бензеном відображає вплив метоксилової групи, яка робить кільце більш насиченим електронами. Метоксилова група сильно впливає на пі-зв'язок кільця як мезомерний донор електронів, більше, ніж як індуктивна електроно-акцепторна група, незважаючи на електронегативність кисню. Якщо говорити більш кількісно, рівняння Гаммета[en] для пара-заміщення анізолу становить –0,27.
Наочним прикладом проявів його нуклеофільності є те, що анізол реагує з оцтовим ангідридом, утворюючи 4-метоксиацетофенон:
Внаслідок впливу метоксилової групи, на відміну від більшості ацетофенонів, метоксиацетофенон піддається повторному ацетилюванню. Було продемонстровано багато пов'язаних реакцій. Наприклад, пентасульфід фосфору (P4S10) перетворює анізол на реактив Ловессона[en], [(CH3OC6H4)PS2]2.[3]
Також зазначаючи багате електронами кільце, анізол легко утворює π-комплекси з карбонілами металів, наприклад Cr(η6-анізол)(CO)3.[4]
Ефірний зв'язок дуже стабільний, але метильну групу можна видалити за допомогою сильних кислот, таких як йодидна кислота або трихлорид бору:
Відновлення за Берчем анізолу дає 1-метоксициклогекса-1,4-дієн.[5]
Анізол отримують метилюванням натрію феноксиду[en]феноксиду натрію диметилсульфатом або хлорометаном:[6][7]
- 2 C6H5O− Na+ + (CH3O)2SO2 → 2 C6H5OCH3 + Na2SO4
Анізол є прекурсором для парфумів, феромонів комах і фармацевтичних препаратів.[7] Наприклад, синтетичний анетол отримують з анізолу.
Анізол є відносно нетоксичним з LD50 3700 мг/кг у щурів.[8] Його головна небезпека – займистість.[8]
- ↑ а б Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. с. 702—703. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
Anisole, C6H5−O−CH3, is the only name in the class of ethers which is retained both as a preferred IUPAC name and for use in general nomenclature. For preferred IUPAC names, no substitution is allowed; for general nomenclature substitution is allowed on the ring and on the side chain under certain conditions (see P-34.1.1.4).
- ↑ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (вид. 6th), New York: Wiley-Interscience, с. 702—703, ISBN 978-0-471-72091-1
- ↑ I. Thomsen; K. Clausen; S. Scheibye; S.-O. Lawesson (1984). Thiation with 2,4-Bis(4-Methoxyphenyl)-1,3,2,4-Dithiadiphosphetane 2,4-Disulfide: N-Methylthiopyrrolidone. Organic Syntheses. 62: 158. doi:10.15227/orgsyn.062.0158.
- ↑ E. Peter Kündig (2004). Synthesis of Transition Metal η6-Arene Complexes. Topics Organomet Chem. Topics in Organometallic Chemistry. 7: 3—20. doi:10.1007/b94489. ISBN 978-3-540-01604-5.
- ↑ A. J. Birch and K. B. Chamberlain (1977). Tricarbonyl[(2,3,4,5-η)-2,4-Cyclohexadien-1-one]Iron and Tricarbonyl[(1,2,3,4,5-η)-2-Methoxy-2,4-Cyclohexadien-1-yl]Iron(1+) Hexafluorophosphate(1−) from Anisole. Organic Syntheses. 57: 107. doi:10.15227/orgsyn.057.0107.
- ↑ G. S. Hiers and F. D. Hager (1929), Anisole, Org. Synth., 9: 12, doi:10.15227/orgsyn.009.0012
- ↑ а б Helmut Fiege; Heinz-Werner Voges; Toshikazu Hamamoto; Sumio Umemura; Tadao Iwata; Hisaya Miki; Yasuhiro Fujita; Hans-Josef Buysch; Dorothea Garbe; Wilfried Paulus. Phenol Derivatives. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_313. ISBN 978-3527306732.
- ↑ а б MSDS [Архівовано 1 липня 2010 у Wayback Machine.]
- International Chemical Safety Card 1014
- Pherobase pheromone database entry


 French
French Deutsch
Deutsch