Цис–транс ізомерія — Вікіпедія
Було запропоновано приєднати статтю Геометрична ізомерія до цієї статті або розділу, але, можливо, це варто додатково обговорити. Пропозиція з листопада 2024. |


Цис–транс ізомерія, також відома як геометрична ізомерія або конфігураційна ізомерія — це термін, який використовується в органічній хімії, і належить до молекул із однаковою молекулярною формулою та послідовністю зв'язків, але з різним за геометрією розташуванням окремих функціональних груп чи частин молекули.
Префікси «цис-» і «транс-» походять із латини. У хімічному контексті, префікс цис- вказує на те, що функціональні групи знаходяться по одну сторону вуглецевого ланцюга[1] у той час як префікс транс вказує, що функціональні групи знаходяться по різні сторони вуглецевого ланцюга. Цис-транс ізомери — стереоізомери, тобто, це пара молекул, які мають однакові формули, але їхні функціональні групи обернено орієнтовані у тривимірному просторі. Цю ізомерію не слід плутати з E–Z ізомерією, яка є абсолютною у стереохімічному описі, і можуть використовуватися тільки з алкенами. Загалом, стереоізомерні молекули містять або подвійні зв'язки, які запобігають обертанню, або у молекулі можуть бути кільцеві структури, які обмежують, або виключають обертання.[2] Цис- і транс- ізомерія відбувається як в органічних молекулах, так і неорганічних координаційних сполуках. Цис і транс дескриптори не використовуються у випадках конформаційної ізомерії, коли дві геометричних форм легко взаємоперетворюються, наприклад, у відкритому ланцюгу з одинарними зв'язками у структурі; у таких випадках використовується визначники «син» і «анти».
Термін «Геометрична ізомерія» згідно ІЮПАК вважається застарілим синонімом до «цис–транс - ізомерії».[3]
Коли замісники, зорієнтовані в одному напрямку, діастереомер називається цис, тоді як замісники орієнтовані в протилежних напрямках, діастереомер називається транс. Як приклад, на якому легко показати цис-транс-ізомерію, може бути невеликий вуглеводень бут-2-ен.
Ін-ізомер — один з ізомерів біциклічних систем, які мають достатньо довгі містки, що дозволяє екзоциклічним зв'язкам біля голови містка або вільним електронним парам бути спрямованими всередину структури.
Аліциклічні сполуки можуть також підлягати цис-–транс- ізомерії. Як приклад геометричного ізомеру із циклічною структурою, можна розглянути 1,2-дихлорциклогексан:
  |   |
| транс-1,2-дихлорциклогексан | цис-1,2-дихлорциклогексан |
Цис — і транс ізомери часто мають різні фізичні властивості. Відмінності між ізомерами, зазвичай, виникають через відмінності у формі молекули і різний дипольний момент.
 |  |
| цис-2-пентен | транс-2-пентен |
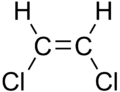 |  |
| цис-1,2-дихлоретен | транс-1,2-дихлоретен |
 |  |
| цис-2-бутендіонова кислота (малеїнова кислоти) | транс-2-бутендіонова кислота (фумарова кислота) |
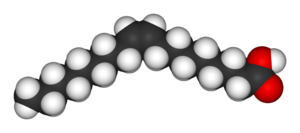 |  |
| Олеїнова кислота | Елаїдинова кислота |
Ці відмінності можуть бути дуже незначними, як у випадку температури кипіння прямого ланцюга алкенів, таких як пент-2-єну, яка становить 37 °С для цис — ізомеру і 36 °C у транс — ізомеру.[4] Відмінність між цис- — і транс - ізомерами може бути більшою, якщо присутні полярні зв'язки, як у випадку із 1,2-дихлоретену. У цьому випадку цис- ізомер має температуру кипіння 60.3 °C, в той час як транс — ізомер — 47,5 °С.[5] У випадку цис- ізомеру два полярні дипольні моменти зв'язків C-Cl разом забезпечують молекулярний диполь, так що з'являються міжмолекулярні диполь–дипольні взаємодії (або сил Keesom), які додаються до дисперсійне сил і це призводить до підвищення температури кипіння. З іншого боку, у транс — ізомеру цього не відбувається, тому що два дипольні моменти зв'язків C−Cl нейтралізовуються і молекула має нульовий диполь (але при цьому не нульовий квадруполь).
Два ізомери бутадіонової кислоти мають такі відмінні властивості і реакційну здатність, що їм дали зовсім різні імена. Цис ізомер називається малеїновою кислотою, а транс — ізомер - фумаровою кислотою. Полярність є ключовим у визначенні відносної точка кипіння, так як це призводить до збільшення міжмолекулярних сил, тим самим підвищуючи температуру кипіння. Таким же чином, симетрія є ключовим у визначенні відносної температури плавлення, так як дозволяє краще пакувати в твердому стані, навіть якщо він не змінює полярність молекули. Одним з прикладів такої взаємодії можна спостерігати на прикладі олеїнової і елаїдинової кислот: олеїнова кислота — цис- ізомер, який має температуру плавлення 13.4 °C, що робить речовину рідкою за кімнатної температури; у той час як транс — ізомер, елаїдинова кислота[en], має вищу температуру плавлення 43 °С, через те, що молекули транс — ізомерних упакувуються щільніше, і речовина є твердою за кімнатної температури.
Таким чином, транс- алкени, які є менш полярними і більш симетричними, мають нижчі точки кипіння і вищі точки плавлення, а цис- алкени, як правило, більш полярні і менш симетричними, мають вищу точок кипіння і нижчу температура плавлення.
У випадку геометричної ізомерії, яка відбувається за участі подвійних зв'язків, і, зокрема, коли обидва заступника однакові, спостерігаються деякі загальні тенденції. Ці тенденції можна пояснити тим, що диполі замісників у цис — ізомері будуть додаватися, щоб отримати загальний молекулярний диполь. У транс — ізомері диполі замісників будуть взаємокомпенсовуватися[джерело?] у зв'язку із знаходженням на протилежних сторонах молекули. Транс — ізомери, як правило, мають більш низькі густину, ніж їх Цис- аналоги.[джерело?]
Згідно з загальною тенденцією, транс- алкени, як правило, мають вищі точки плавлення і меншу розчинність в інертних розчинниках, так як транс- алкени, загалом, є більш симетричні, ніж цис-алкени.[6]
Віцинальні константи (3Дж,НН), виміряні ЯМР-спектроскопією, більші для транс-ізомерів (у діапазоні 12-18 Гц; типові: 15 Гц), ніж для цис-ізомерів (діапазон: 0-12 Гц; типові: 8 Гц).[7]
Зазвичай для ациклічних систем транс- ізомери більш стійкі, ніж цис- ізомери. Як правило, це пов'язано з підвищеною несприятливістю до стеричних взаємодій замісників у цис- ізомерах. Таким чином, транс- ізомери мають меншу екзотермічну теплоту згоряння, що вказує на вищу термохімічну стабільність. У наборі даних Бенсона про аддитивність групової теплоти формування, цис — ізомери зазнають нестачі стабільності у 1,10 ккал/моль. Існує виняток до цього правила, наприклад 1,2-дифторетилен, 1,2-дифтордіазен (FN=NF), і кілька інших галоген-, і кисень- заміщених етиленів. У подібних випадках цис- ізомери стабільніші, ніж транс- ізомери.[8] Це явище називається Цис-ефектом.[9]

Як правило, цис–транс система іменування ізомерів алкенів повинна бути використана тільки тоді, коли наявні тільки два різних замісники на подвійному зв'язку, щоб не виникало жодної плутанини відносно того, де які замісники описані відносно один одного. Для більш складних випадків, цис-/транс- позначення, визначаються відносно найдовшого вуглецевого ланцюга, що відображається у кореневому імені молекули (тобто розширення стандартної органічної номенклатури для материнської структури). Стандартні позначення ІЮПАК E–Z є однозначними у всіх випадках, і тому особливо корисні для три- і чотири- заміщених алкенів, щоб уникнути будь-якої плутанини про те, які групи були визначені як цис — або транс- відносно один одного.
Z (від німецького (від нім. zusammen) що означає «разом». Е (від нім. entgegen) означає «проти», у сенсі «навпаки». Тобто, Z має вищий пріоритет груп цис- один до одної, а Е має вищий пріоритет груп транс- один до одної. Тим не менше, молекулярна конфігурація E або Z визначається правилами пріоритетів Кана — Інгольда — Прелога; більші атомні номери мають вищий пріоритет. Для кожного із двох атомів при подвійному зв'язку, необхідно визначити пріоритет кожного замісника. Якщо обидва пріоритетних замісника знаходяться по одну сторону, вказується Z; якщо на протилежних сторонах, вказується Е.
Оскільки система номенклатури цис-/транс- і Е–Z відносяться до різних груп у алкенах, то ці позначення не суворо співставлювані, тобто Z не завжди відповідає цис-, а Е — транс-. Наприклад, транс-2-хлорбут-2-ен (дві метильні групи, атомів С1 і С4, які формують ланцюг бут-2-ену знаходяться у транс- положенні один до одного) є (Z)-2-хлорбут-2-еном (визначається від атомів хлору і С4, тому що С1 і С4 розташовані навпроти).
Цис–транс - ізомерія може також відбуватися у неорганічних сполуки, особливо в диазенах і комплексних сполуках.
Диазени[en] (і відповідні з дифозфени) можуть також проявляти цис-/транс- ізомерію. Як і у випадку з органічними сполуками, загалом цис- ізомери більше реакційноздатний, і є єдиним ізомером, який може відновлювати алкенів і алкінів до алканів, але з іншої причини: транс — ізомер не може виставити водні у лінію відповідно до відновлюваного алкена, а цис- ізомер формується у зручне положення для приєднання воднів до ненасиченого зв'язку.
  |   |
| транс-диазен | цис-диазен |
В неорганічних координаційних комплексах з октаедричною або плоскою квадратною геометрією, які також є цис- ізомером, у яких подібні ліганди розташовані ближче один до одного і транс — ізомерів, в якому вони розташовані якнайдалі.

Наприклад, є два ізомери квадратно-планарної Pt(NH3)2Cl2, які це пояснив Альфред Вернер у 1893 році. У цис- ізомера, повна назва якого цис-диамінодихлорплатина(II), у 1969 році Барнеттом Розенбергом[en], було знайдено протипухлину активність, і зараз це хіміотерапевтичний препарат, відомий під короткою назвою цисплатин. На відміну від попереднього ізомеру, транс — ізомер (трансплатина) не має жодної корисної протипухлинної активності. Кожен ізомер можна синтезувати за допомогою транс-впливу, щоб контролювати, який ізомер утворюється.
Для октаедричних комплексів із формулою МХ4Y2, також є два ізомери. (Тут М — це атом металу, а X і Y — два різні типи лігандів.) У цис- ізомері, два ліганди Y розташовуються впритул один до одного під кутом 90°, як це відповідає двом атомами хлору, які показані зеленим кольором у молекулі цис-[Co(NH3)4Cl2]+, яка ліворуч. У транс- ізомері, який показано праворуч, два атоми Cl розташовані навпроти відносно центрального спільного атома Co.
Споріднений тип ізомерії в октаедричних комплексах типу МХ3Y3 наявний у фас-меридіальній (або фас-/мер-) ізомерії, у якій різна кількість лігандів розташовуються у цис- або транс- положеннях відносно один одного. Карбоніли металів можна охарактеризувати як «фас-» або «мер-» з допомогою інфрачерфоної спектроскопії.
- ↑ Charlton T. Lewis, Charles Short, A Latin Dictionary (Clarendon Press, 1879) Entry for cis
- ↑ Reusch, William (2010). Stereoisomers Part I. Virtual Textbook of Organic Chemistry. Michigan State University. Процитовано 7 квітня 2015.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Редагована онлайн версія: (2006–) "geometric isomerism". doi:10.1351/goldbook.G02620 (англ.)
- ↑ Chemicalland values. Chemicalland21.com. Процитовано 22 червня 2010.
- ↑ CRC Handbook of Chemistry and Physics (вид. 60th). 1979–80. с. C-298.
- ↑ March, Jerry. Advanced Organic Chemistry, Reactions, Mechanisms and structure (вид. 3rd). с. 111. ISBN 0-471-85472-7.
- ↑ Williams, Dudley H.; Fleming, Ian (1989). Table 3.27. Spectroscopic Methods in Organic Chemistry (вид. 4th rev.). McGraw-Hill. ISBN 007707212X.
- ↑ Bingham, Richard C. (1976). The stereochemical consequences of electron delocalization in extended π systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena. J. Am. Chem. Soc. 98 (2): 535—540. doi:10.1021/ja00418a036.
- ↑ Craig, N. C.; Chen, A.; Suh, K. H.; Klee, S.; Mellau, G. C.; Winnewisser, B. P.; Winnewisser, M. (1997). Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane. J. Am. Chem. Soc. 119 (20): 4789. doi:10.1021/ja963819e.
- IUPAC definition of «stereoisomerism»
- IUPAC definition of «geometric isomerism»
- IUPAC definition of «cis–trans isomers»
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. — Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.


 French
French Deutsch
Deutsch
