Хлорофіл — Вікіпедія
| Хлорофіл | |
 | |
| Маса | 1,5E−24 кг[1] |
|---|---|
| Дата відкриття (винаходу) | 1817 |
| Хімічна формула | C₅₅H₇₂MgN₄O₅[1] |
| Ізомерична SMILES | C1=2N3C(C=C4[N+]5=C(C=C6N7C8=C(C9=[N+](C(=C1)[C@H]([C@@H]9CCC(OC/C=C(/CCC[C@@H](CCC[C@@H](CCCC(C)C)C)C)\C)=O)C)[Mg-2]735)[C@H](C(C8=C6C)=O)C(=O)OC)C(=C4*)*)=C(C2*)*[2] |
| Фізично взаємодіє з | фотон |
| | |
Хлорофіл — зелений пігмент, наявний у клітинах рослин, деяких водоростей і ціанобактерій, що надає їм відповідного кольору. Назва походить від грец. chloros — «зелений» і phyllon — «листок». Зареєстрований як харчовий барвник під номером E140.
Вперше з листя виділили зелену речовину й назвали її хлорофілом французькі хіміки-фармацевти Ж. Пельт'є та Ж. Каванту 1817 року. Це відкриття було зроблено випадково у процесі пошуку лікарських засобів у різних рослинах. У кристалічному вигляді хлорофіл вперше був отриманий російським фізіологом й ботаніком Іваном Бородіним 1882 року. Польські біохіміки Марцелл Ненцький й Леон Мархлевський у 1887 році показали, що основу молекули хлорофілу складає порфінове кільце. Елементний склад хлорофілу a — C55H72N4O5Mg та b — C55H70N4O6Mg був визначений у 1914 році німецьким хіміком Ріхардом Вільштеттером. Він не лише виділив хлорофіл а й хлорофіл b, та встановив їх хімічний склад, але також довів, що у всіх рослин, незалежно від умов їх знаходження, хлорофіл є однаковим. За ці дослідження Р. Вільштеттер у 1915 році був нагороджений Нобелівською премією з хімії.[3]
У 1960 році хіміки-органіки Р. Б. Вудворд й М. Штрель завершили повний синтез молекули хлорофілу й підтвердили правильність структурної формули, встановленої Г. Фішером.
Молекула хлорофілу складається з порфінової «головки» й фітольного «хвоста». При цьому порфінова частина молекули знаходиться на поверхні мембрани тилакоїда й пов'язана із білками, а жиророзчинний фітольний ланцюг занурений у ліпідний шар. Хлорофіл є складним етером дикарбонової кислоти хлорофіліну, у якої одна карбоксильна група етерифікована залишком метилового спирту, а друга — залишком спирту фітолу. За розриву складноетерного зв'язку й відщеплення фітолу утворюється сполука, яка називається хлорофілідом.
| Хлорофіл a | Хлорофіл b | Хлорофіл c1 | Хлорофіл c2 | Хлорофіл d | Хлорофіл f | |
|---|---|---|---|---|---|---|
| Молекулярна формула | C55H72O5N4Mg | C55H70O6N4Mg | C35H30O5N4Mg | C35H28O5N4Mg | C54H70O6N4Mg | C55H70O6N4Mg |
| C2 група | -CH3 | -CH3 | -CH3 | -CH3 | -CH3 | -CHO |
| C3 група | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CHO | -CH=CH2 |
| C7 група | -CH3 | -CHO | -CH3 | -CH3 | -CH3 | -CH3 |
| C8 група | -CH2CH3 | -CH2CH3 | -CH2CH3 | -CH=CH2 | -CH2CH3 | -CH2CH3 |
| C17 група | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl | -CH=CHCOOH | -CH=CHCOOH | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl |
| C17-C18 сполука | Одинарна | Одинарна | Подвійна | Подвійна | Одинарна | Одинарна |
| Наявні в | Універсальна | Переважно рослини | Різноманітні водорості | Різноманітні водорості | Ціанобактерії | Ціанобактерії |
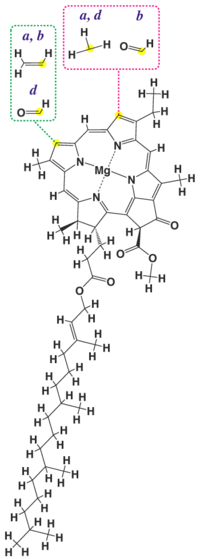 |  |

Основу молекули хлорофілу складає кільце з 4 піролів, пов'язаних йоном магнію. У хлорофілів a, b, d є довгий фітольний ланцюг, який є відсутнім у хлорофілів с. Пластиди водоростей з різних відділів відрізняються за складом хлорофілів. Наприклад, глаукоцистофітові, червоні й евстігматофіцієві (Eustigmatophyceae) водорості містять лише хлорофіл а, зелені, евгленові й хлорорахніофітові містять хлорофіли а та b. Інші відділи еукаріотних водоростей містять хлорофіли а й c. В усіх фотосинтезуючих прокаріотичних водоростей присутній хлорофіл а, хлорофіли b, c зустрічаються у прохлорофтів, хлорофіл d виявлений лише у Acaryochloris marina.

Розрізняють головні хлорофіли, які разом із бета-каротином входять до складу реакційних центрів, і допоміжні, які входять у світлопоглинаючі антени. Головним хлорофілом у всіх фотосинтезуючих водоростей є хлорофіл а. Винятком є Acaryochloris marina, у якого до складу реакційного центру входить хлорофіл d. До складу антенних систем входять хлорофіли b та с. Хлорофіл бере участь у передачі енергії від каротиноїдів до хлорофілу а у антенних комплексах[4].
Хлорофіли, як й фікобіліни, відносяться до тетрапіролів, які, на відміну від фікобілінів, замкнені у кільце (фікобіліни ж розташовані лінійно).
Хлорофіл забезпечує перетворення енергії світла на енергію хімічних зв'язків. Хлорофіли мають два максимуми поглинання світла — у синій (430–460 нм) й червоній (650–700 нм) областях спектру.
Синьо-фіолетовий максимум поглинання хлорофілів забезпечується резонансною структурою порфінового кільця. Поглинання світла у червоній області спектра пов'язане із наявністю магнію й гідруванням подвійного зв'язку у положення С7-С8 D-пірольного ядра. Тому у феофітінуу (через втрату атому Mg) червоний максимум виражений слабкіше. Положення максимумів поглинання світла хлорофілом залежить від природи розчинника, взаємодії молекул пігментів одна з одною, з біпідами та білками. Хлорофіли асоційовані із гідрофобними білками й вбудовані у ліпідну фазу мембрани тилакоїда.
Хлорофіл є сенсибілізатором — легко збуджується при поглинанні світла й має здатність передавати енергію (є донором енергії) іншим молекулам (акцепторам енергії). Збуджена світлом молекула хлорофілу набуває здатності брати участь у окисно-відновних процесах, тобто віддавати й приймати електрони.
У анаеробних умовах хлорофіл, розчинений у піридині, під дією світла відновлюється аскорбіновою кислотою або іншими донорами електронів. Після вимкнення світла реакція йде у зворотному напрямку:
Своєю чергою «фотовідновлений» хлорофіл може відновлювати такі акцептори, як НАД+, хінони, Fe3+ тощо:
Ці реакції отримали назву реакцій Красновського.[5]
При обробці рослин бензиламінопурином підвищується вміст зеатину й ауксинів й понижується рівень абсцизової кислоти. Відношення зеатин/абсцизова кислота зростає. На цьому фоні спостерігається збільшення вмісту у листях пігментів (хлорофілу, каротиноїдів), розчинних вуглеводів. Це узгоджується із даними про впилв цитокінінів на біосинтез хлорофілу через посилене утворення попередника цього пігмента — протохлорофіліду[6].
Барвник зареєстрований під номером E140 і дозволений для застосування у виробництві харчових продуктів за технологічною необхідністю.
В Україні барвник є в переліку дозволених харчових добавок[7].
- ↑ а б 1406-65-1
- ↑ ChEBI release 2021-07-01 — 2021.
- ↑ Г. О. Сіренко, О. В. Кузишин, Н. Є. Шеленко - Чому хемія, а не хімія?.
- ↑ Белякова Г.А. и др. - Ботаника в 4 т. Т.1. Водоросли и грибы, 2006.
- ↑ Медведев Сергей Семенович - Физиология растений.
- ↑ Климачев Д. А., Старикова В. Т. - ВЗАИМОДЕЙСТВИЕ ГОРМОНАЛЬНОЙ СИСТЕМЫ РАСТЕНИЙ И УСЛОВИЙ МИНЕРАЛЬНОГО ПИТАНИЯ.
- ↑ Постанова Кабінету Міністрів України від 4 січня 1999 р. N 12: Про затвердження переліку харчових добавок, дозволених для використання у харчових продуктах


 French
French Deutsch
Deutsch
