共軛 (酸鹼理論) - 维基百科,自由的百科全书
| 酸碱化学 |
|---|
 |
| 酸 |
| 碱 |
根據酸鹼質子理論,一分子或離子的共軛酸是該分子或離子從其他的酸得到一個質子H+
(即质子化)後的產物,在此反應中,原來參與分子或離子為鹼,得到一個質子之後即為其共軛酸。而共軛鹼就是酸在失去一個質子(去质子化)後的產物[1]。有些酸可以提供多個質子,因此某酸的共軛鹼有可能仍是酸性的。
簡單來說,可以用以下的化学反应來說明:
- 酸+碱⇌共轭碱+共轭酸
约翰内斯·尼古劳斯·布仑斯惕和马丁·劳里提出了酸鹼質子理論,根據此理論,任何可以提供質子給其他化合的化合物就是酸,而可以接收質子的化合物就是鹼。質子是原子核內的粒子,帶有一個正電荷,可以用H+
表示,因為氫原子的原子核就是一個質子[2],也就是氢正离子。
根據參與反應的化學物質不同,以及使用的酸碱理论,陽離子有可能是共軛酸,陰離子也有可能是共軛鹼。最簡單可以是共軛鹼的陰離子是溶剂化电子,而其共軛酸就是氫原子。
酸碱反應
[编辑]酸和碱的化學反應會產生對應的共軛碱和共軛酸。酸會失去質子,而碱會得到質子。在以下的圖示中,箭頭表示碱和質子反應形成的鍵結,箭頭從碱的電子對開始,指向酸的氫離子(質子),這個氫離子最後會轉移: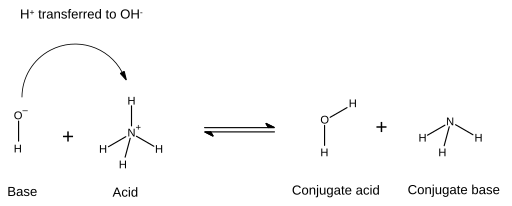 此例中,碱性氫氧根離子從铵接收氫離子,水則是氫氧根離子的共軛酸,而酸性的铵失去一個氫離子,氨則是其共軛碱。而上述反應的逆反應是水H
此例中,碱性氫氧根離子從铵接收氫離子,水則是氫氧根離子的共軛酸,而酸性的铵失去一個氫離子,氨則是其共軛碱。而上述反應的逆反應是水H
2O提供一個氫離子,形成OH−,因此OH−也可以視為是水的共軛碱。「酸」、「碱」、「共軛碱」、「共軛酸」不是專屬於特定化合物,可能在其逆反應中,酸和共軛酸的角色就對調了。
共軛酸碱的強度
[编辑]共軛酸的強度和解离常数成正比。較強的共軛酸比較容易將氫離子推到其他的化合物中,有較高的平衡常数。共軛碱的強度可以視為是其拉氫離子的傾向,若共軛碱是強碱,溶解後會將氫離子留下,其對應的酸也比較不會分解。
強酸的共軛碱會是弱碱[3],像盐酸HCl溶於水中的分解就是很好的例子。因為HCl是強酸(在水中大量分解),其Cl−
就是弱碱,大部份的H+
不會和Cl−
結合,而是和水結合,形成水合氢离子H
3O+
,因此盐酸的共軛碱是比水弱的弱碱。
另一方面,若化合物是弱酸,其共軛碱不一定會是強碱。像乙酸根離子是乙酸的共軛碱,鹼解離係數(Kb)約為5.6×10−10,是弱鹼。 若希望化合物的共軛碱是強碱,化合物本身需要是非常弱的酸,例如水。
識別共軛酸鹼對
[编辑]若要識別共軛酸鹼對,可以在反應中找只差一個氫離子的反應物和生成物。在生成物一側的共軛酸在反應中獲得了一個氫離子,因此少一個氫離子的對應反應物即為鹼。生成物一側的共軛鹼在反應中失去了一個氫離子,因此多一個氫離子的對應反應物即為酸。
考慮以下的酸鹼反應:
硝酸(HNO
3)提供一個氫離子和水分子,因此在在此反應中是酸,其共軛鹼即為硝酸根(NO−
3)即為。水分子在反應中接受了氫離子(質子),是鹼,其共軛酸是水合氢离子(H
3O+
)。
| 方程式 | 酸 | 鹼 | 共軛鹼 | 共軛酸 |
|---|---|---|---|---|
| HClO 2 + H 2O → ClO− 2 + H 3O+ | HClO 2 | H 2O | ClO− 2 | H 3O+ |
| ClO− + H 2O → HClO + OH− | H 2O | ClO− | OH− | HClO |
| HCl + H 2PO− 4 → Cl− + H 3PO 4 | HCl | H 2PO− 4 | Cl− | H 3PO 4 |
應用
[编辑]共軛酸鹼可以用在缓冲溶液系統中。缓冲溶液是由弱酸及其共軛鹼(以鹽類的方式存在)或弱鹼及其共軛酸所組成的系統,可以在滴定過程中限制pH值的變化。缓冲溶液有一般實驗上的應用,也有在生物體內的應用。人體血液就類似缓冲溶液,可以調節pH值。血液中最重要的缓冲系統是重碳酸鹽緩衝系統,避免因為二氧化碳的增減而造成pH值的劇幅變化。其化學反應如下:
以下是一些常見的緩衝試劑。
| 緩衝試劑 | pKa | 適用的pH值範圍 |
|---|---|---|
| 檸檬酸 | 3.13, 4.76, 6.40 | 2.1 - 7.4 |
| 乙酸 | 4.8 | 3.8 - 5.8 |
| KH2PO4 | 7.2 | 6.2 - 8.2 |
| 2-环己氨基乙磺酸(CHES) | 9.3 | 8.3–10.3 |
| 硼酸鹽 | 9.24 | 8.25 - 10.25 |
另一個常用作緩衝試劑的有機化合物是乙酸。乙酸CH
3COOH若要成為緩衝試劑,需要和其共軛鹼CH
3COO−
混合。所形成的混合物即為乙酸緩衝溶液,是由CH
3COOH和CH
3COONa的水溶液混合而。乙酸和許多弱酸一樣,是許多化學實驗中常見的為緩衝試劑。
乳酸林格氏液是由有機酸乳酸、乳酸根、鈣離子、鈉離子、鉀離子及氯離子,用蒸餾水製備的緩衝溶液[4],所形成的液體其張性類似人體血液,常用於因物理创伤、外科手術或烧伤產生出血之後的體液補充[5]。
酸以及其共軛碱的列表
[编辑]以下是一些酸以及其共軛碱的列表,兩者只差一個質子(H+離子)。酸的酸性隨表往下而遞減,碱的碱性隨表往下而遞增。
| 酸 | 共軛碱 |
|---|---|
| H2F+ 二氢氟阳离子 | HF 氢氟酸 |
| HCl 盐酸 | Cl− 氯离子 |
| H2SO4 硫酸 | HSO4− 硫酸氢根离子 |
| HNO3 硝酸 | NO3− 硝酸根离子 |
| H3O+ 水合氢离子 | H2O 水分子 |
| HSO4− 硫酸氢根离子 | SO42− 硫酸根离子 |
| H3PO4 磷酸 | H2PO4− 磷酸二氢根离子 |
| CH3COOH乙酸 | CH3COO− 乙酸根离子 |
| HF 氢氟酸 | F− 氟離子 |
| H2CO3 碳酸 | HCO3− 碳酸氢根离子 |
| H2S 硫化氢 | HS− 氢硫根离子 |
| H2PO4− 磷酸二氢根离子 | HPO42− 磷酸一氢根离子 |
| NH4+ 铵离子 | NH3 氨 |
| H2O 水分子 | OH− 氢氧根离子 |
| HCO3− 碳酸氢根离子 | CO32− 碳酸根离子 |
碱以及其共軛酸的列表
[编辑]以下是一些碱以及其共軛酸的列表。酸的酸性隨表往下而遞減,碱的碱性隨表往下而遞增。
| 碱 | 共軛酸 |
|---|---|
| C2H5NH2 乙胺 | C2H5NH3+ 乙基铵離子 |
| CH3NH2 甲胺 | CH3NH3+ 甲基铵離子 |
| NH3 氨 | NH4+ 铵離子 |
| C5H5N 吡啶 | C5H6N+ 吡啶鎓陽離子 |
| C6H5NH2 苯胺 | C6H5NH3+ 苯銨離子 |
| C6H5COO- 苯甲酸離子 | C6H5COOH 苯甲酸 |
| F- 氟離子 | HF 氟化氢 |
| PO3− 4 磷酸根離子 | HPO2− 4 磷酸一氫根離子 |
| OH− 氢氧根離子 | H2O 水(中性,PH值 7) |
| HCO− 3 碳酸氢根 | H2CO3 碳酸 |
| CO2− 3 碳酸根 | HCO− 3 碳酸氢根 |
| Br- 溴離子 | HBr 溴化氢 |
| HPO2− 4 磷酸一氫根離子 | H2PO− 4 磷酸二氫根離子 |
| Cl- 氯離子 | HCl 氯化氢 |
| H2O 水 | H3O+ 水合氢离子 |
| NO− 2亚硝酸根離子 | HNO2 亚硝酸 |
参见
[编辑]參考資料
[编辑]- ^ Zumdahl, Stephen S., & Zumdahl, Susan A. Chemistry. Houghton Mifflin, 2007, ISBN 0618713700
- ^ Brønsted–Lowry theory | chemistry. Encyclopedia Britannica. [2020-02-25]. (原始内容存档于2025-02-18) (英语).
- ^ Strength of Conjugate Acids and Bases Chemistry Tutorial. www.ausetute.com.au. [2020-02-25]. (原始内容存档于2025-02-23).
- ^ British national formulary: BNF 69 69. British Medical Association. 2015: 683. ISBN 9780857111562.
- ^ Pestana, Carlos. Pestana's Surgery Notes Fifth. Kaplan Medical Test Prep. 7 April 2020: 4–5. ISBN 978-1506254340.


 French
French Deutsch
Deutsch

