血红蛋白 - 维基百科,自由的百科全书
此條目需要擴充。 (2010年9月12日) |



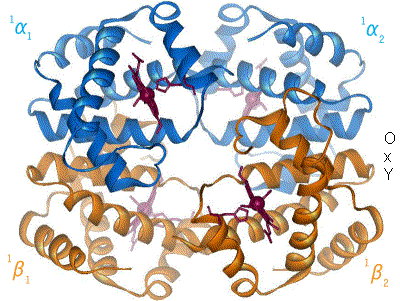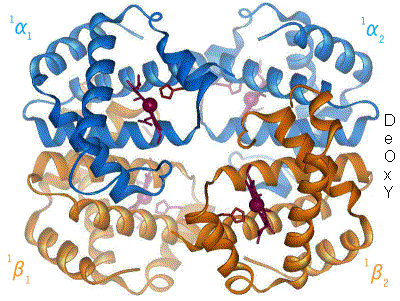
血红蛋白[註 1](Hemoglobin,縮寫 Hb、Hgb)又稱血红素,俗稱血色素,是高等生物体内红色含铁的携氧结合蛋白。血红蛋白的结构为异源四聚体,有4个亚单位(α亚基、β亚基),即2对珠蛋白组成,每个珠蛋白结合1个血基質。
哺乳动物的一个血红蛋白分子,可以结合最多四个氧分子。可以用平均細胞血紅蛋白濃度測出濃度。

分布与分类
[编辑]血红蛋白和类血红蛋白分子存在于几乎所有的脊椎动物体内,在许多无脊椎动物、真菌和植物中也有分布。在这些机体中,血红蛋白可能携带氧气,抑或扮演转移和调节二氧化碳、一氧化氮、硫化氢和硫化物的角色。其中一种称作豆血红蛋白(leghemoglobin)的变体分子是用来清除氧气以免毒害诸如豆科植物的固氮根瘤的厌氧系统的。
哺乳动物中血红蛋白占红细胞干重的97%、总重的35%。人类血红蛋白由2对(4条)血红蛋白单体聚合成四聚体,每个血红蛋白单体由每一条肽链和一个血红素连接构成。肽链有两种(即珠蛋白的两种肽链):含141个氨基酸残基的α链和含146个氨基酸残基的非α链(β、γ及δ链,各种都有固定的氨基酸排列顺序)。其中α链基因位于16号染色体,β、δ、γ链基因位于11号染色体。
血红蛋白有多种类型,可分为6种:胚胎型 HbGowerⅠ(ζ2ε2)、HbGowerⅡ(α2ε2)、HbPortland(ζ2γ2),胎儿型 HbF(α2γ2),成人型 HbA(α2β2)、HbA2(α2δ2);其中,HbA为健康成人中主要的Hb。
正常人出生后有三种血红蛋白:
- 血红蛋白A(HbA):占成人血红蛋白的96%-98%,由一对α链和一对β链组成(α2β2);
- 血红蛋白A2(HbA2):由一对α链和一对δ链组成(α2δ2),占血红蛋白的2%~3%;
- 胎儿血红蛋白(HbF):由一对α链和一对γ链组成(α2γ2),仅存在于胎儿血中,出生6个月后含量仅1%左右。
此外,病态血红蛋白有:血红蛋白H(HbH),由四个相同β链组成的血红蛋白(β4);血红蛋白C(HbC),β链中Lys被Glu取代的血红蛋白;血红蛋白S(HbS),镰刀状细胞红蛋白;血红蛋白O2(HbO2,HHbO2),氧合血红蛋白;血红蛋白CO(HbCO),一氧化碳结合血红蛋白。
生化特性
[编辑]血红蛋白(HbA)化学式:C3032H4816O812N780S8Fe4,分子量约 64,000Da(64,458 g/mol)[1]。人体内的血红蛋白由四个亚基构成(共含四条带血红素基团的多肽链),分别为两个α亚基和两个β亚基,在与人体环境相似的电解质溶液中血红蛋白的四个亚基可以自动组装成α2β2的形态。血液中的血红蛋白从呼吸器官中将氧气运输到身体其他部位释放,以满足机体氧化营养物质支持功能运转之需要,并将由此生成的二氧化碳带回呼吸器官中以排出体外。平均每克血红蛋白可结合1.34ml的氧气,是血浆溶氧量的70倍。
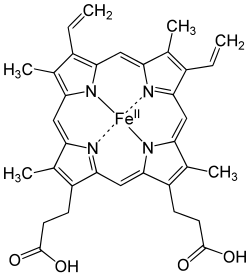
血红蛋白的每个亚基由一条肽链和一个血基質分子构成,肽链在生理条件下会盘绕折叠成球形,把血红素分子抱在里面,这条肽链盘绕成的球形结构又被称为珠蛋白。血基質分子是一个具有卟啉结构的小分子,在卟啉分子中心,由卟啉中四个吡咯环上的氮原子与一个亚铁离子配位结合,珠蛋白肽链中第8位的一个组氨酸残基中的咪唑侧链上的氮原子从卟啉分子平面的上方与亚铁离子配位结合,使中心离子铁(II)成为五配位,既是配位中心,又是活性中心。当血红蛋白不与氧结合的时候,有一个水分子从卟啉环下方与亚铁离子配位结合,而当血红蛋白载氧的时候,就由氧分子顶替水的位置。
血紅蛋白與氧的結合可受到2,3-二磷酸甘油酸(2,3-BPG)的調控,成人的血紅素組成為α2β2,使成人血紅蛋白對氧的親和性降低,而胎兒血紅蛋白的組成為α2γ2,不受2,3-二磷酸甘油酸影響。
血红蛋白中铁(II)能可逆地结合氧分子,取决于氧分压。与氧结合时,血红素中的二价铁化学价不变,形成呈鲜红色的氧合血红蛋白,与氧解离后带有淡蓝色。与氧结合的具体过程非常神奇:没有氧存在时,四个亚基间相互作用力很强;氧分子越多,与血红蛋白结合力越强。首先一个O2与血红蛋白四个亚基中的一个结合,与氧结合之后的珠蛋白结构发生变化,造成整个血红蛋白结构的变化;这种变化使得第二个氧氣分子相比于第一个氧氣分子更容易寻找血红蛋白的另一个亚基结合,而它的结合会进一步促进第三个氧氣分子的结合;以此类推,直到构成血红蛋白的四个亚基分别与四个氧氣分子结合。而在组织内释放氧的过程也是这样,一个氧氣分子的离去会刺激另一个的离去,直到完全释放所有的氧氣分子,这种有趣的现象称为协同效应。

由于协同效应,血红蛋白与氧气的结合曲线呈S形,在特定范围内随着环境中氧含量的变化,血红蛋白与氧分子的结合率有一个剧烈变化的过程,生物体内组织中的氧浓度和肺组织中的氧浓度恰好位于这一突变的两侧,因而在肺组织,血红蛋白可以充分地从氧分压较高的肺泡中摄取氧,并随着血液循环把氧气释放到氧分压较低的组织中,充分地释放所携带的氧分子,从而起到输氧作用;可是当环境中的氧气含量很高或者很低的时候,血红蛋白的氧结合曲线非常平缓。
除了运载氧,血红蛋白还可以与硫化氫、一氧化碳、氰离子结合,结合的方式也与氧完全一样,所不同的只是结合的牢固程度,一氧化碳、氰离子一旦和血红蛋白结合就很难离开,即使浓度很低也能优先和血红蛋白结合,致使通往组织的氧气流中断,这就是煤气中毒和氰化物中毒的原理,使氧气与血红蛋白的结合能力下降,使人窒息而死亡。遇到这种情况可以使用其他与这些物质结合能力更强的物质来解毒,比如一氧化碳中毒可以用静脉注射亚甲基蓝的方法来救治。
血红蛋白也参与其他气体的转运:它能携带机体的部分二氧化碳(大约10%)。亦可将重要的调节分子一氧化氮结合在球状蛋白的某个硫醇基团上,在释放氧气的同时将其释放。在红细胞及其祖系细胞以外也发现了血红蛋白——包括黑质中的A9多巴胺神经元、巨噬细胞、肺泡细胞以及肾脏中的系膜细胞。在这些组织中,血红蛋白作为抗氧化剂和铁代谢的调节因子存在,適用於生物高溫攜氧,在低溫情況下攜氧效果低。


相關病症
[编辑]血红蛋白病是一组遗传性溶血性贫血,分为两大类:珠蛋白肽链分子结构异常(如:鐮刀形細胞貧血症等)和珠蛋白肽链合成数量异常(地中海贫血)
- 正鐵血紅蛋白血症
- 鐮刀形細胞貧血症,在Hbs分子中,其β次單元的Glu6(側鏈帶負電)突變成Val6(側鏈疏水),以致結構變形。
- 地中海貧血症,分为两种:甲型(α-Thalassemias)和乙型(β-Thalassemias)。甲型会形成β4或γ4,其α次單元有缺失,分为3类: ①静止型或标准型α地中海贫血:如果4个α基因仅缺失1个,表现为静止型;如缺失2个则为标准型;②血红蛋白H(HbH或β4)病:4个α基因缺失3个;③血红蛋白Bart胎儿水肿综合征:父母双方均为d地中海贫血,胎儿4个α基因全部缺失,α链绝对缺乏,γ链自相聚合成Hb Bart(γ4)。乙型患者β珠蛋白链的合成缺少,世界上至少1.5亿人携带β珠蛋白基因缺陷(常染色体显性遗传)中的一种。患者相对增多的未结合α链自聚成不稳定的α聚合体,并在幼红细胞内沉淀形成包涵体,引起膜的损害而致溶血。γ和δ链代偿合成,致HbA2(α2δ2)和HbF(α2γ2)增多,HbF的氧亲和力高,加重组织缺氧。
备注
[编辑]- ^ 英語 hemoglobin,中国大陆称血红蛋白,臺灣稱血紅素;而英語 heme,中国大陆称血红素,臺灣稱血基質。两术语极易混淆,在阅读汉语文献时,应厘清讨论对象。
参考文献
[编辑]- ^ Van Beekvelt MC, Colier WN, Wevers RA, Van Engelen BG. Performance of near-infrared spectroscopy in measuring local O2 consumption and blood flow in skeletal muscle. J Appl Physiol. 2001, 90 (2): 511–19. PMID 11160049. S2CID 15468862. doi:10.1152/jappl.2001.90.2.511.
延伸閱讀
[编辑]| 關於血红蛋白 的圖書館資源 |
- Campbell, MK. Biochemistry third. Harcourt. 1999. ISBN 0-03-024426-9.
- Eshaghian, S; Horwich, TB; Fonarow, GC. An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure. Am Heart J. 2006, 151 (1): 91.e1–91.e6. PMID 16368297. doi:10.1016/j.ahj.2005.10.008.
- Ganong, WF. Review of Medical Physiology 21st. Lange. 2003. ISBN 0-07-140236-5.
- Hager, T. Force of Nature: The Life of Linus Pauling. Simon and Schuster. 1995. ISBN 0-684-80909-5.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T. Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds. J Mol Biol. 2005, 356 (2): 335–53. PMID 16368110. doi:10.1016/j.jmb.2005.11.006.


 French
French Deutsch
Deutsch