硒 - 维基百科,自由的百科全书
此條目尚未参照元素專題之格式編寫。 |
硒存在於金屬硫化物礦物中,礦石中金屬應與硫原子鍵結的位置,部分由硒原子取代。在商業上,硒經常是得自這些礦石的精煉過程中所產生的副產物。純的硒化物或硒酸鹽化合物礦物是已知的,但很少見。現今硒的主要商業用途是在玻璃製造和色素。硒是一種半導體,用於光電池,曾經是很重要的電子學應用,現已大部分被矽半導體的裝置取代,但硒仍用於少數幾種類型的直流電源突波保護器和一種螢光量子點。
服用大量硒盐可能引起中毒,但微量的硒是許多生物(包括所有動物)細胞功能所必需的。硒是許多多種維生素和其他膳食補充劑中的一個成分,包括嬰兒配方奶粉。它是抗氧化酶谷胱甘肽过氧化酶和硫氧還蛋白還原酶的組成成分(間接還原動物和一些植物中的某些氧化分子)。它也存在於三種脫碘酶中,它們將一種甲狀腺激素轉化為另一種。植物中硒的需求因物種而異,某些植物需要相對較大的量,而另一些則顯然不需要。[3]
性质
[编辑]物理性质
[编辑]硒可形成幾種同素異形體,它們隨溫度變化而相互轉換,並與溫度變化的速率有關。以化學反應製備所得之硒通常是非晶質的磚紅色粉末。當迅速融化時,它形成黑色的玻璃態,販賣時常以珠子狀出售。[4]黑硒的結構是不規則和複雜的,由眾多可達1000個原子的聚合物環所組成。黑硒是一種脆性,有光澤的固體,微溶於二硫化碳。加熱時,它在50 ℃ 軟化並在180 ℃轉化為灰硒;當有鹵素和胺的存在時,會降低其轉化溫度。[5]
通過改變溶劑(通常為二硫化碳)的蒸發速率,可從黑硒溶液產生紅色α,β和γ形式。它們都屬單斜晶體對稱性,並且類似硫由折疊狀的Se8環以不同的方式排列而成。α形式中的排列最緊密。在Se8環中,Se-Se距離為233.5 pm,Se-Se-Se角為105.7°。其他硒同素異形體可能含有Se6或Se7環。[5]
最穩定和緻密形式的硒是灰色的並且具有由螺旋聚合物鏈組成的六方晶格,其中Se-Se距離為237.3 pm,Se-Se-Se角為130.1°,鏈條之間的最小距離為343.6 pm。灰硒的形成可透過以下的方式:溫和加熱其它同素異形體、緩慢冷卻熔融的硒、或者冷凝恰好低於熔點的硒蒸氣。相對於其他硒形式的絕緣體性質,灰色硒是半導體,具有可觀的光電導性。另一個與其他同素異形體不同之處是它不溶於二硫化碳。[5]它可抵抗空氣氧化,不會受到非氧化性酸的侵蝕,使用強還原劑,則形成聚硒化物。硒不會表現出如硫在逐漸加熱時產生的粘度變化。[4][6]
光學性質
[编辑]由於可在平板X射線探測器(見下文)中用作光電導體,非晶質的硒(α-Se)薄膜之光學性質已成為深入研究的主題。[7][8][9]
同位素
[编辑]硒有七種天然存在的同位素。其中五個:74Se、76Se、77Se、78Se和80Se是穩定的,而80Se是其中含量最豐富的(天然豐度為49.6%)。其他天然存在的同位素還包括長壽命的原始放射性核種 82Se,其半衰期為9.2×1019年。具放射性的非原始核種硒-79也以微量存在於鈾礦石中,是核分裂的產物。硒還有許多不穩定的放射性人造同位素,質量數介乎64Se到95Se;其中最穩定的兩種是75Se,半衰期為119.78天,和72Se,半衰期為8.4天。硒的同位素中,比穩定同位素更輕的放射性同位素主要透過正電子發射生成砷的同位素,而比穩定同位素更重的放射性同位素則進行β衰變生成溴的同位素,在已知最重的硒同位素中,會有少數進行中子發射的支線。
| 同位素 | 天然 | 來源 | 半衰期 |
|---|---|---|---|
| 74Se | 天然 | 穩定 | |
| 76Se | 天然 | 穩定 | |
| 77Se | 天然 | 核分裂產物 | 穩定 |
| 78Se | 天然 | 核分裂產物 | 穩定 |
| 79Se | 微量 | 核分裂產物 | 327000 年[10][11] |
| 80Se | 天然 | 核分裂產物 | 穩定 |
| 82Se | 天然 | 核分裂產物[12] | ~1020 年 |
化合物
[编辑]硒在化合物中通常的氧化态为−2、+2、+4和+6。
氧族元素化合物
[编辑]硒有两种氧化物——二氧化硒(SeO2)和三氧化硒(SeO3)。二氧化硒可以由硒和氧气直接反应而成:[4]
- Se8 + 8 O2 → 8 SeO2

它是由SeO2单体组成的聚合物固体,在气态下则解离成固体,溶于水生成亚硒酸 H2SeO3。亚硒酸也可以由硒和硝酸反应而成:[13]
- 3 Se + 4 HNO3 + H2O → 3 H2SeO3 + 4 NO
不像形成稳定三氧化物的硫,三氧化硒在热力学上不稳定,超过185 °C时分解成二氧化硒:[4][13]
- 2 SeO3 → 2 SeO2 + O2 (ΔH = −54 kJ/mol)
在实验室里,三氧化硒可以由无水硒酸钾(K2SeO4)和三氧化硫(SO3)反应而成。[14]
亚硒酸的盐叫做亚硒酸盐,例子包括亚硒酸银(Ag2SeO3)和亚硒酸钠(Na2SeO3)。
- H2SeO3 + 2 H2S → SeS2 + 3 H2O
二硫化硒由八元环组成,组成约为 SeS2,其中的八元环的成分可变,例如Se4S4和Se2S6。二硫化硒已在洗发水中用作抗头皮屑剂、聚合抑制剂、玻璃染料和烟花中的还原剂。[13]
三氧化硒可以由硒酸 H2SeO4脱水而成,而后者可以由二氧化硒和过氧化氢反应而成:[15]
- SeO2 + H2O2 → H2SeO4
卤素化合物
[编辑]硒唯一稳定的氯化物是二氯化二硒(Se2Cl2),类似的溴化物也是已知的。这些化合物的结构类似二氯化二硫。二氯化硒是制备硒化合物(例如Se7)的重要试剂。它可以由硒和硫酰氯(SO2Cl2)反应而成。[17]硒和氟气反应,生成六氟化硒:
- Se8 + 24 F2 → 8 SeF6
相较于对应的硫化合物六氟化硫,六氟化硒(SeF6)更活泼,有毒,会刺激肺部。[18] 一些硒的卤氧化物如:二氟氧化硒(SeOF2)和二氯氧化硒(SeOCl2)都用于特殊溶剂。[4]
硒化物
[编辑]和其它氧族元素一样,硒也有对应的氢化合物硒化氢 H2Se。它是极臭、有毒的无色气体,酸性比H2S更强。在溶液中,它会电离成HSe−。硒离子Se2−可以形成各种化合物,包括硒化汞(HgSe)、硒化铅(PbSe)、硒化锌(ZnSe)和硒化铜铟镓(Cu(Ga,In)Se2)。这些材料都是半导体。例如铝的高电正性元素的硒化物会水解:[4]
- Al2Se3 + 3 H2O → Al2O3 + 3 H2Se
碱金属硒化物可以继续和硒反应,形成含有Se2−
n链的多硒化物。
硒化物可以由硒和金属反应而成[19]:
- Se + Cu —Δ→ CuSe
- Se + 2 Ag —Δ→ Ag2Se
- Se + Zn —Δ→ ZnSe
- 3 Se + 2 Al —Δ→ Al2Se3
- Se + 2 K —液氨→ K2Se
其它化合物
[编辑]四氮化四硒 Se4N4是橙色的爆炸性化合物,是四氮化四硫(S4N4)的衍生物。[4][20][21]它可以由四氯化硒(SeCl4)和[((CH
3)
3Si)
2N]
2Se反应而成。[22]
- 8 KCN + Se8 → 8 KSeCN
和过渡金属氰化物在液氨中反应,会有不同的反应发生,如[19]:
- 3 Se + 2 CuCN → Cu(SeCN)2 + CuSe
- 22 Se + 12 AgCN + 16 NH3 → 6 Ag2Se + Se4N4 + 12 NH4SeCN
有机硒化合物
[编辑]硒,特别是II氧化态的硒能与碳形成稳定的键,其结构类似于相应的有机硫化合物。硒和硫有類似的性質,因此,許多有機硫化合物都有对应的有机硒化合物。其中,最常见的是硒醚(R2Se,硫醚的类似物)、二硒化物(R2Se2,二硫化物的类似物)和硒醇(RSeH,硫醇的类似物)。有机硫化学中的亚砜在有机硒化学中对应的化合物是硒代亚砜(RSe(O)R),是有机合成的中间体,例如硒代亚砜消除反应。由于双键规则,硒酮 R(C=Se)R和硒醛 R(C=Se)H都很罕见。[23]
歷史
[编辑]硒(Selenium名稱來自希臘文的σελήνη selene,意思是「月亮」)於1817年由永斯·貝吉里斯(Jöns Jakob Berzelius) 與約翰·戈特利布·甘恩(Johan Gottlieb Gahn)兩位化學家發現。[24]這兩位化學家在瑞典格利普霍姆堡(Gripsholm)附近擁有一家以鉛室法製造硫酸的工廠。從瑞典法倫的大銅山礦區來的黃鐵礦用鉛室法會產生被認為是砷化物的紅色沉澱,此黃鐵礦因而不再用來製備硫酸。不過貝吉里斯與甘恩仍然想使用這裡的黃鐵礦而且察覺到紅色沉澱物燃燒時會釋放出類似辣根的氣味,這種氣味並非典型砷化物具有的,而像是碲化物的氣味。所以貝吉里斯最初寫給亞歷山大·馬西特(Alexander Marcet)的信上說到這是碲化物。但是在法倫礦區礦物少有碲化物的事實讓貝吉里斯重新分析這些紅色沉澱物,在1818年他寫給馬西特的第二封信就提到這是一種類似硫與碲的新元素。由於碲是以地球命名,貝吉里斯就以月球來命名這個新元素。[25][26]
1873年衛勒比·史密斯(Willoughby Smith)發現灰硒的電阻與所在環境的光度有關,[27]這個特性讓硒被用來當作感光元件。在1870年代中期,第一個用到硒的商業產品由維爾納·馮·西門子(Werner von Siemens)開發出來,亞歷山大·格拉漢姆·貝爾(Alexander Graham Bell)1879年發明的光電話機(Photophone)也用到了硒元件,硒傳輸的電流正比於照在其上的光線強度,這種現象也被用在測光表與類似裝置的設計。硒的半導體性質應用在許多電子設備,[28][29][30]1930年代初期開始有以硒設計的硒整流器 ,因為效率較好[31][32][33] 取代了氧化銅整流器。此商業運用持續到1970年代,之後又被更便宜且更有效率的矽整流器所取代。
硒的毒性危害到工人,在醫療上引發關注。從動物食用高硒含量的作物而發現硒對動物有毒性。1954年生化學家珍·平森(Jane Pinsent)首先發現微生物中硒與特定生物功能的關聯,[34][35]1957年發現對哺乳動物相當重要。[36][37]1970年代硒被發現出現在兩組不同的酶之中。後來又發現蛋白質中含有硒半胱胺酸。1980年代硒半胱胺酸被發現在密碼子UGA中,其作用於細菌的轉錄機制最早被解開,後來也發現作用在哺乳動物的機制。(參看SECIS元件)[38]

存在
[编辑]天然(即元素態)硒是一種少見的礦物,通常不會形成良好的晶體,但是當它生成時,會是陡峭的菱面體或微小的針狀(毛髮狀)晶體。[39] 由於其他化合物和元素的存在,硒的分離常常變得複雜。
硒在天然界以多種無機物形式存在,包括硒化物、硒酸鹽和亞硒酸鹽,但這些礦物很少見。 常見的透石膏(selenite)是一種石膏(硫酸鈣水合物),雖然和硒一樣以月亮為名,但其並非含硒的礦物,不含亞硒酸根離子,且其早在發現硒之前就被命為該名了。硒是許多金屬硫化物礦物中最常見的雜質,它取代了一小部分的硫。[40][41]
在生命系統中,硒存在於氨基酸:硒代甲硫胺酸、硒代半胱胺酸和甲基硒代半胱胺酸中。在這些化合物中,硒扮演類似於硫的作用。 另一種天然存在的有機硒化合物是二甲基硒。[42][43]
某些土壤富含硒,而硒可以被某些植物進行生物累積。在土壤中,硒最常以可溶形式存在,例如硒酸鹽(類似於硫酸鹽),它們很容易透過淋溶進入河流,[40][41]海水含有相當量的硒。[44][45]
人為的硒來源包括燃煤,以及硫化礦石的開採和冶煉。[46]
生產
[编辑]如銅、鎳或鉛一般,硒最常由許多硫化物礦石中的硒化物而得。取得硒的特別有效方法是來自電解法進行金屬精煉的副產物,例如由銅精煉廠的陽極泥來獲得。另一個來源是來自硫酸廠的鉛室泥漿,但這是一個不再使用的製程。雖可以透過許多方法從這些泥中精製硒,然而,大多數元素態硒是精煉銅或生產硫酸的副產品。[47][48]自銅的溶劑萃取和電解提煉(SX / EW)法發明以來,在全球銅的生產供應中所佔的份額越來越大,[49]這限縮了硒的來源,因為礦石中的硒,只有相當少的部分與銅一起被淋溶出。[50]
硒的工業生產,通常涉及從純化銅的過程中所獲得的殘餘物提取二氧化硒;此法通常先將精煉銅所得之殘餘物氧化,以產生二氧化硒,二氧化硒與水混合並酸化以形成亞硒酸,接著將二氧化硫氣泡通入亞硒酸溶液(還原步驟)得到元素態硒。[51][52]
硒的總儲量估計為93,000噸。2011年全球約生產了2,000噸硒,主要集中在德國(650噸)、日本(630噸)、比利時(200噸)和俄羅斯(140噸),這些數據不包括兩個主要生產國,美國和中國。其價格於2004年急劇從4-5增長至27美元/磅。2004–2010年價格相對穩定,每磅約30美元(100磅包裝),但2011年增加到65美元/磅。2010年的消費量分別為:冶金--30%,玻璃製造--30% ,農業 - 10%,化學品和顏料 - 10%,電子產品 - 10%。中國是硒的主要消費國,每年用量為1,500-2,000噸。[53]
應用
[编辑]錳電解
[编辑]在錳的電解提煉過程中,添加二氧化硒降低了操作電解池所需的能量。為此目的,中國成為最大的二氧化硒消費國。為了產出每噸錳,平均使用2公斤的氧化硒。[53][54]
玻璃製造
[编辑]硒的最大商業用途是在於生產玻璃,這佔了其消費量的約50%。 硒化合物賦予玻璃紅的色澤,這種顏色可抵消大多數玻璃通常存在的鐵雜質所引起的綠色或黃色色調。為此目的,可加入各種亞硒酸鹽和硒酸鹽。對於其它應用可能需要紅色時,能由加入CdSe和CdS的混合物來得到。[55]
合金
[编辑]在黃銅中硒與鉍一起使用來取代毒性較高的鉛。美國根據例如1974年通過的“安全飲用水法”對飲用水中的鉛進行管控,這使得減少黃銅中的鉛含量成為必要;新款黃銅以EnviroBrass的名義上市銷售。[56] 與鉛和硫一樣,硒在0.15%左右的濃度下提高了鋼的可加工性;[57][58] 硒在銅合金中亦可產生相同的機械加工性能。[59]
鋰硒電池
[编辑]鋰硒(Li-Se)電池是鋰電池系列中最有前途的儲能系統之一,[60] 它有機會成為鋰硫電池之外的另一選擇,具有高電流的優點。
太陽能電池
[编辑]光電導體
[编辑]非晶質的硒(α-Se)薄膜可用作平板X射線探測器中的光電導體,[62] 這些探測器使用非晶質的硒將入射的X射線光子直接捕獲並轉換成電荷。[63]
整流器
[编辑]硒整流器最早在1933年使用,它們的使用一直持續到20世紀的90年代。
其它用途
[编辑]製造橡膠中的硫化過程所使用的催化劑,可用少量有機硒化合物來改進。[50]
電子業對硒的需求正在減少。[50] 它的太陽能光電和光電導效應仍可用於影印機、[64][65][66][67] 光電池、照度計和太陽能電池。它在單純複印紙的機器中作為光電導體的用途,曾經是主要的應用,但在20世紀的80年代,隨著越來越多的複印機轉成使用有機光電導體,光電導體的應用下降(儘管這仍然是一個大量的最終用途)。雖然曾經被廣泛使用,硒整流器大部分已被基於矽的整流器取代(或正在被替換)。最值得注意的例外是直流電源突波保護,其中硒抑制器的卓越能量耐受力,使其比金屬氧化物型的壓敏電阻更適用。
硒化鋅是藍光發光二極體(LED)的第一種材料,但現在氮化鎵佔據了市場的主導地位。[68] 硒化鎘曾是量子點中的重要成分。在X射線照術和固態平板X射線照相機中,無晶質的硒片被用來將X射線影像轉換為電荷分佈圖。[69] 游離硒(Se24+)是X射線雷射中使用的活性介質之一。[70]
硒是一些化學反應中的催化劑,但由於毒性問題,它沒有被廣泛使用。在 X射線晶體學中,摻入一個或多個硒原子代替硫,有助於多波長反常色散和單波長反常色散的定相。[71]
硒用於照相印刷品的調色,並且由許多攝影製造商作為色劑出售。硒增強並擴展了黑白攝影圖像的色調範圍,並提高了列印的持久性。[72][73][74]
硒-75在工業射線照相中用作加馬射線源。[75]
對生物体的影響
[编辑]| 硒 | |
|---|---|
| 危险性 | |
| NFPA 704 | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
硒是人體必需的微量礦物質營養素[76],多以氧化態Se(Ⅱ)、Se(Ⅳ)、和Se(Ⅵ)存在,化學性質與硫相似,許多含硫胺基酸,如甲硫胺酸(Met)、半胱氨酸(Cys)、胱氨酸也可用硒取代硫。
硒在動物組織中最常以硒甲硫氨酸(selenomethionine,簡稱SeMet)和硒半胱氨酸(selenocysteine,簡稱SeCys)的形態存在,其中硒甲硫氨酸無法由人體合成,僅能由植物合成後經攝食再經消化代謝而獲得,故食材動植物來源組成將決定硒在飲食中的形式,此外,人體中硒甲硫氨酸可以取代甲硫胺酸;但硒半胱胺酸不能取代半胱胺酸。硒在生理上的功能除了抗氧化外,還調控了甲狀腺的代謝和維他命C的氧化還原態,也曾被提出和抗癌相關的可能性。在食材成分含量裡,同種植物性食材含硒成分變化相當大,乃因各原植物生長地的土壤中硒的濃度不同,當地的動物也隨之反映相應情形,因此硒營養缺乏或過量情形常有地域性關係。
然而,純硒元素和金屬硒化物的毒性相對上不大,而且有些為重要的微量元素之一。嚴重缺乏可引致克山症和溪山症,病徵包括心肌壞死、萎縮、軟骨組織壞死。另外又與甲狀腺腫、呆小症和習慣性流產有關。
含量與分佈
[编辑]人體本身的硒總含量為15mg。男性體內的硒多集中在睪丸及前列腺輸精管中,會隨精液一起排出體外。人體與動物有二個硒儲存庫,一為身體蛋白質的硒甲硫氨酸(SeMet),它的儲存量視飲食中SeMet量而定,其提供硒的量,取決於甲硫胺酸的轉換率;二為肝臟酵素谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的硒。
食物來源
[编辑]硒存在於土壤中,而世界各地的土壤硒含量皆不相同,各地植物所含的硒濃度也因此不同。一般而言,食物中的瘦肉、柿子、蒜頭、海產、蔥、南瓜等含有多量的硒。動物製品的硒含量(約0.4-1.5μg/g)比植物體高;一般植物穀類的硒含量範圍可在<0.1μg/g─>0.8μg/g;在海洋生物中,硒類的含量也比植物多,但由於魚類(尤其是體內含汞的魚類)會形成汞─硒複合體,造成對硒的生物利用性極低,故雖然硒在魚類的含量多但對於魚類本身的利用性極低;至於肉類會提供0.1-0.4μg/g;乳製品的硒含量則為<0.3μg/g。
另外,全穀物和核果種子也是好的來源。在飲水中提供的硒攝取量十分有限,除非水流經含硒量高的土壤地區才可能有較高的含量。
植物中的硒是因硒取代硫而進入植物體,硒型態有甲硒胺酸、硒胺酸與其代謝產物等。動物生長需要硒,在攝食植物時獲得甲硒胺酸。飲食中硒的形式取決於動植物食品的組合。
| 食品名稱/重量 | 硒(μg) |
|---|---|
| 鮪魚 / 3 oz | 68 |
| 火腿(瘦肉)/ 3 oz | 42 |
| 蛤蜊 / 3 oz | 41 |
| 鮭魚 / 3 oz | 40 |
| 義大利蛋麵 /1杯 | 35 |
| 沙朗牛排 / 3 oz | 28 |
| 雞胸肉 / 3 oz | 20 |
| Special K cereal | 17 |
| 麩燕麥片 / 1杯 | 14 |
| 全麥麵包 / 1片 | 10 |
| 燕麥糊 / 1/2杯 | 10 |
| 白麵包 / 1片 | 9 |
| 葡萄乾麥片 / 1杯 | 4 |
建議量
[编辑]民眾的實際硒攝取量會因地而異,美國平均每日81μg、加拿大每日113–220μg,高於RDA。均飲食估計可提供約104-124 μg的硒。成人之上限攝取量(UL)訂為400μg。
硒的建議量在1980年只能根據估計而得,稱為Estimated safe and adequate dietary intake(ESADDI);2000年則根據需要量之科學研究而訂定每日建議攝取量(RDA)。
過去曾有關於臺灣境內硒之飲食攝取量的研究[78],分析結果六日飲食的硒攝取範圍在104~124μg(1.3~1.6μmol)/day,平均值為112μg(1.4μmol)/day,加上臺灣非低硒區域,且食品貿易進出口抹去食品在硒含量上的地域性限制,推測臺灣境內應無硒營養缺乏的問題。
- 硒的營養來源:
- 影響硒營養需求量的因素[79]
- 1.生物吸收率:見「吸收」。
- 2.性別:早期來自中國研究報告,當時硒缺乏現象比現在嚴重,在此情形顯示產齡女性較易罹患克山病(Keshan disease);另外,過去20年報告顯示孩童不論男女有相同的比例罹患克山病;性別的影響必須在硒攝取量極低的情下才會顯現,假設考慮女性有較高機率罹患克山病,硒對各年齡層的需求量將以男性參考體重為基準。
| 年齡 | 美國 (μg/day)[79] | 台灣 (μg/day)[78] |
|---|---|---|
| 0 個月~ | AI=15 | 15 |
| 6個月~ | AI=20 | 20 |
| 1歲~ | 20 | 20 |
| 4歲~ | 30 | 25 |
| 7歲~ | 30 | 30 |
| 10歲~ | 40 | 40 |
| 13歲~ | 40 | 50 |
| 14歲~ | 55 | 50 |
| 孕婦 | 60 | 60 |
| 哺乳 | 70 | 70 |
- RDA(建議攝取量 Recommanded Dietary Allowances):美國原始的飲食標準,代表同年齡層中,97~98%人的營養需求量。
- AI(足夠攝取量 Adequate Intake):未能有足夠的實驗資訊建立EAR的情形下,所推估維持健康狀態的量,常用在一歲以下的嬰兒。
| 年齡 | 美國 (μg)[79] | 台灣 (μg)[78] |
|---|---|---|
| 0月~ | 45 | 35 |
| 3月~ | 45 | 50 |
| 6月~ | 60 | 60 |
| 9月~ | 60 | 65 |
| 1歲~ | 90 | 90 |
| 4歲~ | 150 | 135 |
| 7歲~ | 150(4~8歲) | 185 |
| 10歲~ | 280 | 280 |
| 13歲~ | 400(14歲~) | 360 |
| 16歲~ | 400 | 400 |
| 19歲~ | 400 | 400 |
| 懷孕期 | 400 | 400 |
| 哺乳期 | 400 | 400 |
- UL(Tolerable Upper Intake Level 上限攝取量):對於97~98%的人不可能產生不良健康影響之每日最大營養攝取量。
對硒的特殊需求者
[编辑]- 以全靜脈注射營養(TPN,Total Parenteral Nutrition)為唯一營養來源者,需要硒的營養補充劑。
- 有嚴重腸胃道疾病(例如:克隆氏症)或曾移去一大段小腸者有硒營養缺乏的風險。
- 碘營養缺乏者。研究指出硒缺乏會惡化碘缺乏的症狀,適當補充硒可以緩解碘缺乏症狀以及在神經系統的影響。
- 使用化療藥物者需要硒營養的補充。有研究指出,多種型態的硒可以減少化療藥物(例如:順鉑,cisplatin)所引發腎和骨髓的傷害。
資料來源:[80]
吸收
[编辑]有機和無機形式的硒都可以很有效率的被吸收,只是發生在不同的腸道部位;吸收率並非調控動物體硒之恆態的機制。十二指腸是硒主要的吸收位置,空腸和迴腸則有少量的吸收,但胃則沒有吸收硒之能力。甲硒胺酸的吸收效率比亞硒酸鹽(selenite)來得好。含有硒的胺基酸吸收是利用胺基酸運送系統,吸收率可達到80%。甲硒胺酸的吸收率比硒胺酸好。在某些研究中,亞硒酸鹽的吸收率可達到85%以上,因與腸道中物質的交互作用,吸收率較有變化。一旦吸收後,保留程度高於硒酸鹽。硒酸鹽(selenate)的吸收又比亞硒酸鹽好,幾乎被完全吸收;但併入組織前,大部分會由尿中排除。
維生素A、維生素C、維生素E都會增加硒的吸收,當在小腸腔的谷胱甘肽(glutathione,GSH)濃度低時也會增加吸收。重金屬(例:水銀)和植酸被認為會抑制硒的吸收。
高劑量的維生素C、鋅及重金屬(例如:汞)會減少硒的吸收;但若在飲食中合併食用硒及維生素C,硒可以和飲食中的胺基酸形成保護結構進而不影響其吸收[81]。
转运
[编辑]小腸吸收之硒會和運輸蛋白結合經血液攜帶至肝和其他組織。腎臟、肝臟、心臟、胰臟和肌肉都是硒含量較高的組織,肺臟、腦部、骨骼和紅血球也含有硒。目前如何調控硒從組織釋放到血漿裡或是組織從血漿裡吸收的作用機制仍然不明。存在血漿中的硒,與許多不同分子結合成不同的形式存在著。其中最多的就是硒半胱氨酸(Selenocysteine,Sec):由硒原子取代原本在半胱氨酸中的硫原子而存在,由硒蛋白質P(Selenoprotein P)這個運輸蛋白所攜帶,而這個運輸形式在血漿中也佔了一半以上。其它類型的運輸形式還有甲硒氨酸(Selenomethionine),由硒原子取代原本在甲硫氨酸中的硫原子而存在,也是由硒蛋白質P所攜帶;除了這兩種有機硒之外,也有無機硒的運輸形式:硒酸鹽、亞硒酸鹽、硒化氢,與在人體血液中α球蛋白及β球蛋白的巯基(sulfhydryl groups)結合,例如:極低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)。
而前述各種帶有硒且存在於血漿中的分子,均會被細胞所吸收。而細胞則釋放甲基化的硒化物至血漿中,再經由尿液將其排出體外。
- 分子特性
- 硒蛋白質P(Selenoprotein P)- 是一種含有硒半胱氨酸的血漿蛋白,也是一種運輸蛋白,主要是由肝臟合成,在血漿中大約有50%以上的硒是和含硒蛋白質P結合。含硒蛋白質P的結構最多可以帶有十個Sec殘基,當硒量下降時也會使殘基合成量下降。
- α球蛋白(α-globulin)- 其中又分成α 1-globulin及α 2-globulin。兩者均為醣蛋白,亦皆可幫助脂質的運輸。其中α 2-globulin又有一些不同的功能:幫助血紅素的運輸、銅運輸、血液凝集以及調控氧化酶的活性。
- β球蛋白(β-globulin)- 可以幫助脂質的運輸以及鐵和其他礦物質的運輸。
代謝
[编辑]含硒胺基酸和無機態硒都會在組織中進行代謝。從飲食而來的甲硒胺酸其利用情形和甲硫胺酸相似,可儲存在胺基酸代謝池中,用於合成蛋白質,也可代謝成硒半胱氨酸和硒胱胺酸。
硒胺酸可以從飲食中直接得到,或是經由甲硒胺酸代謝而來。硒半胱氨酸經由β-硒半胱氨酸裂解酶作用之後產生游離態硒。游離態硒可以從谷胱甘肽(GSH)得到氫,然後生成硒化物(selenide)。硒化物有兩個代謝途徑,其一是經過甲基化作用後藉由尿液排出體外,或是形成硒代磷酸鹽(selenophosphate),這是體內重要含硒酵素的前驅物,例如5'-脫碘酶(5'-deiodinase)或榖胱甘肽過氧化酶(glutathione peroxidase)。
從食物中得來的硒酸鹽在體內可轉換成亞硒酸鹽,更進一步代謝成硒代谷胱甘肽(selenodiglutathione)及硒離子,後者成為硒蛋白或酵素的原料。
生化功能
[编辑]硒最主要的功能是作為各種硒蛋白(selenoprotein)的組成分,進而影響其酵素活性或功能。
- 谷胱甘肽過氧化物酶(glutathione peroxidase,GPX)
- 甲狀腺素脫碘酶(Iodothyronine Deiodinases,IDI或DI)
- 脫碘酶是含硒蛋白質,酵素的活性區是硒半胱氨酸。已知有三種亞型。第一型存在肝臟、腎臟和肌肉,第二型及第三型存在皮膚、腦下垂體、脂肪細胞和腦。主要功能是催化甲狀腺素和相關代謝物脫去碘原子(圖)
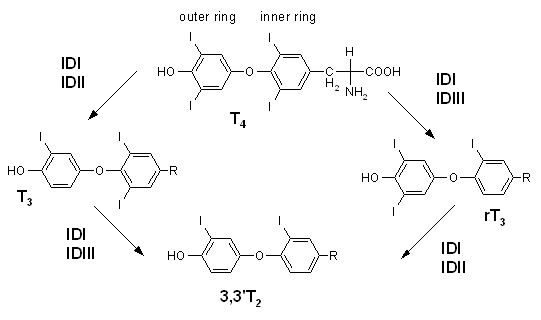
甲狀腺素脫碘酶的作用
- 脫碘酶是含硒蛋白質,酵素的活性區是硒半胱氨酸。已知有三種亞型。第一型存在肝臟、腎臟和肌肉,第二型及第三型存在皮膚、腦下垂體、脂肪細胞和腦。主要功能是催化甲狀腺素和相關代謝物脫去碘原子(圖)
- 「硫氧化還原蛋白」還原酶(硫氧还蛋白还原酶,TrxR)
- 酵素的活性區有硒半胱氨酸,並含有FAD。此酵素存在血液、皮膚和肝臟等組織。主要反應是將氧化態的「硫氧化還原蛋白」(thioredoxin)中的雙硫鍵(disulfide bond)予以還原。還原態的「硫氧化還原蛋白」可以將氫原子提供給其他化合物(圖[83])。
- 硒代磷酸鹽合成酶(Selenophosphate synthetase)
- 硒代磷酸鹽合成酶有兩種亞型,其中一型含硒半胱氨酸,催化硒離子磷酸化成硒代磷酸鹽的反應,這是合成含硒蛋白質的必備原料(圖[84])。
- 硒蛋白質P(Selenoprotein P)
- 這是硒的運輸蛋白質。有移除自由基的作用,具有抗氧化劑的功能。當體內的硒含量不足時,硒蛋白質P會優先獲得硒。
- 硒蛋白質W(Selenoprotein W)
- 含有硒半胱氨酸,主要存在心肌、骨骼肌和其它組織的細胞質中,可能扮演抗氧化劑的功能。
硒蛋白生合成分子機制
[编辑]硒蛋白的硒胺酸是在轉譯過程合成並直接利用的,稱為轉譯插入反應(translational incorporation)。合成途徑需要的蛋白質有:硒胺酸合成酶selenocysteine synthase、硒半胱胺酸專用延長因子selenocysteine-specific elongation factor、selenocysteine-specific tRNA(tRNASec)、硒代磷酸鹽合成酶 selenophosphate synthetase。硒胺酸對應的基因密碼是UGA,此密碼通常當做終止密碼,但若配合mRNA序列3’端未轉譯區域具有獨特的二級結構selenocysteine insertion sequence,則成為轉譯硒胺酸的密碼。
自然界中有許多細菌、植物或動物都能利用硒化氫(hydrogen selenide)合成多種有機化合物,如大蒜中的selenide garlic就是含有高單位的Se-methylselenocysteine。人類需要直接攝取有機的硒化物。自然界中甲硒甲硫胺酸(selenomethionine)插入硒蛋白(selenoprotein)中是直接取代甲硫胺酸(methionine)的位置而得。也就是說在含甲硒胺酸的蛋白質合成過程是直接把甲硒胺酸當作甲硫胺酸編入,並沒有特殊密碼。人類再利用甲硒胺酸釋出的硒,先合成磷酸硒(selenophosphate)再生成硒半胱胺酸(selenocysteine,Sec)或其他小分子,再利用UGA的密碼將Sec編入人體的特殊蛋白硒蛋白質。人體硒的儲存者可能是硒蛋白質 P(selenoprotein p),在已被發現的14種硒蛋白質中只有硒蛋白質 P含有10到12個Sec,其Sec數可以隨血中硒的濃度而改變。其他的硒蛋白質都只有單一個Sec。所以硒帶蛋白質 P可能是人類硒的儲存池,當食物中硒供應不足時硒蛋白質 P就會釋出硒供人體利用,但是 至今仍無法證實其功能。
合成反應主要有四個步驟(圖示[85])
- 步驟一:tRNASec與Serine經由Seryl-tRNA synthetase作用,生成Seryl-tRNASec。
- 步驟二: 硒離子和ATP經由硒代磷酸鹽合成酶反應生成硒代磷酸鹽。
- 步驟三:Seryl-tRNASec和硒代磷酸鹽經由硒胺酸合成酶作用,產生含硒胺基酸殘基Selenocysteyl-tRNASec。
- 步驟四:轉譯時由SBP2和SECIS結合,繼而和tRNASec-eEFsec複合物結合,再與核醣體作用而誘導硒胺酸插入蛋白質(圖示[86])。
缺乏與毒性
[编辑]缺乏症候群
[编辑]- 動物缺硒
硒缺乏會引起牲畜類動物疾病。硒缺乏造成硒蛋白質酵素活性下降。若硒以外之營養狀況良好,硒缺乏僅造成輕微的臨床症狀。若伴有營養不良、化學藥物、感染等壓力,則會動物會出現嚴重病症。例如:硒缺乏加上維生素 E缺乏可導致大鼠與豬的之脂質過氧化與肝臟壞死,使豬、牛、羊的心臟損傷。在受感染的小鼠體內,硒缺乏可導致非致病性的coxsackie B3病毒轉變為具致病性的病毒,而造成小鼠的心肌炎。
- 人體缺硒
- 人體攝取不足時,會造成克山病和溪山症(Kashin-Beck disease)。
- 克山病的主要病癥為心肌病變(cardiomyopathy),包括心律加快、心電圖異樣、充血性心臟衰竭、心臟組織的多病灶壞疽等,嚴重時會導致生命危險甚至死亡。
- 克山症(Keshan disease)是一種因為飲食缺乏微量元素硒所造成的充血性心肌病變症。此病症的命名來自於中国黑龙江省克山县,黑龙江省克山县是此病高流行的地區,發現是因為此地的土壤缺乏硒。克山症會造成心肌病變,好發於孩童和懷孕的婦女。補充硒可以改善病症,目前也發現此病症和病毒感染有關;特別是心肌病毒感染,如科薩奇病毒引起的心肌炎或感染過敏性心肌炎。本病的發生除了黑龍江省之外,在吉林、遼寧、內蒙古、河北、河南、山東、山西、陝西、甘肅、四川、雲南、西藏等地區都有病例,且病區多在荒僻山丘、高原及草原的農村,城鄉地區較少發病。
- 克山病的症狀主要是造成擴張性心肌病變(Dilated Cardiomyopathy)。心肌呈變形、壞死、和疤痕形成。心臟擴張腫大,多數左心室擴張比右心室嚴重。心臟的切面可以看到大小不等黃色、灰白色壞死、纖維化的疤痕;在顯微鏡下也可以觀察到心肌變性、肌纖維腫大、壞死的現象。適量的硒對缺硒造成的心肌損害有明顯的保護作用及抗氧化能力。硒是GSH-px的組成成分之一,該酶的主要作用是還原脂質過氧化物,清除自由基進而保護細胞膜的完整性。而低硒會造成GSH-px活性降低,造成心肌膜系統損傷。
- 克山症的臨床症狀主要為急性和慢性心功能不全、心臟擴大、心律不整以及腦、肺、腎等栓塞,根據1982年中華人民共和國全國克山病防治經驗交流會上的分形如下:
- 急性:突然發病的狀況,在中国大陆北方,急型病多發生在冬季,會因寒冷、過勞、感染、暴飲暴食或分娩等誘因而發病。重症者會出現心源性休克、急性肺水腫和嚴重心律失常的症狀。一開始可能感到頭暈、心窩部不適、反覆惡心嘔吐、吐黃水,繼而煩躁不安。嚴重者可在數小時或數天內死亡。患者常會面色蒼白,四肢冰冷,血壓降低,呼吸減慢。心臟一般輕度大,心音弱,尤其第一心音減弱,舒張期和收縮期會出現雜音。心律不整,主要為室性早搏、陣發性心動過速和房室傳導阻滯。急性心衰竭時肺部出現雜音,此外肝腫大和下肢水腫亦常見。
- 亞急型:發病不如急型快速。患者多為幼童,2~5歲佔85%。以春、夏季發病為多數。會出現心源性休克或充血性心力衰竭。發病初期表現為精神萎靡、咳嗽、呼吸急促、食欲不振、面色灰暗和全身水腫。亦會出現心臟擴大、奔馬律和肝腫大。腦、肺、腎等處的栓塞並不少見。
- 慢型:起病緩慢,很難被病患所察覺,亦可由急型、亞急型或潛在型轉化而來。臨床表現主要為慢性充血性心力衰竭,有心悸、呼吸急促,勞累後加重,並會有少尿、水腫和腹水。體檢觀察發現心臟向兩側明顯擴大,心音低,會聽到輕中度收縮期雜音和舒張期奔馬律,晚期可能出現右心衰竭的體徵如頸靜脈恕張、肝腫大和下肢浮腫等。嚴重者有胸、腹腔積液,心源性肝硬化等症狀。心律不整的症狀如室性早搏、心動過速、傳導阻滯、心房顫動等。
- 潛在型:可發生在平時看似健康的人,亦可為其他型好轉的階段。前者常無症狀,可照常勞動或工作,而在普查中被發現,此屬穩定的潛在型。由其他型轉變而來者可有心悸、呼吸急促、頭昏、無力等症狀。心電圖會有ST-T變化,QT間期延長和過早搏動。潛在型心臟雖受損,但心功能代償良好。心臟不增大或輕度增大。
- 克山症的預防措施首應注意環境衛生和個人衛生。保護水源,改善水質。改善營養條件,防止偏食,尤其對孕婦、產婦和兒童更應加強補充蛋白質,各種維生素及人體必需的微量元素,包括鎂、碘等,並防治大骨節病、地方性甲狀腺病。且流行區推廣預防性服藥,採用硒酸鈉作為預防性服藥,經多年推廣,證明可明顯降低發病率。通常採用每10天口服一次,1~5歲1mg,6~10歲2mg,11~15歲3mg,16歲以上4mg。非發病季節可停服三個月。此外,流行區推薦使用含硒食鹽。農村使用含硒液浸過的種子種植。植物根部施加含硒肥料以提高農作物中含硒量。
- 溪山症的主要病徵為骨關節病變(osteoarthropathy),包含骨關節、小腿、手臂的軟骨骺版退化與壞死。此疾病為地域性、多發性、變形性骨關節病變,出現於亞洲低硒地區青春期前兒童與青少年。上述症狀僅發生於硒缺乏者,但改善硒營養狀況並無法完全避免此疾病。
- 兒童和全靜脈營養病人發生硒缺乏時,易導致關節僵硬、肌肉痛、頭髮和皮膚失去色素顏色、生長遲滯、指甲白化等症狀。生長遲滯的現象與硒在甲狀腺素的代謝有關。
毒性
[编辑]- 化合物形式與毒性
元素態的硒和大部分的金屬硒化物毒性較小,因為生物可用性(bioavailability)小。硒酸鹽和亞硒酸鹽的毒性較大,硒化氫(hydrogen selenide)的毒性最大,是一種氣狀的硒化合物。有機態硒化物如甲硒胺酸和硒胺酸與含硫胺基酸相似,因此毒性較無機態硒為低,但其吸收率高,雖不致造成急性毒害,但長期大量攝取,會產生與無機硒相似的中毒症狀。
硒中毒(selenosis)可能發生在工人以及攝取過多硒的族群。目前訂定硒的上限攝取量為每天400μg;硒的副作用發生最低量(LOAEL)為910 μg。攝食過量時,極易導致毛髮異樣、指甲脫落、腳趾甲異樣等副作用,不過並無飲食硒中毒的案例。
中毒的嚴重程度與所攝取的硒含量成正比的關係。中毒的症狀包含:反胃嘔吐、疲勞、腹瀉、頭髮與指甲損壞、異常刺痛感等,也會干擾硫的正常代謝以及抑制蛋白質合成。服用含有高量硒的藥物會造成急性硒中毒,嚴重過量會導致肝硬化、肺水腫,甚至喪命。治療硒在體內不平衡所造成的症狀目標:1.降低關節炎症狀;2.降低血壓;3.改善皮膚、毛髮及指(趾)甲問題。
食物硒含量取決於土壤硒含量。美國雖有高硒地區,但農業部(USDA)已確認這些地區,並禁止飼養動物作為食物來源。美加地區食物運銷系統發達,可確保個人不會只攝食到當地農產,保障民眾硒攝取量不致過高或過低。
- 硒中毒的生化指標
硒蛋白質含量在硒需要量達到後,即呈現飽和狀態,不再隨硒攝取量增加而上升,因此無法被用於評估硒的毒性。測量組織(血液、血漿)的硒含量有助於評估硒中毒的危險性。尿液硒排除量在特定控制之條件下,可作為硒毒性的指標。臨床症狀如毛髮、指甲易碎裂脫落等常被報導,是主要的評估終點。硒的甲基化代謝物因測量誤差大,且受許多因素影響,不適用於硒中毒指標。
與其他營養素的關係
[编辑]體內含鉛量增多時會有硒濃度下降的現象。銅不足會降低榖胱甘肽過氧化酶和5'-脫碘酶的活性。硒與甲硫胺酸的利用有關。從食物攝取的硒有一部分是甲硒胺酸的形式,可作為合成蛋白質的材料。當甲硫胺酸供應不足時,甲硒胺酸會成為它的替代物而用在蛋白質的合成,而不會代謝成為硒離子以供利用,間接引發硒的不足。鐵的缺乏會減少榖胱甘肽過氧化酶的合成,減少組織中的硒濃度。維生素E和榖胱甘肽過氧化酶同樣有抗氧化的功能,在使細胞膜和DNA免於自由基的攻擊機制上,硒和維生素E常一起作用,在功能上也有互補作用,其中一者濃度較高會減低另一濃度較低者所造成的影響[87]。
参阅
[编辑]参考文献
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Azzolini, O.; Beeman, J. W.; Bellini, F.; Beretta, M.; Biassoni, M.; Brofferio, C.; Bucci, C.; Capelli, S.; et al. Measurement of the 2νββ Decay Half-Life of 82Se with the Global CUPID-0 Background Model. Physical Review Letters. 2023-11-29, 131 (22). ISSN 0031-9007. doi:10.1103/PhysRevLett.131.222501.
- ^ Ruyle, George. Poisonous Plants on Arizona Rangelands (PDF). The University of Arizona. [2009-01-05]. (原始内容 (PDF)存档于2004-07-15).
- ^ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 House, James E. Inorganic chemistry. Academic Press. 2008: 524. ISBN 978-0-12-356786-4.
- ^ 5.0 5.1 5.2 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ YouTube上的加熱硒影片
- ^ Jafar, Mousa M. Abdul-Gader; Saleh, Mahmoud H.; Ahmad, Mais Jamil A.; Bulos, Basim N.; Al-Daraghmeh, Tariq M. Retrieval of optical constants of undoped amorphous selenium films from an analysis of their normal-incidence transmittance spectra using numeric PUMA method. Journal of Materials Science: Materials in Electronics. 2016-04-01, 27 (4): 3281–3291. ISSN 0957-4522. doi:10.1007/s10854-015-4156-z (英语).
- ^ Saleh, Mahmoud H.; Ershaidat, Nidal M.; Ahmad, Mais Jamil A.; Bulos, Basim N.; Jafar, Mousa M. Abdul-Gader. Evaluation of spectral dispersion of optical constants of a-Se films from their normal-incidence transmittance spectra using Swanepoel algebraic envelope approach. Optical Review. 2017-06-01, 24 (3): 260–277. Bibcode:2017OptRv..24..260S. ISSN 1340-6000. doi:10.1007/s10043-017-0311-5 (英语).
- ^ Minkov, D.A.; Gavrilov, G.M.; Angelov, G.V.; Moreno, J.M.D.; Vazquez, C.G.; Ruano, S.M.F.; Marquez, E. Optimisation of the envelope method for characterisation of optical thin film on substrate specimens from their normal incidence transmittance spectrum. Thin Solid Films. 2018, 645: 370–378. Bibcode:2018TSF...645..370M. doi:10.1016/j.tsf.2017.11.003.
- ^ The half-life of 79Se. Physikalisch-Technische Bundesanstalt. 2010-09-23 [2012-05-29]. (原始内容存档于2011-09-27).
- ^ Jörg, Gerhard; Bühnemann, Rolf; Hollas, Simon; et al. Preparation of radiochemically pure 79Se and highly precise determination of its half-life. Applied Radiation and Isotopes. 2010, 68 (12): 2339–2351. PMID 20627600. doi:10.1016/j.apradiso.2010.05.006.
- ^ 82Se对于所有实际用途都可看做稳定
- ^ 13.0 13.1 13.2 Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick. Inorganic chemistry. San Diego: Academic Press. 2001: 583. ISBN 978-0-12-352651-9.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997: 780. ISBN 0-7506-3365-4.
- ^ Seppelt, K.; Desmarteau, Darryl D. Selenoyl difluoride. Inorganic Syntheses 20. 1980: 36–38. ISBN 978-0-471-07715-2. doi:10.1002/9780470132517.ch9. The report describes the synthesis of selenic acid.
- ^ Lenher, V. Action of selenic acid on gold. Journal of the American Chemical Society. April 1902, 24 (4): 354–355 [2022-03-05]. doi:10.1021/ja02018a005. (原始内容存档于2020-11-07).
- ^ Xu, Zhengtao. Devillanova, Francesco A. , 编. Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. 2007: 460. ISBN 978-0-85404-366-8.
- ^ Proctor, Nick H.; Hathaway, Gloria J. Hughes, James P. , 编. Proctor and Hughes' chemical hazards of the workplace 5th. Wiley-IEEE. 2004: 625. ISBN 978-0-471-26883-3.
- ^ 19.0 19.1 19.2 《化学元素反应手册》. P528. 第三节 硒
- ^ Woollins, Derek; Kelly, Paul F. The Reactivity of Se4N4 in Liquid Ammonia. Polyhedron. 1993, 12 (10): 1129–1133. doi:10.1016/S0277-5387(00)88201-7.
- ^ Kelly, P.F.; Slawin, A.M.Z.; Soriano-Rama, A. Use of Se4N4 and Se(NSO)2 in the preparation of palladium adducts of diselenium dinitride, Se2N2; crystal structure of [PPh
4]
2[Pd
2Br
6(Se
2N
2)]. Dalton Transactions. 1997, (4): 559–562. doi:10.1039/a606311j. - ^ Siivari, Jari; Chivers, Tristram; Laitinen, Risto S. A simple, efficient synthesis of tetraselenium tetranitride. Inorganic Chemistry. 1993, 32 (8): 1519–1520. doi:10.1021/ic00060a031.
- ^ Erker, G.; Hock, R.; Krüger, C.; Werner, S.; Klärner, F.G.; Artschwager-Perl, U. Synthesis and Cycloadditions of Monomeric Selenobenzophenone. Angewandte Chemie International Edition in English. 1990, 29 (9): 1067–1068. doi:10.1002/anie.199010671.
- ^ Berzelius, J.J. Lettre de M. Berzelius à M. Berthollet sur deux métaux nouveaux [Letter from Mr. Berzelius to Mr. Berthollet on two new metals]. Annales de Chimie et de Physique. 2nd series. 1818, 7: 199–206 [2019-08-03]. (原始内容存档于2020-03-11) (法语). From p. 203: "Cependant, pour rappeler les rapports de cette dernière avec le tellure, je l'ai nommée sélénium." (However, in order to recall the relationships of this latter [substance (viz, selenium)] to tellurium, I have named it "selenium".)
- ^ Weeks, Mary Elvira. The discovery of the elements. VI. Tellurium and selenium. Journal of Chemical Education. 1932, 9 (3): 474. Bibcode:1932JChEd...9..474W. doi:10.1021/ed009p474.
- ^ Trofast, Jan. Berzelius' Discovery of Selenium. Chemistry International. 2011, 33 (5): 16–19 [2019-08-03]. (原始内容存档于2018-06-29). PDF (页面存档备份,存于互联网档案馆)
- ^ See:
- Smith, Willoughby. The action of light on selenium. Journal of the Society of Telegraph Engineers. 1873, 2 (4): 31–33 [2019-08-03]. doi:10.1049/jste-1.1873.0023. (原始内容存档于2021-01-03).
- Smith, Willoughby. Effect of light on selenium during the passage of an electric current. Nature. 20 February 1873, 7 (173): 303 [2019-08-03]. Bibcode:1873Natur...7R.303.. doi:10.1038/007303e0. (原始内容存档于2021-01-03).
- ^ Bonnier Corporation. Action of light on selenium. Popular Science. 1876, 10 (1): 116 [2019-08-03]. (原始内容存档于2020-03-17).
- ^ Levinshtein, M. E.; Simin, G. S. Earliest semiconductor device. Getting to Know Semiconductors. 1992-12-01: 77–79 [2019-08-03]. ISBN 978-981-02-3516-1. (原始内容存档于2020-03-17).
- ^ Winston, Brian. Media Technology and Society: A History: From the Telegraph to the Internet. 1998-05-29: 89 [2019-08-03]. ISBN 978-0-415-14229-8. (原始内容存档于2020-03-14).
- ^ Morris, Peter Robin. A History of the World Semiconductor Industry. 1990: 18 [2019-08-03]. ISBN 978-0-86341-227-1. (原始内容存档于2020-03-09).
- ^ Bergmann, Ludwig. Über eine neue Selen-Sperrschicht-Photozelle. Physikalische Zeitschrift. 1931, 32: 286–288.
- ^ Waitkins, G. R.; Bearse, A. E.; Shutt, R. Industrial Utilization of Selenium and Tellurium. Industrial & Engineering Chemistry. 1942, 34 (8): 899–910. doi:10.1021/ie50392a002.
- ^ Pinsent, Jane. The need for selenite and molybdate in the formation of formic dehydrogenase by members of the Coli-aerogenes group of bacteria. Biochem. J. 1954, 57 (1): 10–16. PMC 1269698
 . PMID 13159942. doi:10.1042/bj0570010.
. PMID 13159942. doi:10.1042/bj0570010. - ^ Stadtman, Thressa C. Some Functions of the Essential Trace Element, Selenium. Trace Elements in Man and Animals 10. Trace Elements in Man and Animals 10. 2002: 831–836. ISBN 978-0-306-46378-5. doi:10.1007/0-306-47466-2_267.
- ^ Schwarz, Klaus; Foltz, Calvin M. Selenium as an Integral Part of Factor 3 Against Dietary Necrotic Liver Degeneration. Journal of the American Chemical Society. 1957, 79 (12): 3292–3293. doi:10.1021/ja01569a087.
- ^ Oldfield, James E. Selenium: A historical perspective. Selenium. Selenium. 2006: 1–6. ISBN 978-0-387-33826-2. doi:10.1007/0-387-33827-6_1.
- ^ Hatfield, D. L.; Gladyshev, V. N. How Selenium Has Altered Our Understanding of the Genetic Code. Molecular and Cellular Biology. 2002, 22 (11): 3565–3576. PMC 133838
 . PMID 11997494. doi:10.1128/MCB.22.11.3565-3576.2002.
. PMID 11997494. doi:10.1128/MCB.22.11.3565-3576.2002. - ^ Native Selenium. Webminerals. [2009-06-06]. (原始内容存档于2009-07-15).
- ^ 40.0 40.1 Kabata-Pendias, A. Geochemistry of selenium. Journal of Environmental Pathology, Toxicology and Oncology. 1998, 17 (3–4): 173–177. PMID 9726787.
- ^ 41.0 41.1 Fordyce, Fiona. Selenium Geochemistry and Health. AMBIO: A Journal of the Human Environment. 2007, 36: 94–97. doi:10.1579/0044-7447(2007)36[94:SGAH]2.0.CO;2.
- ^ Wessjohann, Ludger A.; Schneider, Alex; Abbas, Muhammad; Brandt, Wolfgang. Selenium in chemistry and biochemistry in comparison to sulfur. Biological Chemistry. 2007, 388 (10): 997–1006. PMID 17937613. doi:10.1515/BC.2007.138.
- ^ Birringer, Marc; Pilawa, Sandra; Flohé, Leopold. Trends in selenium biochemistry. Natural Product Reports. 2002, 19 (6): 693–718. PMID 12521265. doi:10.1039/B205802M.
- ^ Amouroux, David; Liss, Peter S.; Tessier, Emmanuel; et al. Role of oceans as biogenic sources of selenium. Earth and Planetary Science Letters. 2001, 189 (3–4): 277–283. Bibcode:2001E&PSL.189..277A. doi:10.1016/S0012-821X(01)00370-3.
- ^ Haug, Anna; Graham, Robin D.; Christophersen, Olav A.; Lyons, Graham H. How to use the world's scarce selenium resources efficiently to increase the selenium concentration in food. Microbial Ecology in Health and Disease. 2007, 19 (4): 209–228. PMC 2556185
 . PMID 18833333. doi:10.1080/08910600701698986.
. PMID 18833333. doi:10.1080/08910600701698986. - ^ Public Health Statement: Selenium (PDF). Agency for Toxic Substances and Disease Registry. [2009-01-05]. (原始内容存档 (PDF)于2009-01-15).
- ^ Public Health Statement: Selenium – Production, Import/Export, Use, and Disposal (PDF). Agency for Toxic Substances and Disease Registry. [2009-01-05]. (原始内容存档 (PDF)于2009-01-15).
- ^ Chemistry: Periodic Table: selenium: key information. webelements. [2009-01-06]. (原始内容存档于2008-05-09).
- ^ Bartos, P. J. SX-EW copper and the technology cycle. Resources Policy. 2002, 28 (3–4): 85–94. doi:10.1016/S0301-4207(03)00025-4.
- ^ 50.0 50.1 50.2 Naumov, A. V. Selenium and tellurium: State of the markets, the crisis, and its consequences. Metallurgist. 2010, 54 (3–4): 197–200. doi:10.1007/s11015-010-9280-7.
- ^ Hoffmann, James E. Recovering selenium and tellurium from copper refinery slimes. JOM. 1989, 41 (7): 33–38. Bibcode:1989JOM....41g..33H. doi:10.1007/BF03220269.
- ^ Hyvärinen, Olli; Lindroos, Leo; Yllö, Erkki. Recovering selenium from copper refinery slimes. JOM. 1989, 41 (7): 42–43. Bibcode:1989JOM....41g..42H. doi:10.1007/BF03220271.
- ^ 53.0 53.1 Selenium and Tellurium: Statistics and Information. United States Geological Survey. [2012-05-30]. (原始内容存档于2012-05-08).
- ^ Sun, Yan; Tian, Xike; He, Binbin; et al. Studies of the reduction mechanism of selenium dioxide and its impact on the microstructure of manganese electrodeposit. Electrochimica Acta. 2011, 56 (24): 8305–8310. doi:10.1016/j.electacta.2011.06.111.
- ^ Bernd E. Langner "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a23_525.
- ^ Davis, Joseph R. Copper and Copper Alloys. ASM Int. 2001: 91 [2019-08-10]. ISBN 978-0-87170-726-0. (原始内容存档于2020-03-08).
- ^ Isakov, Edmund. Cutting Data for Turning of Steel. 2008-10-31: 67 [2019-08-10]. ISBN 978-0-8311-3314-6. (原始内容存档于2020-03-18).
- ^ Gol'Dshtein, Ya. E.; Mushtakova, T. L.; Komissarova, T. A. Effect of selenium on the structure and properties of structural steel. Metal Science and Heat Treatment. 1979, 21 (10): 741–746. Bibcode:1979MSHT...21..741G. doi:10.1007/BF00708374.
- ^ Davis, Joseph R. Copper and Copper Alloys. ASM International. 2001: 278 [2019-08-10]. ISBN 978-0-87170-726-0. (原始内容存档于2020-03-21).
- ^ Eftekhari, Ali. The rise of lithium–selenium batteries. Sustainable Energy & Fuels. 2017, 1: 14–29. doi:10.1039/C6SE00094K.
- ^ Deutsche Gesellschaft für Sonnenenergie. Copper indium diselenide (CIS) cell. Planning and Installing Photovoltaic Systems: A Guide for Installers, Architects and Engineers. Earthscan. 2008: 43–44 [2019-08-10]. ISBN 978-1-84407-442-6. (原始内容存档于2020-03-16).
- ^ Wee Chong Tan. Optical Properties of Amorphous Selenium Films (PDF) (Master of Science论文). University of Saskatchewan. July 2006 [2019-08-10]. (原始内容 (PDF)存档于2015-11-29).
- ^ Direct vs. Indirect Conversion 互联网档案馆的存檔,存档日期January 2, 2010,.
- ^ Springett, B. E. Application of Selenium-Tellurium Photoconductors to the Xerographic Copying and Printing Processes. Phosphorus and Sulfur and the Related Elements. 1988, 38 (3–4): 341–350. doi:10.1080/03086648808079729.
- ^ Williams, Rob. Computer Systems Architecture: A Networking Approach. Prentice Hall. 2006: 547–548 [2019-08-10]. ISBN 978-0-321-34079-5. (原始内容存档于2020-03-21).
- ^ Diels, Jean-Claude; Arissian, Ladan. The Laser Printer. Lasers. Wiley-VCH. 2011: 81–83 [2019-08-10]. ISBN 978-3-527-64005-8. (原始内容存档于2020-03-16).
- ^ Meller, Gregor & Grasser, Tibor. Organic Electronics. Springer. 2009: 3–5 [2019-08-10]. ISBN 978-3-642-04537-0. (原始内容存档于2020-03-09).
- ^ Normile, Dennis. The birth of the Blues. Popular Science. 2000: 57 [2019-08-10]. (原始内容存档于2020-03-21).
- ^ Kasap, Safa; Frey, Joel B.; Belev, George; et al. Amorphous selenium and its alloys from early xeroradiography to high resolution X-ray image detectors and ultrasensitive imaging tubes. Physica Status Solidi B. 2009, 246 (8): 1794–1805. Bibcode:2009PSSBR.246.1794K. doi:10.1002/pssb.200982007.
- ^ Svelto, Orazio. Principles of LASERs fourth ed. Plenum. 1998: 457. ISBN 978-0-306-45748-7.
- ^ Hai-Fu, F.; Woolfson, M. M.; Jia-Xing, Y. New Techniques of Applying Multi-Wavelength Anomalous Scattering Data. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 1993, 442 (1914): 13–32. Bibcode:1993RSPSA.442...13H. doi:10.1098/rspa.1993.0087.
- ^ MacLean, Marion E. A project for general chemistry students: Color toning of photographic prints. Journal of Chemical Education. 1937, 14 (1): 31. Bibcode:1937JChEd..14...31M. doi:10.1021/ed014p31.
- ^ Penichon, Sylvie. Differences in Image Tonality Produced by Different Toning Protocols for Matte Collodion Photographs. Journal of the American Institute for Conservation. 1999, 38 (2): 124–143. JSTOR 3180042. doi:10.2307/3180042.
- ^ McKenzie, Joy. Exploring Basic Black & White Photography. Delmar. 2003: 176 [2019-08-10]. ISBN 978-1-4018-1556-1. (原始内容存档于2020-05-02).
- ^ Hayward, Peter; Currie, Dean. Radiography of Welds Using Selenium 75, Ir 192 and X-rays (PDF). [2019-08-10]. (原始内容存档 (PDF)于2019-05-30).
- ^ Gropper SS, Groff JL, et al. (2005)Advanced Nutrition and Human Metabolism, 4th ed., pp. 456-461. Wardswirth, ISBN 0-534-55986-7
- ^ Gordon M. Wardlaw, Jeffery S. Hampl Perspectives in Nutrition, 7th edition, P.422
- ^ 78.0 78.1 78.2 行政院衛生署(2003)國人膳食營養素參考攝取量及其說明,修訂第六版,pp. 422-447。台灣行政院衛生署,ISBN 957-01-4677-X
- ^ 79.0 79.1 79.2 Institute of Medicine (2000) Dietary Reference Intakes for Vitamin C, Vitamin E, Selenium, and Carotenoids, pp. 284-324. National Academy Press, ISBN 0-309-06949-1
- ^ 存档副本. [2008-11-14]. (原始内容存档于2007-08-08).
- ^ 存档副本. [2008-11-14]. (原始内容存档于2008-02-20).
- ^ 存档副本. [2008-01-10]. (原始内容存档于2010-06-03).
- ^ 存档副本. [2008-01-10]. (原始内容存档于2005-04-09).
- ^ 存档副本. [2008-01-10]. (原始内容存档于2009-01-13).
- ^ http://www.freepatentsonline.com/20050048548-0-large.jpg
- ^ http://www.nature.com/ng/journal/v37/n11/images/ng1105-1162-F1.gif
- ^ Gropper SS, Groff JL, et al. Advanced Nutrition and Human Metabolism, 5th ed., pp. 511,318.
外部链接
[编辑]- 元素硒在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 硒(英文)
- 元素硒在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素硒在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 硒(英文)
- Selenium (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos (University of Nottingham)
- National Institutes of Health page on Selenium (页面存档备份,存于互联网档案馆)
- Assay (页面存档备份,存于互联网档案馆)
- ATSDR – Toxicological Profile: Selenium (页面存档备份,存于互联网档案馆)
- CDC - NIOSH Pocket Guide to Chemical Hazards (页面存档备份,存于互联网档案馆)


 French
French Deutsch
Deutsch




