Benzilxlorid — Vikipediya
| Benzilxlorid | |
|---|---|
 | |
 | |
| Ümumi | |
| Kimyəvi formulu | C6H5CH2Cl |
| Molyar kütlə | 126,59 q/mol |
| Fiziki xassələri | |
| Sıxlıq | 1,100 q/sm³ |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | 39 °S |
| Qaynama nöqtəsi | 179 °S |
| Buxarın təzyiqi | 133,32 Pa[1] |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 100-44-7 |
| PubChem | 7503 |
| RTECS | XS8925000 |
| ChEBI | 615597 |
| BMT nömrəsi | 1738 |
| ChemSpider | 13840690 |
Benzilxlorid [(xlormetil)benzol, α-xlortoluol] C6H5CH2Cl.
Fiziki xassələri
[redaktə | vikimətni redaktə et]Molekul kütləsi 126,59; kəskin iyli rəngsiz maye; ərimə t-ru 390C, qaynama t-ru 179,30C; sıxlığı 1,100 q/sm3 (250C); nD20=1,5391; buxarının təzyiqi (kPa) : 0,1 (220C), 1,3 (60,80C), 8,0 (100,50C), 26,6 (134,00C); ∆Hyanma - 3714 kC/mol; ε 6,43 (19,90C). Benzilxlorid etanolda, xloroformda, benzolda istənilən miqdarda həll olur, suda həll olmur.
Kimyəvi xassələri
[redaktə | vikimətni redaktə et]Xlorun nukleofil əvəzolunma reaksiyalarına eləcə də aromatik nüvənin hidrogen atomlarının elektrofil əvəzolunma reaksiyalarına asan daxil olur. Zəif oksidləşdiricilərin təsirindən benzaldehidə çevrilir; asanlıqla Qrinyar reaktivi əmələ gətirir.
Alınması
[redaktə | vikimətni redaktə et]Benzilxlorid sənayedə maye fazada toluolun radikal xlorlaşması üsulu ilə alınır:
- С6H5CH3 + Cl2 → C6H5CH2Cl + HCl
Bu üsulla ildə 100 000 tona yaxın benzilxlorid alınır2. Reaksiya zamanı aralıq məhsul kimi benzalxlorid və benzotrixlorid alınır (C6H5CHCl2 və C6H5CCl3). Prosesin bir neçə variantı mövcuddur:
Toluolun 1% PCI3 iştirakı ilə 90-100 0C-də, UB-şüalar altında və ya 2,21-azo-bis-izobutironitril iştirakı ilə xlorlaşması. Yüksək temperaturda xlorlaşma ilə yanaşı reaksiyanı otaq temperaturunda, katalizatorun iştirakı olmadan ilə də aparmaq mümkündür. Belə ki, günəş işığı və ya süni işıq altında, qazın yaxşı həll olmasını təmin etmək üçün daha hündür kalonkadan istifadə etməklə və toluol üzərində xlor buraxmaqla benzil xlorid alırlar. Bu prosesdə nəmliyin olması reaksiyanın sürətinə nəzərə çarpacaq dərəcədə təsir etmir. Laboratoriyada benzil xloridin daha bir sadə üsulla alınması –natrium hipoxlorid və ya kalsium hipoxlorid məhlulu üzərində toluolun xlorlaşması məlumdur. Belə ki, şüşə boru vasitəsilə sulfat və ya xlorid turşusu məhlulundan (şüşə boru məhlul olan qabın dibinə kimi uzadılır) xlor buraxmaqla məhlulun üst təbəqəsində olan toluolu xlorlaşdırmaq mümkündür. Bu zaman yaranan xlor radikalı səthdə olan toluolla (toluol təbəqəsinin qalınlığı təqribən 3-4 sm olur) qarşılıqlı təsirdə olaraq benzilxlorid əmələ gətirir. Reaksiya qarışığı işıqlandırıldığı halda reaksiya daha sürətlə gedir. Reaksiya, həmçinin otaq temperaturunda da aparılır. Benzilxloridi toluolun sulfurilxloridlə SO2Cl2 xlorlaşması, benzolun Blan reaksiyası üzrə xlormetilləşməsi reaksiyaları üzrə də almaq olar:
Benzilxloridi laboratoriyada benzil spirtinin qatı xlorid turşusu reaksiyası ilə də almaq mümkündür.
Tətbiqi
[redaktə | vikimətni redaktə et]Benzilxlorid benzil spirtinin, xüsusən də plastik kütlələrin, örtüklərin, elektrik izolyasiya örtüklərinin və lakların istehsalında geniş istifadə edilən benzilsellülozanın alınmasında istifadə olunur. Benzilxlorid sənayedə plastifikator, aromatizator və ətriyyat istehsalında köməkçi komponent kimi istifadə olunur. Benzilxloridə natrium sianidlə təsir etməklə aralıq məhsul kimi benzilsianid və ondan da təbabətdə istifadə olunan fenilsirkə turşusunu alırlar.
Dördlü ammonium duzları. Üçlü aminləri benzilxloridlə alkilləşdirməklə səthi-aktiv maddə kimi istifadə olunan dördlü ammonium duzları alırlar.
Üzvi sintezdə qoruyucu qrup kimi molekula benzil qrupu daxil etmək məqsədilə istifadə olunur və bu zaman müvafiq benzil efirləri alınır.
Karbon turşuları ilə reaksiyası zamanı müvafiq mürəkkəb benzil efirləri alınır3. Benzilxloridin kalium permanqanatın (KMnO4) qələvi məhlulu ilə oksidləşməsi nəticəsində benzoy turşusunu (C6H5COOH) almaq olar.
Benzilxlorid amfetaminlər sinfinə aid narkotik maddələrin sintezində istifadə oluna bildiyi üçün ABŞ-də onun satışı monitorinq altında həyata keçirilir. Benzilxlorid maqnezium ilə qaşılıqlı təsirdə olaraq Qrinyar reaktivi əmələ gətirir.
Heteroatomlu funksional qrupun benzilləşməsi
[redaktə | vikimətni redaktə et]Benzilxlorid heteroatomlu funksional qrup üçün münasib benzilləşdirici agentdir və bu çür mühafizə qrupunun funksional qrupa daxil edilməsi reaksiyalarına geniş əhəmiyyət verilir4. Spirtlərin bu reagentlə benzilləşməsi KOH kimi güclü əsasın iştirakı ilə, spirtli həlledicilərdə5, n-Bu4 NHSO4[6] faza dəyiişikliyində katalizlə nail olunur. Amin qrupları karbonatlar və ya hidroksidlərin iştirakı ilə benzilxloridlə asanlıqla benzilləşirlər, dibenzilləşmə isə daha dəqiq reaksiyalara əsaslanır[7]. Tiollar natrium hidroksid və ya tsezium karbonat və polyar həlledicilərin iştirakı ilə asanlıqla benzilləşirlər.[8] Amidlər metal hidridlər kimi güclü əsasların təsiri ilə N-benzilləşə bilər.
Metilenaktiv birləşmələrin benzilləşməsi
[redaktə | vikimətni redaktə et]Anionlar və dianionlar, β-ketoefirlər, β-ketaldehidlər, β-diketonlar, β-ketoamidlər, β-ketonitrillər benzilxloridlə qarşılıqlı təsirdə olaraq C-benzilləşmiş məhsullar əmələ gətirir. β-ketoefirlər və β-diketonlar turşu vəziyyətinə daha az benzilləşirlər.[9]
Təhlükəsizlik
[redaktə | vikimətni redaktə et]Benzilxlorid alkilləşdirici agentdir. O su ilə qarşılıqlı təsirdə olaraq benzil spirtinə və hidrogenxloridə hidroliz olunur.Benzilxlorid otaq temperturunda kifayət qədər uçucudur göz və dərinin selikli qişasını zədələyir. Onunla sorucu şkaf altında işləyirlər. Benzilxlorid mutagendir və müəyyən qədər də konserogendir.
Mənbə
[redaktə | vikimətni redaktə et]Химическая энциклопедия, Изд. "Советская энциклопедия", М., 1988, т. 1, с. 496.
İstinad
[redaktə | vikimətni redaktə et]- http://www.cdc.gov/niosh/npg/npgd0053.html
- Furniss, B. S.; Hannaford, A. J.; Smith, P. W. G.; Tatchell, A. R. (1989), Vogel’s Textbook of Practical Organic Chemistry (5th ed.), Harlow: Longman, p. 864, ISBN 0-582-46236-3
- Shaw, J. E.; Kunerth, D. C.; Sherry, J. J. Tetrahedron Lett. 1973, 689.
- Greene, T. W.; Wuts, P. G. M., Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991. (b) Protective Groups in Organic Chemistry, McOmie, J. F. W., Ed.; Plenum: New York, 1973.
- Fletcher, H. G., Methods Carbohydr. Chem. 1963, 166.
- Freedman, H. H.; Dubois, R. A. Tetrahedron Lett. 1975, 3251.
- Kuhn, R.; Löw, I.; Trischmann, H. Chem. Ber. 1957, 90, 203.
- Heer, J.; Billeter, J. R.; Miescher, K. Helv. Chim. Acta 1945, 28, 991


 French
French Deutsch
Deutsch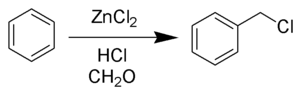
![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{}]{NaCN}}C_{6}H_{5}CH_{2}CN{\xrightarrow[{}]{H_{2}O}}C_{6}H_{5}CH_{2}COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9c65d785b7a0daac3171ddfe45b74bd18e6a56f)
![{\displaystyle {\mathsf {R_{3}N+C_{6}H_{5}CH_{2}Cl\rightarrow [R_{3}N(C_{6}H_{5}CH_{2})]^{+}Cl^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60f446137c8a356400fae69c4748bd2f5a8002fb)
![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{}]{ROH}}C_{6}H_{5}CH_{2}OR{\xrightarrow[{Pd}]{H_{2}}}ROH+C_{6}H_{5}CH_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f2481cdd4506614eceefa19048a1478d2126362)
![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{OH^{-}}]{KMnO_{4}}}C_{6}H_{5}COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/49c375ed5f43a9fed9a23a44f89a7f83bdee891a)