Geraniol – Wikipedia
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Geraniol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10H18O | |||||||||||||||||||||
| Kurzbeschreibung | farblose oder leicht gelbliche Flüssigkeit mit blumigem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 154,25 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | flüssig[2] | |||||||||||||||||||||
| Dichte | 0,88 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | 229–230 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex | 1,4766 (20 °C)[7] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Geraniol ist eine organisch-chemische Verbindung mit der Summenformel C10H18O. Es ist ein acyclischer Monoterpen-Allylalkohol, der in hohen Konzentrationen in den ätherischen Ölen von Zitronengräsern (Cymbopogon) und anderen Pflanzen vorkommt.
Es riecht rosenartig mit einem Hauch von Zitrusfrüchten und ist ein kommerziell wichtiger Inhaltsstoff von Parfüms, Hautcremes, Aromen, Reinigungsmitteln, Waschmitteln und anderen Verbraucherprodukten. Der Geschmack wird als süß-blumig-rosig, zitrusartig mit fruchtigen, wachsartigen Nuancen beschrieben. In kleinen Mengen verbessert es die gustatorische Wahrnehmung der Geschmacksrichtungen Zitrone, Grapefruit, Limette und Orange.
Bienen, Hummeln, Melipona oder die Platanen-Netzwanze nutzen Geraniol als Pheromon zur Futtersuche, zur Kastendetermination oder als Alarmpheromon. Gegen einige Insekten wirkt es als Repellent.
Bei der Herstellung von Citronellol, Citral oder Geranylestern wie etwa Geranylpropionat ist Geraniol ein wichtiges Zwischenprodukt. Es wird pharmakologisch unter anderem als Antimykotikum und Antibiotikum sowie als Repellent gegen Ektoparasiten genutzt. Es hat zytotoxische und zytostatische Aktivität. Geraniol wirkt als Penetrationsverstärker für die transdermale Anwendung von Medikamenten.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Geraniol ist neben Citronellol der wichtigste Bestandteil von Rosenöl. Daher ist seine Erforschung eng mit dem Bedarf an Rosenöl verknüpft. Einer Legende nach wurde das Rosenöl während der Herrschaft Jahangirs zwischen 1605 und 1627 über das Mogulreich entdeckt. Demnach bemerkte seine Ehefrau Nur Jahan Öltröpfchen in ihrem Rosenwasserbad und ließ das Material sammeln. Über moslemische Händler gelangte das Verfahren der Rosenölgewinnung in die Türkei und nach Bulgarien. Im 17. Jahrhundert wurde Rosenöl aus dieser Region in Europa ein Handelsgut.[9] Die Wasserdampfdestillation von Rosenblättern zur Gewinnung von Rosenöl ist aber wahrscheinlich viel älter. So wurden in Harappa Tongefäße ausgegraben, die von der Indus-Kultur schon etwa 5000 vor Christus zu diesem Zweck eingesetzt wurden.[9]
Belege für die Verwendung von Rosenöl und damit Geraniol als Arzneimittel finden sich bereits im 9. Jahrhundert. Der arabische Wissenschaftler und Arzt al-Kindī verschrieb zu dieser Zeit bereits Rosenprodukte bei Magenschmerzen, Geschwüren, Leber- und Mundkrankheiten sowie Halsschmerzen und verwendete Rosenöl als Bestandteil von Hämorrhoidensalben.[9] Bereits im 1. Jahrhundert beschrieb Pedanios Dioskurides, der als Pionier der Pharmakologie gilt, die Verwendung von in Wein gekochten Rosen zur Behandlung von Kopfschmerzen und anderen Beschwerden.
Da zur Herstellung von einem Kilogramm Rosenöl etwa fünf Tonnen Rosenblüten gebraucht wurden, suchten die Parfümeure nach billigeren Alternativen. 1819 wurde ein ätherisches Öl aus den Blättern der Pelargonie Pelargonium graveolens gewonnen, das bis zu 75 % Geraniol enthielt. Zu dessen Herstellung wurde für ein Kilogramm etwa eine Tonne Blätter benötigt.[10]
Oscar Jacobsen isolierte das Geraniol 1871 durch fraktionierte Destillation aus dem indischen Geraniumöl.[11] Er zeigte, dass es sich um einen Alkohol mit der Summenformel C10H18O handelte. Jacobsen erhielt durch Erhitzen mit Phosphorpentoxid und Zinkchlorid eine Verbindung, die er Geranien nannte. Er zeigte, dass sich Geraniol mit Calciumchlorid zu einer Verbindung vereinigt, die sich unter Zugabe von Wasser wieder löst und zur Abtrennung des Geraniols von anderen Komponenten ätherischer Öle geeignet ist.[11] Dies war im 19. Jahrhundert eine übliche Methode des Geraniolnachweises. Friedrich Wilhelm Semmler und Ferdinand Tiemann wiesen 1890 nach, dass Geraniol ein aliphatischer Alkohol mit zwei Doppelbindungen ist, damals die erste bekannte aliphatische Terpenverbindung.[12]
Der steigende Bedarf an Geraniol führte zur Entwicklung verschiedener industrieller Prozesse. So patentierte 1957 die US-amerikanische Firma Van Ameringen Haebler Inc., die später mit der Essenz-Fabrik Polak & Schwarz zu International Flavors & Fragrances fusionierten, ein Verfahren zur Herstellung von Geraniol über die Hydrochlorierung von Myrcen.[13]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Geraniol ist Bestandteil vieler ätherischer Öle und kommt unter anderem in Wermutkraut, Katzenminze, Grünem Kardamom, Koriander, Basilikum, Möhren, Lorbeer, Thymian, Muskat, Wein, Schwarznuss, Tee, Bergamotte und Zitronen vor.[14][15] Die größten Mengen sind mit 70–85 % im Palmarosa-Öl enthalten, das aus dem Zitronengras Cymbopogon martini gewonnen wird. Die Öle der Pelagornie Pelargonium graveolens und der Rosen (Rosa) enthalten ebenfalls große Mengen Geraniol.[16][9]
- Palmarosa-Gras (Cymbopogon martinii)
- Pelargonium graveolens
- Rose
- Wermut (Artemisia absinthium)
- Koriander
- Lorbeer
- Muskatnussbaum
- Echte Katzenminze (Nepeta cataria)
| Pflanzliche Vorkommen von Geraniol (Auswahl)[17] | ||
|---|---|---|
| Pflanze | Pflanzenteil | Prozentanteil (flüchtige Fraktion des ätherischen Öls) |
| Cymbopogon martinii | Blätter | 93,25 % |
| Thymus daenensis | oberirdische Pflanzenteile | 75,70 % |
| Elettariopsis elan | Blatt, Rhizom und Wurzel | 71,60 % |
| Aframomum citratum | Samen | 70,00 % |
| Aeollanthus myrianthus | Blüten | 66,00 % |
| Thymus longicaulis | oberirdische Pflanzenteile | 56,80 % |
| Neofinetia falcata | Blüten | 53,00 % |
Ebenso kommt Geraniol in vielen Zitrusfrüchten wie der Tangerine, Zitronen, Grapefruits und Orangen sowie in Blaubeeren, Brombeeren und Pfirsichen vor und trägt ebenso zum Geschmack und Geruch der Kartoffelknolle bei.[18]
Honigbienen produzieren Geraniol in der 1883 von Nikolai Nasanov entdeckten, sich im Abdomen befindenden Nasanov-Drüse. Geraniol dient der Honigbiene als Pheromon, um Zugänge zum Bienenstock zu markieren sowie Blüten anzuzeigen, die noch Nektar beinhalten.[19]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Synthesen und Extraktion
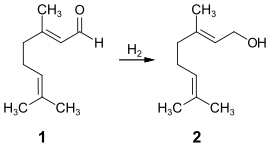
[Bearbeiten | Quelltext bearbeiten]Der Großteil des Geraniols wird synthetisch im industriellen Maßstab hergestellt. Eine weit verbreitete Herstellungsmethode ist die partielle Hydrierung von Citral 1, wobei durch die Verwendung spezieller Katalysatoren oder Reaktionstechniken eine hohe Selektivität erzielt werden kann.[20]
Ein weiterer Syntheseweg geht vom α-Pinen 1 aus, das selektiv zu Pinan 2 hydriert wird. Die Oxidation mit Sauerstoff ergibt das Pinanhydroperoxid 3, das mit Natriumbisulfit oder katalytisch zum 2-Pinanol 4 reduziert wird. Die Pyrolyse von 2-Pinanol ergibt Linalool 5.[20] In Gegenwart von Orthovanadat-Katalysatoren kann Linalool zum Geraniol 6 isomerisiert werden.[21]
Dabei entsteht mit einer Ausbeute über 90 % ein Geraniol-Nerol-Gemisch, das mittels fraktionierter Destillation getrennt wird.[20] Die industriell hergestellte Menge lag 2008 bei über 1000 Tonnen Geraniol pro Jahr.[22]
Bei einer industriellen Synthese aus Grundchemikalien wird zunächst Aceton 1 basenkatalysiert mit Ethin 2 zu 2-Methyl-3-butin-2-ol 3 umgesetzt. Die katalytische Hydrierung in Gegenwart von Lindlar-Katalysator ergibt 2-Methyl-3-buten-2-ol 4. Dieser kann mit Acetessigsäuremethylester 5 zum 3-Buten-2-ylacetoacetat 6 umgeestert werden. Nach der Decarboxylierung durch eine Carroll-Umlagerung wird 6-Methyl-5-hepten-2-on 7 erhalten. Die erneute Ethinylierung ergibt Dehydrolinalool 8, das mit Wasserstoff und Lindlar-Katalysator partiell zum Linalool 9 hydriert wird. Die säurekatalysierte Allylumlagerung ergibt Geraniol 10.[23]
Myrcen, das in Mengen von etwa 30.000 Tonnen pro Jahr hergestellt wird, dient ebenfalls als Ausgangsstoff für die Produktion von Geraniol.[24] Es handelt sich dabei um eine Variante des Takasago-Verfahrens zur Herstellung von (−)-Menthol. Dazu wird es im ersten Schritt mit Dipropylamin zum N,N-Dipropylgeranylamin umgesetzt, das in weiteren Schritten zum Geraniol umgesetzt wird.[25]
Etwa 10 % des Geraniols wird für die Parfümindustrie aus der Destillation von ätherischen Ölen, wie dem javanischem Citronellöl, eventuell nach vorheriger Verseifung der Ester, gewonnen.[20][21] Die lösliche Geraniolfraktion wird durch mehrstufige Extraktion mit einem Wasser-Ethanol-Gemisch angereichert und so von der nicht wasserlöslichen Terpen- und Sesquiterpenfraktion, die nicht zu den Aromaeigenschaften beitragen, getrennt. Durch Abdampfen des Wassers und des Ethanols werden konzentrierte ätherische Öle erhalten. Geraniol kommt in diesen Ölen immer gemeinsam mit Nerol vor. Der Name Geraniol wird industriell daher zum Teil für die Mischung aus Geraniol und Nerol verwendet.[21]
Genetisch modifizierte Hefen schieden Geraniol in relativ hohen Mengen in das Wachstumsmedium aus, speziell, wenn die Mutanten zusätzlich einen Defekt in der Farnesyldiphosphat-Synthase aufwiesen. Es wurden Ausbeuten von etwa einem Milligramm Geraniol pro Liter Wachstumsmedium erreicht.[26]
Aufarbeitung
[Bearbeiten | Quelltext bearbeiten]Geraniol bildet mit Calciumchlorid einen Komplex, der sich zur Aufarbeitung und Reinigung verwenden lässt. Dazu wird eine Geraniol enthaltenes ätherisches Öl mit einem wasserunlöslichen Lösungsmittel wie Hexan versetzt. Nach Zugabe von Calciumchlorid fällt der Geraniol-Calciumchlorid-Komplex aus und kann abfiltriert werden. Durch Zugabe von Wasser zerfällt der Komplex wieder und das wasserunlösliche Geraniol kann abgetrennt werden.[27]
Die Kristallstruktur des Geraniol-Calciumchlorid-Komplexes zeigt eine Doppelschicht aus Geraniolmolekülen, in denen Kanäle aus Calcium- und Chlorid-Ionen die Doppelschichten voneinander trennen.[28] Der sehr wasserempfindliche Geraniol-Calciumchlorid-Komplex kristallisiert im monoklinen Kristallsystem in der Raumgruppe C2/c (Raumgruppen-Nr. 15) mit den Gitterparametern a = 4751 pm, b = 4188 pm, c = 12138 pm, β = 93° und vier Formeleinheiten (C10H18O)2 x CaCl2 pro Elementarzelle.[28]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Geraniol ist eine farblose bis leicht gelbliche Flüssigkeit mit blumig-rosenähnlichem Geruch. Die Dichte des Geraniols beträgt 0,88 g·cm−3. Die Flüssigkeit erstarrt bei etwa −15 °C und siedet bei etwa 230 °C. Mit Ethanol und Diethylether ist Geraniol in jedem Verhältnis mischbar, in Wasser ist es mit 686 mg·l−1 schlecht löslich.[6] Der Flammpunkt liegt bei 110 °C.[29]
Molekulare Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das Molekül besitzt eine 2,6-Octadienstruktur mit zwei isolierten Doppelbindungen, zwei Methylgruppen in 3- und 7-Stellung und eine primäre Alkoholfunktion. Die beiden Substituenten der Doppelbindung in 2-Stellung, die nach der Cahn-Ingold-Prelog-Konvention die höchste Priorität besitzen, sind trans- oder (E) angeordnet. Die Substituenten der Doppelbindung in 6-Stellung weisen keine cis-trans-Isomerie auf, da die beiden terminalen Methylgruppen stereochemisch gleichwertig sind. Das cis-Isomer des Geraniols ist das Nerol.
Die drei sp2-hybridisierten, planar substituierten Kohlenstoffatome in 2-, 3- und 6-Stellung der beiden Doppelbindungen sind prochiral. Die Alkoholfunktion steht in Allylstellung zur Doppelbindung in 2-Stellung. Diese kann etwa durch eine Sharpless-Epoxidierung mittels eines chiralen Katalysators enantioselektiv epoxidiert werden.[30]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Als acyclischer ungesättigter Alkohol geht Geraniol Umlagerungs- und Cyclisierungsreaktionen ein. Die Umlagerung in Gegenwart von Kupferkatalysatoren führt zu Citronellal, teilweise beziehungsweise vollständige Hydrierung zu Citronellol beziehungsweise 3,7-Dimethyloctan-1-ol, Oxidation oder katalytische Dehydrierung zu Citral, Veresterung zu den jeweiligen Geranylestern. Im sauren Milieu lässt sich sowohl Geraniol als auch Nerol zu dem Isomer α-Terpineol cyclisieren. Das (E)-Isomer Geraniol lagert sich unter saurer Katalyse mit Iodwasserstoff in das (Z)-Isomer Nerol um.[31]
Formal besteht Geraniol aus zwei Isopreneinheiten, die nach der Isoprenregel in einer Kopf-Schwanz-Verbindung stehen, wodurch die lineare Struktur des 2,6-Dimethyloctans entsteht. Biosynthetisch handelt es sich um die Isopreneinheiten Isopentenylpyrophosphat und Dimethylallylpyrophosphat, die unter Katalyse einer Prenyltransferase (Geranyltransferase) reagieren.
Durch eine Enzym-katalysierte Reaktion mit Wasser entsteht Geraniol. Aus dem intermediären Geranylpyrophosphat, das eine Zwischenstufe der Cholesterinbiosynthese ist, ist nicht nur Geraniol, sondern auch weitere Monoterpene wie Linalool, Citronellol und Geranial zugänglich.
Die Bildung von Linalool aus Geraniol ist mit Hilfe von Natriumnaphthalid möglich. An der Luft oxidiert Geraniol zu einem Hydroxyhydroperoxid, das weiter zu Wasserstoffperoxid, Geranial und Neral reagiert. Daneben bilden sich geringere Mengen eines Hydroperoxids. Die Reaktionsprodukte sind allergene Verbindungen, die mäßig sensibilisierend sind.[32]
Unter Katalyse von Silbertrifluormethansulfonat in Gegenwart von Aminbasen wie 2,6-Di-tert-butylpyridin reagiert Geraniol mit primären Alkylhalogeniden wie Iodmethan zum Methylether.[33]
Geraniol lässt sich mit Bobbitt-Salz, einem recyclebaren stöchiometrischen Oxidationsmittel, zu Geranial oxidieren.[34] Mit homogenen Übergangsmetallkatalysatoren auf Basis von Ruthenium, die mit chiralen Liganden wie BINAP komplexiert sind, lässt sich die Doppelbindung in Allylstellung mit hohem Enantiomerenüberschuss hydrieren. Als Produkt entsteht ein Enantiomer des Citronellols, wobei die Verwendung von (S)-BINAP zur Bildung von (R)-Citronellol führt.[35]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Duft- und Aromastoff
[Bearbeiten | Quelltext bearbeiten]
Als blumige Note ist es Bestandteil vieler Parfüms.[36] Als Bestandteil des Ylang-Ylang-Öls wird es bei der Herstellung von Parfüms wie Chanel Nº 5 verwendet, wo es zur Herznote gehört. Die Firma Beneo entwickelte ein nach Rosen duftendes Bonbon namens „Deo“. Dieses enthält neben Isomalt, einen Zuckeraustauschstoff, auch Geraniol. Das konsumierte Geraniol soll den Körper durch die Poren verlassen und einen rosenähnlichen Geruch erzeugen, der stundenlang anhalten kann. Damit wirkt das Bonbon als verzehrbares Deodorant.[37] Die angenehmen blumigen Noten des chinesischen Keemun-Tees sind ebenso auf einen hohen Anteil an Geraniol zurückzuführen.[38]
Die hohe Flüchtigkeit des Geraniols begrenzt den Zeitraum, über den dessen Dufteindruck wahrgenommen werden kann. Geraniol wird daher zum Teil als Palmitinsäureester eingesetzt, der als Riechstoffvorläufer dient. Er wird unter dem Handelsnamen Hexarose vertrieben und Weichspülern zugesetzt. Durch im Waschmittel vorhandene Enzyme wie Lipasen oder Proteasen, die sich nach dem Waschvorgang noch auf der Wäsche befinden, wird der Ester gespalten und das Geraniol über einen längeren Zeitraum freigesetzt. Geraniolester der 2-Carbamoylbenzoesäure erfüllen denselben Zweck.[39]
Neben 1,2-Propandiol, Glycerin, Nikotin und anderen Inhaltsstoffen wird Geraniol als Teil der Aromamischung für E-Zigaretten verwendet.[40] Die Deutsche Post AG gab am 1. März 2010 ein Folienblatt Gartenrose heraus, deren Briefmarken mit (R)-(+)-Limonen und Geraniol parfümiert sind. Beim Reiben über die Marken wird der Duft freigesetzt.[41]
Pheromon und Repellent
[Bearbeiten | Quelltext bearbeiten]
Geraniol zieht in Lockstofffallen den Japankäfer an.[42] In einem Gebiet von etwa 60.000 Quadratmetern wurden mit 500 Fallen 10.000.000 Käfer gefangen. Imker nutzen künstlich hergestellte Insektenpheromone wie das Nasanov-Pheromon, das Geraniol und Citral enthält, um Bienen zu einem ungenutzten Bienenstock zu locken.[43]
Geraniol wird in verschiedenen Formen, etwa als Duftkerze, als Öl zum Einreiben oder mittels Zerstäubern, als Repellent gegen Mücken verwendet. Nach einer zweitägigen Exposition beeinträchtigte Geraniol signifikant die Aktivierungs- und Orientierungsphasen des Blutsaugverhaltens von Stechmücken; fast alle Mücken verloren die Fähigkeit, einen Wirt zu suchen.[44]
Futtermittelzusatzstoff
[Bearbeiten | Quelltext bearbeiten]Die Gabe von Geraniol als Futtermittelzusatzstoff reduziert die Methanemissionen von Wiederkäuern. Das von Wiederkäuern produzierte Methan stellt einen erheblichen Energieverlust für das Tier dar. Außerdem ist Methan ein Treibhausgas mit einem globalen Erwärmungspotenzial. Geraniol verringert die Methanproduktion deutlich, hat aber negative Auswirkungen auf die Futterverdauung und -fermentation im Pansen.[45]
Der Geruch oder der Geschmack von ätherischen Ölen führt möglicherweise zur Verweigerung der Futteraufnahme. Dies lässt sich durch die Mikroverkapselung von ätherischen Ölen vermeiden.[46] Unter dem Namen Herbromix ist eine mikroverkapselte Mischung ätherischer Öle von Oregano, Lorbeer- und Salbeiblättern, Fenchel, Myrtenblättern und Zitrusschalen erhältlich. Die Mischung enthält Geraniol als wirksamen Bestandteil und wird als Zusatz zu Geflügelfutter verwendet.[47] Die Firma DSM hat Geraniol enthaltene Mixturen ätherischer Öle für die Schweine-, Geflügel- und Rindermast entwickelt, die unter dem Namen Crina vermarktet werden.[48]
Die Verwendung von ätherischen Ölen als Futtermittelzusatzstoff in der Tierernährung hat seit dem 2006 in der Europäischen Union erteilten Verbot von antibiotischen Wachstumsförderern, welche im Verdacht stehen, zur steigenden Antibiotikaresistenz von Krankheitserregern beim Menschen beizutragen, zugenommen. Die antimikrobielle Wirkung von ätherischen Ölen ist gut dokumentiert und beruht neben der Wirkung von phenolischen Verbindungen unter anderem auf der von Geraniol.[49] Geraniol ist gemäß der Durchführungsverordnung (EU) 2020/1396 als Zusatzstoff in Futtermitteln für alle Tierarten außer Meerestieren als „sensorischer Zusatzstoff“ zugelassen.[50]
Akarizid
[Bearbeiten | Quelltext bearbeiten]Geraniol zeigte als aktive Komponente in aus Pelargonien extrahiertem ätherischen Öl eine schützende Wirkung gegen Milbenbefall in Lebensmitteln. Bei der Verwendung von Geraniol als Akarizid betrug die Sterblichkeit der Milben 100 % bei einer Dosis von 10 Mikrogramm pro Kubikzentimeter des ätherischen Öls.[51]
Pflanzenschutzmittel
[Bearbeiten | Quelltext bearbeiten]In der Schweiz wurde der Wirkstoff per 1. Juli 2022 zur Verwendung in Pflanzenschutzmitteln zugelassen.[52]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Biosynthese von Terpenen
[Bearbeiten | Quelltext bearbeiten]Das Pyrophosphatderivat der Geraniols ist eine Schlüsselkomponente bei der Biosynthese vieler Terpene, etwa des Myrcen und Linalool.[53]
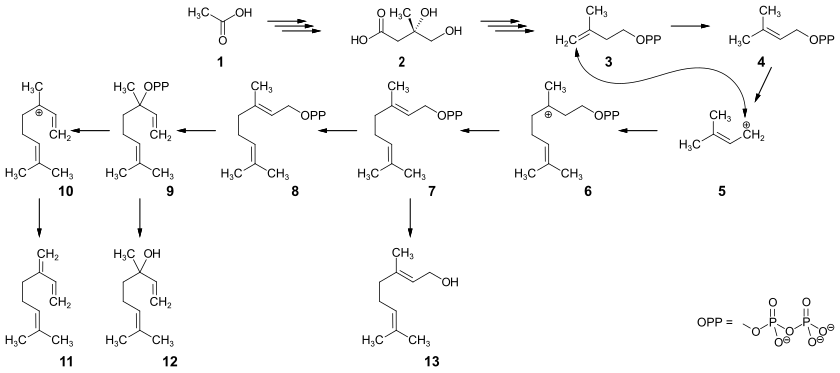
Die Biosynthese dieser Terpene erfolgt aus Mevalonsäure 2, die über mehrere Stufen aus Essigsäure 1, beziehungsweise Acetyl-Coenzym A gebildet wird. Enzymatisch wird unter Abspaltung von Kohlendioxid das Isopentenylpyrophosphat (IPP) 3 gebildet, das teilweise in das isomere Dimethylallylpyrophosphat (DMAPP) 4 umgelagert wird. Unter Abspaltung eines Diphosphat-Anions entsteht aus 4 das mesomeriestabilisierte Kation 5, das elektrophil die Doppelbindung eines IPP-Moleküls angreift. Unter Bildung einer C-C-Bindung entsteht über die Zwischenstufe 6 das Geraniolpyrophosphat 7, aus dem Geraniol 13 gebildet wird. 7 kann wiederum über die Zwischenstufe 8 zum Linalylpyrophosphat 9 isomerisieren, aus dem durch Hydrolyse das Linalool 12 entsteht. Durch Abspaltung des Diphosphat-Anions aus dem Linalylpyrophosphat entsteht das Kation 10, das wiederum unter Abspaltung eines Protons Myrcen 11 bildet.[54]
Botenstoff
[Bearbeiten | Quelltext bearbeiten]Geraniol wirkt bei Königinnenentwicklung bei Bienen der Gattung Melipona als kastendeterminierendes Primerpheromon. Die Ammenarbeiterinnen kontrollieren durch die Gabe von Geraniol bei genetisch prädisponierten Larven den Entwicklungsweg. Nur bei ausreichender Versorgung mit Geraniol bilden sich neue Königinnen, bei fehlender Geraniolgabe wird diese Entwicklung unterdrückt.[55]
Geraniol wurde als das Alarmpheromon der Nymphen der Platanen-Netzwanze (Corythucha ciliata) identifiziert. Nur deren Nymphen produzieren Geraniol, das ebenfalls als Alarmpheromon für artverwandte Nymphen wirkt. Erwachsene Platanen-Netzwanzen zeigen dagegen keine Anzeichen von Aggregation. Sie produzieren kein Geraniol und sprechen auch nicht darauf an.[56]
Geraniol wurde in den flüchtigen Bestandteilen des Teakbaums gefunden, wo es neben einer großen Anzahl anderer Komponenten als Botenstoff zur chemischen Kommunikation dient. Geraniol wurde als Pheromon für Schmetterlinge, Hautflügler und Schnabelkerfen, als Attractant für Käfer und als Kairomon für Fransenflügler identifiziert.[57]
Pharmakologische Wirkung
[Bearbeiten | Quelltext bearbeiten]Entzündungshemmende und antioxidative Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Geraniol weist verschiedene pharmakologische Eigenschaften auf, darunter antioxidative, entzündungshemmende und zytostatische Aktivität und gilt als potentielles Arzneimittel.[58] Eine antimikrobielle Aktivität gegen 78 verschiedene Mikroorganismen wurde nachgewiesen. Am besten untersucht ist die Einwirkung auf Candida und Staphylococcus.[59]
Durch den Verzehr von rohem Fisch kann es zu einer Infektion mit Parasiten wie Spulwürmern kommen, die Krankheiten wie Anisakiasis verursachen, welche sich durch Bauchschmerzen, Schwindel, Übelkeit, Durchfall und Erbrechen äußern. Geraniol führt in vitro bei einer Konzentration von 250 μg/ml innerhalb von 48 h zu einer Letalität von 90 % gegenüber den Larven der Spulwürmer.[60]
Anti-Tumor Wirkung
[Bearbeiten | Quelltext bearbeiten]Die therapeutische oder präventive Wirkung von Geraniol auf verschiedene Krebsarten wurde untersucht und Vorschläge für die Grundlagen für seine pharmakologischen Wirkungen gemacht. Außerdem scheint Geraniol gewisse Tumorzellen für häufig verwendete Chemotherapeutika zu sensibilisieren.[61] Eine allgemein anerkannte Therapie auf Grundlage von Geraniol wurde jedoch noch nicht entwickelt.
Eine Mischung aus natürlichen ätherischen Ölen von Eugenol, Carvon, Nerolidol und Geraniol in Olivenöl war bei der Beseitigung von Läsionen des Gebärmutterhalses bei Zervixkarzinomen wirksam.[62] Eine Studie wies nach, dass Geraniol das Zellwachstum in einer Kolonkarzinom-Zelllinie signifikant hemmte. Die Färbung mit dem Fluoreszenzfarbstoff 4′,6-Diamidin-2-phenylindol (DAPI) zeigte, dass Geraniol den programmierten Zelltod der Krebszellen induzierte. Mittels eines Western-Blot-Arrays wurde die Hochregulation des Coenzyms Bax und die Herabregulation des Proteins Bcl-2 durch Geraniol nachgewiesen.[58]
Aromatherapie
[Bearbeiten | Quelltext bearbeiten]Die Aromatherapie verwendet ätherische Öle, etwa Lavendelöl, das neben anderen Terpenen etwa 7 % Geraniol enthält, in der Massage und bei anderen Anwendungen mit dem Ziel, die körperliche, emotionale oder geistige Gesundheit zu verbessern. Die Untersuchung der Aromatherapie auf Angstzustände bei Patienten nach einer koronaren Bypassoperationen zeigte, dass die Aromatherapie in der Lage ist, Angst, Schmerzen, Übelkeit und andere Nebenwirkungen dieser Operation signifikant zu verringern.[63]
Andere aromatherapeutische Anwendungen von Geraniol enthaltenden ätherischen Ölen, etwa gegen Diabetes oder Allergien, wurden untersucht, jedoch bislang ohne eine wissenschaftliche Bestätigung der Effektivität.[64] Es gibt bisher keine wissenschaftlichen Beweise für die direkte Wirkung ätherischer Öle, die durch Massage auf die Haut aufgetragen werden, auf bestimmte innere Organe, etwa durch lokale Hautadsorption.
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Toxikologische Studien an Ratten zeigten weder bei einer 16-Wochen-Fütterung mit einer Nahrung, die 1 % Geraniol, noch bei einer 28-Wochen-Fütterung mit einer Nahrung, die 0,1 % Geraniol enthielt, negative Auswirkungen auf den Organismus. Geraniol wirkte im akuten Hautreizungstest am Kaninchen nicht reizend, im Maximierungstest am Meerschweinchen wirkte es nicht sensibilisierend. Es wurde keine Sensibilisierung oder eine mutagene Wirkung festgestellt.[44] Während Geraniol selbst nur ein schwaches Kontaktallergen darstellt, zeigten seine Autooxidationsprodukte eine wesentlich stärkere allergene Wirkung.[32] Bei der Verwendung von Geraniol in kosmetischen Mitteln muss laut der Verordnung (EG) Nr. 1223/2009 das Vorhandensein auf der Liste der Inhaltsstoffe angegeben werden, wenn seine Konzentration 10 ppm in Produkten übersteigt, die nach dem Auftragen auf der Haut verbleiben, und 100 ppm in Produkten, die nach dem Auftragen abgewaschen werden.[65]
Bei einer Studie zur akuten Augenreizung am Kaninchen reizte die Testsubstanz in 0,42%iger Konzentration die Augen der Versuchstiere mäßig und verursachte eine Hornhauttrübung sowie eine Bindehautentzündung und Rötung. Die Symptome klangen innerhalb von zehn Tagen nach der Exposition ab.[66]
Nachweis
[Bearbeiten | Quelltext bearbeiten]Zur zuverlässigen qualitativen und quantitativen Bestimmung des Geraniols in komplexen Gemischen kann nach angemessener Probenvorbereitung die Kopplung der Gaschromatographie mit der Massenspektrometrie eingesetzt werden.[67][68] Weitere verfügbare Trennmethoden sind die Dünnschichtchromatographie oder die Hochleistungsflüssigkeitschromatographie, die mit spektroskopischen Methoden wie der UV/VIS-Spektroskopie, der Infrarotspektroskopie oder der Kernspinresonanzspektroskopie gekoppelt werden können.[69]
Literatur
[Bearbeiten | Quelltext bearbeiten]- H. Surburg, J. Panten: Common Fragrance and Flavor Materials: preparation, properties, and uses. Wiley-VCH, Weinheim 2006, ISBN 3-527-31315-X, S. 28–29.
- Kemal Hüsnü Can Başer, Gerhard Buchbauer: Handbook of essential oils: science, technology, and applications. CRC Press, Boca Raton, 2010, ISBN 978-1-4200-6315-8
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu GERANIOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Juni 2021.
- ↑ a b c Datenblatt Geraniol (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ a b Datenblatt Geraniol bei Alfa Aesar, abgerufen am 15. Dezember 2010 (Seite nicht mehr abrufbar).
- ↑ Geraniol in der Gefahrstoff-Datenbank der Universität Hamburg.
- ↑ Datenblatt Geraniol bei Sigma-Aldrich, abgerufen am 12. Mai 2017 (PDF).
- ↑ a b c d Eintrag zu Geraniol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-266.
- ↑ Eintrag zu Geraniol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Januar 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d Kemal Hüsnü Can Başer, Ayten Altintaș, Mine Kürkçüoglu: Turkish Rose: A Review of the History, Ethnobotany, and Modern Uses of Rose Petals, Rose Oil, Rose Water, and Other Rose Products. In: HerbalGram. 96, 2012, S. 40–53.
- ↑ Kemal Hüsnü Can Başer: Turkish rose oil. In: Perfumer and Flavorist. 17, 1992, S. 45–52.
- ↑ a b J. Bertram, E. Gildemeister: Ueber Geraniol und Rhodinol. In: Journal für Praktische Chemie. 53.1, 1896, S. 225–237.
- ↑ A. Wehrmann: Zur Jononfrage. In: Chemische Revue über die Fett‐und Harz‐Industrie. 6.12, 1899, S. 221–226.
- ↑ Patent US2882323A: Hydrochlorination of myrcene. Veröffentlicht am 14. April 1959, Erfinder: Richard Weiss.
- ↑ GERANIOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. Juni 2021.
- ↑ Otto Vostrowsky, Thorolf Brosche, Helmut Ihm, Robert Zintl, Karl Knobloch: Über die Komponenten des ätherischen Öls aus Artemisia absinthium L.. In: Zeitschrift für Naturforschung C. 36, 1981, S. 369–377 (PDF, freier Volltext).
- ↑ Maher Boukhris, Monique S. J. Simmonds, Sami Sayadi, Mohamed Bouaziz: Chemical Composition and Biological Activities of Polar Extracts and Essential Oil of Rose-scented Geranium, Pelargonium graveolens. In: Phytotherapy Research. 27, 2013, S. 1206–2013, doi:10.1002/ptr.4853.
- ↑ Wanda Maczka, Katarzyna Winska, Małgorzata Grabarczyk: One Hundred Faces of Geraniol. In: Molecules, 2020, 25, S. 3303, doi:10.3390/molecules25143303.
- ↑ Ron G. Buttery, Richard M. Seifert, Louisa C. Ling: Characterization of some volatile potato components. In: Journal of Agricultural and Food Chemistry. 18, 1970, S. 538–539, doi:10.1021/jf60169a044.
- ↑ R. Boch, D. A. Shearer: Identification of Geraniol as the Active Component in the Nassanoff Pheromone of the Honey Bee. In: Nature. 194, 1962, S. 704–706, doi:10.1038/194704b0.
- ↑ a b c d Horst Surburg, Johannes Panten: Common Fragrance and Flavor Materials. 6. Vollständig überarbeitete und erweiterte Auflage. Wiley-VCH, 2016, ISBN 978-3-527-33160-4, S. 30–32.
- ↑ a b c Charles Sell: Chemistry of Essential Oils. In: Kemal Hüsnü Can Başer, Gerhard Buchbauer: Handbook of essential oils: science, technology, and applications. CRC Press, Boca Raton, 2010, ISBN 978-1-4200-6315-8, S. 121–150.
- ↑ A. Lapczynski, S.P. Bhatia, R.J. Foxenberg, C.S. Letizia, A.M. Api: Fragrance material review on geraniol. In: Food and Chemical Toxicology. 46, 2008, S. 160–170, doi:10.1016/j.fct.2008.06.048.
- ↑ Eberhard Breitmaier: Terpenes: Flavors, Fragrances, Pharmaca, Pheromones. Wiley-VCH, 2006, ISBN 978-3-527609949, S. 119–121.
- ↑ Kirk-Othmer: Kirk-Othmer Chemical Technology of Cosmetics. John Wiley & Sons, 2012, ISBN 1-118-51890-X (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Kunihiko Takabe, Takao Katagiri, Juntaro Tanaka: Highly stereoselective syntheses of nerol and geraniol. In: Chemistry Letters. 6.9, 1977, S. 1025–1026.
- ↑ Marilyne Oswald, Marc Fischer, Nicole Dirninger, Francis Karst: Monoterpenoid biosynthesis in Saccharomyces cerevisiae. In: FEMS Yeast Research. 7, 2007, S. 413–421, doi:10.1111/j.1567-1364.2006.00172.x.
- ↑ Howard A. Jones, John W. Wood: Preparation of Pure Geraniol. In: Industrial & Engineering Chemistry. 34, 1942, S. 488, doi:10.1021/ie50388a025.
- ↑ a b William J. Cook, Ulf Thewalt, Charles E. Bugg: Calcium-binding to non-ionic lipids: Crystal structure of a calcium chloride complex of geraniol. In: Biochemical and Biophysical Research Communications. 68, 1976, S. 143–148, doi:10.1016/0006-291X(76)90021-8.
- ↑ Eintrag zu Geraniol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Dezember 2021.
- ↑ Lynn M. Bradley, Joseph W. Springer, Gregory M. Delate, Andrew Goodman: Epoxidation of Geraniol: An Advanced Organic Experiment that Illustrates Asymmetric Synthesis. In: J. Chem. Educ. 1997, 74, 11, S. 1336, doi:10.1021/ed074p1336.
- ↑ Yasuhide Yukawa, Terukiyo Hanafusa, Kaneko Fujita: Stereoselective Synthesis of Nerol. In: Bulletin of the Chemical Society of Japan. 37.2, 1964, S. 158–162.
- ↑ a b L. Hagvall, C. Bäcktorp, S. Svensson, G. Nyman, A. Börje, A. T. Karlberg: Fragrance compound geraniol forms contact allergens on air exposure. Identification and quantification of oxidation products and effect on skin sensitization. In: Chemical Research in Toxicology. Band 20, Nr. 5, S. 807–814. PMID 17428070.
- ↑ R.M. Burk, T.S. Gac, M.B. Roof: A mild procedure for etherification of alcohols with primary alkyl halides in the presence of silver triflate. In: Tetrahedron Letters. 35, 44, 1994, S. 8111–8112, doi:10.1016/0040-4039(94)88256-8.
- ↑ James M.Bobbitt u. a.: Discussion Addendum for: Preparation of 4-Acetylamino-2, 2, 6, 6-tetramethylpiperidine-1-oxoammonium Tetrafluoroborate and the Oxidation of Geraniol to Geranial (2,6-Octadienal, 3,7-dimethyl-, (2e)-). In: Organic Syntheses. 90, 2013, S. 215, doi:10.15227/orgsyn.090.0215.
- ↑ H. Takaya u. a.: New chiral ruthenium complexes for asymmetric catalytic hydrogenations. In: Pure and Applied Chemistry. 62.6, 1990, S. 1135–1138.
- ↑ Juliane Daphi-Weber, Heike Raddatz, Rainer Müller: Untersuchung von Riechstoffen – Kontrollierte Düfte. In: Gesellschaft Deutscher Chemiker (Hrsg.): HighChem hautnah. Band V, Frankfurt am Main 2010, ISBN 978-3-936028-64-5, S. 94–95.
- ↑ Donald E. Pszczola: A Progressive Potpourri. In: Food Technology (Chicago), 65.7, 2011, S. 77–89.
- ↑ H. F. Linskens, J. F. Jackson: Essential Oils and Waxes. Springer-Verlag, Berlin, Heidelberg, New York, 2012, ISBN 978-3-642-84025-8, S. 29.
- ↑ Andreas Herrmann: Profragrances – Riechstoffvorstufen. In: Chemie in unserer Zeit, 49, 2015, S 36–47, doi:10.1002/ciuz.201400677.
- ↑ J. Aszyk u. a.: Comprehensive determination of flavouring additives and nicotine in e-cigarette refill solutions. Part I: Liquid chromatography-tandem mass spectrometry analysis. In: Journal of Chromatography A., 1519, 2017, S. 45–54. doi:10.1016/j.chroma.2017.08.0.
- ↑ postfrisch – Das Philatelie-Journal, Januar/Februar 2010, Heft 1/2010, S. 25
- ↑ E. R. Van Leeuwen: Japanese Beetles Are Caught Plentifully in Geraniol-Baited Traps. In: Yearbook of Agriculture, 1930, S. 334–336.
- ↑ R. G. Danka, J. L. Williams, T. E. Rinderer: A bait station for survey and detection of honey bees. In: Apidologie. 21, 1990, S. 287–292, doi:10.1051/apido:19900403.
- ↑ a b W.Chen, A.M.Viljoen: Geraniol — A review of a commercially important fragrance material. In: South African Journal of Botany. 76, 4, 2010, S. 643–651, doi:10.1016/j.sajb.2010.05.008.
- ↑ M. Joch, V. Kudrna, B. Hučko, M. Marounek: Effecs of Geraniol and Camphene on in Vitro Rumen Fermentation and Methane Production. In: Scientia agriculturae bohemica. 48, 2017, S. 63–69, doi:10.1515/sab-2017-0012.
- ↑ Kemal Hüsnü Can Başer, Chlodwig Franz: Essential Oils Used in Veterinary Medicine. In: Kemal Hüsnü Can Başer, Gerhard Buchbauer: Handbook of essential oils: science, technology, and applications. CRC Press, Boca Raton, 2010, ISBN 978-1-4200-6315-8, S. 881–894.
- ↑ Sandra Diaz-Sanchez, Doris D’Souza, Debrabrata Biswas, Irene Hanning: Botanical alternatives to antibiotics for use in organic poultry production. In: Poultry Science. 94, 2015, S. 1419–1430, doi:10.3382/ps/pev014.
- ↑ Website der Fa. DSM über Crina-Produkte.
- ↑ C. Franz, K. H. C. Baser, W. Windisch: Essential oils and aromatic plants in animal feeding - a European perspective. A review.. In: Flavour and Fragrance Journal. 25, 2010, S. 327–340, doi:10.1002/ffj.1967.
- ↑ Verordnung (EU) 2020/1396
- ↑ J. H. Jeon, C. H. Lee, H. S. Lee: Food protective effect of geraniol and its congeners against stored food mites. In: Journal of food protection. 72.7, 2009, S. 1468–1471.
- ↑ Aktualisierung der genehmigten Wirkstoffe für Pflanzenschutzmittel. In: blv.admin.ch. Bundesamt für Lebensmittelsicherheit und Veterinärwesen, 1. Juli 2022, abgerufen am 28. August 2023.
- ↑ Agneta Prasse, Hans-Ullrich Siehl, Klaus-Peter Zeller, Stefan Berger, Dieter Sicker: Wie unsere Nase die enantiomeren Linaloole unterscheidet. In: Chemie in unserer Zeit. 48, 2014, S. 342–353, doi:10.1002/ciuz.201400679.
- ↑ Klaus Roth: Pesto. Mediterrane Biochemie. In: Chemie in unserer Zeit. Band 40, Nr. 3, 2006, S. 200–206, doi:10.1002/ciuz.200600388.
- ↑ Stefan Jarau, u. a.: Workers Make the Queens in Melipona Bees: Identification of Geraniol as a Caste Determining Compound from Labial Glands of Nurse Bees. In: Journal of Chemical Ecology. 36, 2010, S. 565–569, doi:10. /s10886-010-9793-3.
- ↑ Yasumasa Kuwahara, Akihiro Kawai, Nobuhiro Shimizu, Susumu Tokumaru, Hiroshi Ueyama: Geraniol, E-3,7-dimethyl-2,6-octadien-1-ol, as the Alarm Pheromone of the Sycamore Lace Bug Corythucha ciliata (Say). In: Journal of Chemical Ecology. 37, 2011, S. 1211–1215, doi:10.1007/s10886-011-0025-2.
- ↑ P. Mohamed Shafi, M. Mohanakrishnan: Chemical Ecology of Teak (Tectona grandis Linn.) Floral Volatiles. In: Asian Journal of Chemistry. 32.11, 2020, S. 2693–2699.
- ↑ a b Y. u. Lei, Peng Fu, Xie Jun, Peng Cheng: Pharmacological Properties of Geraniol – A Review. In: Planta Medica. 85, 2019, S. 48–55, doi:10.1055/a-0750-6907.
- ↑ Maria Helena Pereira de Lira u. a.: Antimicrobial activity of geraniol: an integrative review. In: Journal of Essential Oil Research, 2020, S. 187–198, doi:10.1080/10412905.2020.1745697.
- ↑ L.A. Barros, A.R. Yamanaka, L.E. Silva, M.L.A. Vanzeler, D.T. Braum, J. Bonaldo: In vitro larvicidal activity of geraniol and citronellal against Contracaecum sp (Nematoda: Anisakidae). In: Brazilian Journal of Medical and Biological Research. 42, 2009, S. 918–920, doi:10.1590/S0100-879X2009005000023.
- ↑ Minsoo Cho, Insuk So, Jung Nyeo Chun, Ju-Hong Jeon: The antitumor effects of geraniol: Modulation of cancer hallmark pathways (Review). In: International Journal of Oncology. 48, 2016, S. 1772–1782, doi:10.3892/ijo.2016.3427.
- ↑ Alex Baleka Mutombo, Rahma Tozin, Hollande Kanyiki, Jean-Pierre Van Geertruyden, Yves Jacquemyn: Impact of antiviral AV2 in the topical treatment of HPV-associated lesions of the cervix: Results of a phase III randomized placebo-controlled trial. In: Contemporary Clinical Trials Communications. 15, 2019, S. 100377, doi:10.1016/j.conctc.2019.100377.
- ↑ Nasrollah Moradifar, Mohammad Kalantari Shahijan, Navid Bakhtiari, Mojdeh Tavakoli, Arash Amin: Aromatherapy in patients undergoing coronary artery bypass surgery: A systematic review of clinical trials. In: Global Journal of Medical, Pharmaceutical, and Biomedical Update. 16, 2021, S. 6, doi:10.25259/GJMPBU_5_2021.
- ↑ Maria Lis-Balchin: Aromatherapy with Essential Oils. In: Kemal Hüsnü Can Başer, G. Buchbauer: Handbook of Essential Oils. CRC Press, Boca Raton, London, New York, 2010, ISBN 978-1-4200-6315-8, S. 562–563.
- ↑ Verordnung (EG) Nr. 1223/2009
- ↑ U.S. EPA. 2004. Geraniol; Exemption from the requirement of a tolerance. Fed. Reg. 69(82), S. 23146–23151, 28. April 2004.
- ↑ D. S. Pedersen, D. L. Capone, G. K. Skouroumounis, A. P. Pollnitz, M. A. Sefton: Quantitative analysis of geraniol, nerol, linalool, and alpha-terpineol in wine. In: Anal Bioanal Chem. 375(4), Feb 2003, S. 517–522. PMID 12610703
- ↑ B. Sgorbini, M. R. Ruosi, C. Cordero, E. Liberto, P. Rubiolo, C. Bicchi: Quantitative determination of some volatile suspected allergens in cosmetic creams spread on skin by direct contact sorptive tape extraction-gas chromatography-mass spectrometry. In: Journal of Chromatography A. 1217(16), 16. Apr 2010, S. 2599–2605. PMID 20074740
- ↑ Karl-Heinz Kubeczka: History and Sources of Essential Oil Research. In: Kemal Hüsnü Can Başer, Gerhard Buchbauer: Handbook of essential oils: science, technology, and applications. CRC Press, Boca Raton, 2010, ISBN 978-1-4200-6315-8, S. 3–38.


 French
French Deutsch
Deutsch