Homolytische Spaltung – Wikipedia
Bei der homolytischen Spaltung oder homolytischen Bindungsspaltung und Radikalreaktion wird eine kovalente Bindung zweier Atome durch äußere Einflüsse, wie hochfrequentem Licht (Photolyse) oder Wärme (Thermolyse) gespalten, sie ist also eine Art der Dissoziation. Hierbei verbleibt je ein Bindungselektron nach der Spaltung von A–B bei jedem der vorherigen Bindungspartner (A und B), es entstehen Radikale (A· und B·):[1] Radikale entstehen, wenn Teilchen mit wenig polaren Bindungen reagieren. Besonders häufig treten sie im Gaszustand auf, wenn die kinetische Energie der Teilchen groß genug ist, um beim Zusammenstoß eine Bindungsspaltung zu ermöglichen.
Die Bildung von Radikalen findet bevorzugt in unpolarem Milieu statt, da im polaren Milieu die Bildung von Ionen oft begünstigt ist. Die homolytische Spaltung wird für die Erzeugung von Radikalen eingesetzt, die als Startradikale eine Anwendung
- in der Polymerchemie[2],
- bei der Halogenierung von Alkanen[3],
- bei der Seitenkettenhalogenierung von alkylierten Aromaten (SSS-Regel),
- bei der Halogenierung in der Allylstellung von Alkenen
haben.
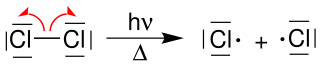
Ein Beispiel zur Radikalerzeugung ist die lichtinduzierte Homolyse von Chlor:
Bei der Photolyse von Aceton entstehen zunächst je ein Methyl-Radikal und ein Acetyl-Radikal.[4]
Die Umkehrung der homolytischen Spaltung ist die Rekombination von zwei Radikalen unter Entstehung einer Einfachbindung.
Dissoziationsenergien
[Bearbeiten | Quelltext bearbeiten]Dissoziationsenergien gelten als ein Maß für die Stabilität von kovalenten Bindungen. Sie geben den Energiebetrag an, der nötig ist, um eine Bindung homolytisch zu spalten. Daher ist dieser Wert bei Mehrfachbindungen größer als bei Einfachbindungen.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Heterolytische Spaltung (Gegensatz zur Homolyse)
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Homolyse. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- ↑ M. D. Lechner, K. Gehrke und E. H. Nordmeier: Makromolekulare Chemie, 4. Auflage, Birkhäuser Verlag, 2010, S. 54–55, ISBN 978-3-7643-8890-4.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 205, ISBN 3-342-00280-8.
- ↑ Eintrag zu Methyl.... In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.


 French
French Deutsch
Deutsch