Streptococcus pyogenes – Wikipedia
| Streptococcus pyogenes | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
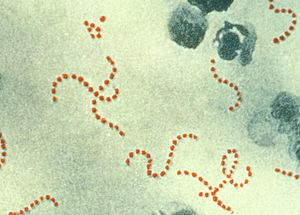 Streptococcus pyogenes | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Streptococcus pyogenes | ||||||||||||
| Rosenbach 1884 |
Streptococcus pyogenes (von griechisch πύον Eiter – Eiter hervorrufende Streptokokken) ist ein häufig vorkommendes Bakterium, das beim Menschen unter anderem Scharlach und eitrige Tonsillitis oder Tonsillopharyngitis auslösen kann.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Streptococcus pyogenes ist grampositiv, kettenbildend, beta-hämolysierend und Pyrrolidonyl-Arylamidase-positiv. S. pyogenes wächst anaerob, ist aber aerotolerant, d. h. die Bakterien wachsen in Anwesenheit von Luftsauerstoff, benötigen aber keinen Sauerstoff für ihren Stoffwechsel. Die einzelne, rundliche Zelle hat eine Größe von 0,6 bis 1 µm. S. pyogenes kann sich nicht aktiv bewegen und bildet keine Endosporen. Auf Blutagar, einem bluthaltigen Nährmedium, entstehen grauweißlich schleimige Kolonien. Nach dem Lancefield-Schema, das die Streptococcus-Arten nach ihrem C-Polysaccharid differenziert, gehört S. pyogenes zur Gruppe A.
Pathogenese und verursachte Krankheiten
[Bearbeiten | Quelltext bearbeiten]Streptococcus pyogenes besitzt verschiedene Virulenzfaktoren, die es dem Bakterium ermöglichen, sich der Abwehrreaktion des menschlichen Immunsystems zu entziehen und Krankheiten auszulösen. Einer der wichtigsten Virulenzfaktoren ist das M-Protein, ein antiphagozytotisches Oberflächenprotein. Einen ähnlichen Effekt hat die bei einigen Stämmen vorhandene Kapsel aus Hyaluronsäure. Darüber hinaus spaltet eine C5a-Peptidase wichtige Signalmoleküle im Komplementsystem und unterbindet so die Aktivierung dieses Teiles des Immunsystems.
Die Fibronektin-bindenden Proteine F1 und SfbI dienen dem Bakterium zum Anheften an die Endothelzellen und unterstützen so sein Eindringen in menschliches Gewebe. Dort angekommen, zerstören die Streptolysine O und S rote Blutkörperchen und andere Zellen. Die Streptokinase löst Fibrin auf. Außerdem helfen auch verschiedene Enzyme wie DNAsen, Proteasen und Hyaluronidasen dem Bakterium bei der Ausbreitung im Gewebe. Um sich gegenüber anderen Bakterien behaupten zu können, sezerniert S. pyogenes des Weiteren Bakteriengifte.
Streptococcus pyogenes verursacht sowohl akute invasive Infektionen als auch nicht-invasive Folgekrankheiten. Die akuten Infektionen gehen dabei wegen der vielen gewebeauflösenden Enzyme häufig mit Eiterbildung einher. Ein mögliches Ziel sind die oberen Atemwege, wo sich eine Mandel- oder Rachenentzündung bilden kann. Auf der Haut können je nach Tiefe der Infektion und Abwehrlage Impetigo, Erysipel oder Phlegmone entstehen. Lokale Infektionen können bei einer schlechten Abwehrlage auch in eine generalisierte Infektion übergehen (Sepsis).
Alle Stämme von S. pyogenes sind „poly-lysogenisiert“, d. h. sie tragen einen oder mehrere Bakteriophagen auf ihrem Genom.[1] Einige der Phagen können defekt sein, aber in einigen Fällen können aktive Phagen Defekte in anderen ausgleichen.[2] Im Allgemeinen ist das Genom von S. pyogenes-Stämmen, die während der Krankheit isoliert wurden, zu mehr als 90 % identisch, sie unterscheiden sich aber durch den oder die Phagen, die sie tragen.
Wenn das Streptokokkenbakterium von einem Virus (Bakteriophagen) befallen worden ist, kann es mithilfe des Virusgenoms ein pyrogenes Streptokokken-Exotoxin (PSE, auch mit spe bezeichnet, englisch Streptococcal pyrogenic exotoxin) bilden. Dieses kommt in drei Varianten A, B und C vor, wobei A und C als Superantigene wirken. Bekannt sind die – mit Stand September 2020 noch nicht vom International Committee on Taxonomy of Viruses (ICTV) bestätigten – Kandidaten „Streptococcus-Phage T12“ (Akronym: T12, Familie: Drexlerviridae, Morphotyp: Siphoviren)[3][4] für speA, und „Bakteriophage CS112“ (ΦCS112) für speC.[5][6] Die betreffenden (Phagen-)Gene sind (in Kursivschrift): speA, speC usw.[7] PSE B spaltet Immunglobuline. Alle drei Toxine können außerdem die Symptome von Scharlach hervorrufen. Bei einer Ausstattung des Immunsystems mit risikoreichen MHCII-Allotypen[8] kann es zu einer nekrotisierenden Fasziitis oder einem Streptokokken-induzierten toxischen Schocksyndrom (STSS) kommen. Rund 30 Prozent der an letzterem Erkrankten versterben an Schock und Multiorganversagen. Einzig eine frühe Diagnose ermöglicht die erfolgreiche Behandlung.[9]
Gefürchtet sind die immunologisch bedingten Folgeerkrankungen der Streptokokkeninfektion, insbesondere die akute Glomerulonephritis und das akute rheumatische Fieber. Es ist die akute Glomerulonephritis, welche ca. drei Wochen nach dem eigentlichen Infekt auftritt, von der mit dem Infekt auftretenden akuten interstitiellen Nephritis abzugrenzen. Diese findet im Rahmen einer überschießenden, zellvermittelten Immunantwort als abakterielle Entzündung des Niereninterstitiums statt. Bei der Glomerulonephritis kommt es durch Ablagerung von Antigen-Antikörper-Komplexen (Immunkomplexkrankheit Typ III) zu Schädigungen der Niere. Beim akuten rheumatischen Fieber spielen Kreuzreaktionen zwischen Antigenen der Streptokokken und körpereigenen Strukturen, vor allem Kollagen IV, eine Rolle. Es kommt zu Entzündungen im Herz (Endokarditis, Myokarditis, Perikarditis), in Gelenken (Arthritis), im Gehirn (Chorea minor) und in der Haut (Erythema) oder in seltenen Fällen in der Muskulatur (Pyomyositis). In der Unterhaut bilden sich Knötchen.
Diagnostik
[Bearbeiten | Quelltext bearbeiten]Je nach Ort der Erkrankung können Blut, Punktate, Biopsiematerial oder Eiterabstriche im Labor untersucht werden. Dort können bereits unter dem Mikroskop die typischen Ketten erkannt werden. Um S. pyogenes anzuzüchten, benutzt man Agarplatten, denen Fleischextrakt, Blut oder Serum zugegeben ist. Bei 37 °C und 5 bis 10 % Kohlendioxid ist in 16 bis 24 Stunden mit einer Koloniebildung zu rechnen.
Zur Differenzierung des C-Polysaccharids (siehe oben) können im Handel erhältliche Testkits verwendet werden, die mit Antikörpern arbeiten. Für wissenschaftliche Zwecke werden manchmal auch die Gene für das M-Protein (emm-Gene) untersucht.
Liegt ein Verdacht auf ein durch S. pyogenes verursachtes rheumatisches Fieber vor, kann der Patient auf Antikörper gegen Streptolysin O (siehe oben) und gegen die DNAse untersucht werden.
Therapie
[Bearbeiten | Quelltext bearbeiten]Streptokokken können gut mit Penicillinen, bei schweren Fällen auch kombiniert mit Clindamycin, bekämpft werden. Bei Unverträglichkeit werden Makrolidantibiotika eingesetzt. Weitere Alternativen sind Cephalosporine.
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]S. pyogenes kommt weltweit vor. Es befällt nur den Menschen, gehört hier aber zu den häufigsten Erregern von Haut- und Atemwegserkrankungen. Dabei fällt auf, dass in gemäßigten Klimazonen die Racheninfektionen die größte Rolle spielen, während in tropischen Ländern eher Hautinfektionen auftreten. Die Übertragung der Keime geschieht sowohl durch Tröpfchen- als auch durch Schmierinfektionen. Obwohl auch bei Menschen, bei denen keine Krankheit aufgetreten ist, Keime nachgewiesen werden können, sind apparente Kranke als Infektionsquelle häufiger.
Sonstiges
[Bearbeiten | Quelltext bearbeiten]Zwei Enzyme von S. pyogenes werden in der Medizin zu therapeutischen Zwecken eingesetzt: Die Streptokinase dient zum Auflösen von Blutgerinnseln, die DNasen werden in der Wundbehandlung eingesetzt.
Im „Kampf“ mit Makrophagen greift S. pyogenes mithilfe von Cytolysinen nicht nur deren Zellmembran an, sondern in einem kaskadierten Prozess auch die Mitochondrien.[10]
Der Chirurg Friedrich Fehleisen (1854–1924) hatte diesen, früher Streptococcus erysipelatos genannten Erreger als Verursacher des Erysipels entdeckt[11] und ihn zur Therapie von bösartigen Geschwülsten eingesetzt.[12]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Helmut Hahn et al. (Hrsg.): Medizinische Mikrobiologie und Infektiologie. 5. vollständige aktualisierte Auflage. Springer Medizin Verlag, Heidelberg u. a. 2005, ISBN 3-540-21971-4.
- Fritz H. Kayser et al.: Medizinische Mikrobiologie. Taschenlehrbuch medizinische Mikrobiologie. 11. überarbeitete und erweiterte Auflage. Thieme, Stuttgart u. a. 2005, ISBN 3-13-444811-4.
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 230 f.
- Anastassios C. Papageorgiou, Carleen M. Collins, Delia M. Gutman, J. Bradford Kline, Susan M. O’Brien, Howard S. Tranter, K. Ravi Acharya: Structural basis for the recognition of superantigen streptococcal pyrogenic exotoxin A (SpeA1) by MHC class II molecules and T-cell receptors, in: EMBO J. 18(1), 4. Januar 1999, S. 9–21, doi:10.1093/emboj/18.1.9, PMC 1171097 (freier Volltext), PMID 9878045 (Allele SpeA1 bis SpeA4).
- Matthias Imöhl, Christina Fitzner, Stephanie Perniciaro, Mark van der Linden: Epidemiology and distribution of 10 superantigens among invasive Streptococcus pyogenes disease in Germany from 2009 to 2014, in: PLOS ONE, 18. Juli 2017, doi:10.1371/journal.pone.0180757.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Informationen des Robert Koch-Instituts zu Scharlach und anderen Infektionen mit Streptococcus pyogenes
- Thomas Proft, John D. Fraser: Streptococcal Superantigens: Biological properties and potential role in disease, in: J. J. Ferretti, D. K. Stevens, V. A. Fischetti (Hrsg.): Streptococcus pyogenes: Basic Biology to Clinical Manifestations, 10. Februar 2016, University of Oklahoma Health Sciences Center; insbes. Tabelle 1
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ J. J.Ferretti, W. M. McShan, D. Ajdic D, D. J. Savic, G. Savic, K. Lyon et al.: Complete Genome Sequence of an M1 Strain of Streptococcus pyogenes. In: Proc Natl Acad Sci USA. 98. Jahrgang, Nr. 8, 2001, S. 4658–63, doi:10.1073/pnas.071559398, PMID 11296296, PMC 31890 (freier Volltext), bibcode:2001PNAS...98.4658F.
- ↑ C. Canchaya, F. Desiere, W. M. McShan, J. J. Ferretti, J. Parkhill, H. Brussow: Genome analysis of an inducible prophage and prophage remnants integrated in the Streptococcus pyogenes strain SF370. In: Virology. 302. Jahrgang, Nr. 2, 2002, S. 245–258, doi:10.1006/viro.2002.1570, PMID 12441069.
- ↑ NCBI: Bacteriophage T12 (species)
- ↑ Thomas B. Broudy, Vincent A. Fischetti: In Vivo Lysogenic Conversion of Tox− Streptococcus pyogenes to Tox+ with Lysogenic Streptococci or Free Phage. In: Infect Immun., Band 71, Nr. 7, Juli 2003, S. 3782 –3786; doi:10.1128/IAI.71.7.3782-3786.2003, PMC 161974 (freier Volltext), PMID 12819060.
- ↑ Stephen C. Goshorn, Patrick M. Schlievert: Bacteriophage association of streptococcal pyrogenic exotoxin type C. In: J Bacteriol. Band 171, Nr. 6, Juni 1989, S. 3068–3073; doi:10.1128/jb.171.6.3068-3073.1989, PMC 210016 (freier Volltext), PMID 2566595.
- ↑ SIB: Viral exotoxin. ViralZone
- ↑ Tlou Mmolawa: Molecular analysis of temperate prophages in Salmonella enterica serovar Typhimurioum DT 64 isolated in Australia, Doktorarbeit an der University of Adelaide, Januar 2001
- ↑ Allotypen, in: Lexikon der Biologie (spektrum.de)
- ↑ Dorothea Ranft: Gefräßige Streptokokken: Spätfolgen der Infektion können dramatisch sein. In: Medical Tribune. 19. Juli 2018, abgerufen am 9. Juli 2019.
- ↑ Oliver Goldman et al.: Streptococcus pyogenes induces oncosis in macrophages through the activation of an inflammatory programmed cell death pathway. Cellular Microbiology Band 11, Nr. 1, S. 138–155, doi:10.1111/j.1462-5822.2008.01245.x.
- ↑ Friedrich Fehleisen: Die Aetiologie des Erysipels. Berlin 1883 (Digitalisat – Internet Archive).
- ↑ Werner Köhler: Fehleisen, Friedrich. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin und New York 2005, ISBN 3-11-015714-4, S. 394.


 French
French Deutsch
Deutsch