Ligando puente , la enciclopedia libre

En química de coordinación, un ligando puente es un ligando que conecta dos o más átomos, normalmente iones metálicos.[1] El ligando puede ser atómico o poliatómico. Prácticamente todos los compuestos orgánicos complejos pueden servir como ligandos puente, por lo que el término suele restringirse a ligandos pequeños como los pseudohaluros o a ligandos diseñados específicamente para unir dos metales.
Al nombrar un complejo en el que un único átomo sirve de puente entre dos metales, el ligando puente va precedido de la letra griega mu, μ,[2] con un subíndice numérico que denota el número de metales unidos al ligando puente. μ2 se suele denotar simplemente como μ. Al describir complejos de coordinación hay que tener cuidado de no confundir μ con η ('eta'), que se refiere a la hapticidad. Los ligandos que no son puente se denominan ligandos terminales.
Lista de ligandos puente
[editar]Prácticamente todos los ligandos tienden puentes, a excepción de las aminas y el amoníaco.[3] Entre los ligandos puente más comunes se encuentran la mayoría de los aniones.
| Ligando puente | Nombre | Ejemplo |
|---|---|---|
| OH- | hidróxido | [Fe 2(OH) 2(H 2O) 8]4+, ver olación |
| O2- | óxido | [Cr 2O 7]2−, véase polioxometalato |
| SH- | hidrosulfuro | Cp 2Mo 2(SH) 2S 2 |
| NH2- | azanida | HgNH 2Cl |
| N3- | nitruro | [Ir 3N(SO 4) 6(H 2O) 3]4−, véase complejo de nitrido metálico |
| CO | carbonilo | Fe 2(CO) 9, véase carbonilo puente |
| Cl- | cloruro | Nb 2Cl 10, véase ligandos de haluro |
| H- | hidruro | B 2H 6 |
| CN- | cianuro | aprox. Fe 7(CN) 18 (azul de Prusia), véase cianometalato |
| PPh− 2 | difenilfosfuro | ver complejos de fosfido de metales de transición |
Muchos ligandos orgánicos simples forman puentes fuertes entre centros metálicos. Muchos ejemplos comunes incluyen derivados orgánicos de los ligandos inorgánicos anteriores (R = alquilo, arilo): OR-, SR-, NR-2, NR2- (imido), PR-2 (fosfido, nótese la ambigüedad con la entrada anterior), PR2- (fosfinidino), y muchos más.
Ejemplos
[editar]- Compuestos y complejos con ligandos puente
- En este complejo de rutenio, dímero de dicloruro de (cimeno)rutenio, dos ligandos cloruro son terminales y dos son μ2 puente.
- La pirazina es un ligando puente en este compuesto de dirutenio, denominado complejo de Creutz-Taube.
- En el clústerde cobalto Co3(CO)9(CtBu), el ligando CtBu es triplemente puente, aunque este aspecto no suele indicarse en la fórmula.
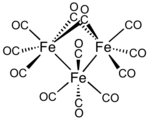
- En el dodecacarbonilo de trihierro, dos ligandos CO son puente y diez son ligandos terminales. Los ligandos de CO terminal y puente se intercambian rápidamente.
- En el NbCl5, hay dos ligandos puente y ocho ligandos cloruro terminales.
- El clúster [Au6C(PPh3) 6]2+ presenta un ligando μ6-carburo, aunque de nuevo no se suele utilizar el designador "μ".
- En el trióxido de renio, los ligandos de óxido son todos μ2. Estos ligandos de óxido "pegan" los centros metálicos.
- En el caso del ZrCl4, hay ligandos cloruro tanto terminales como doblemente puenteantes.
- En el acetato de rodio(II), los cuatro grupos acetato son ligandos puente.
- In VO(HPO
4)·0.5H2O, los pares de centros de vanadio(IV) están unidos por ligandos de agua.[4]
Enlace
[editar]Para los ligandos doblemente puente (μ2-), dos representaciones limitantes son las interacciones de enlace de 4 electrones y de 2 electrones. Estos casos se ilustran en la química de grupos principales mediante [Me2Al(μ2-Cl)]2 y [Me2Al(μ2-Me)]2. La posibilidad de que se produzcan enlaces metal-metal complica este análisis. Los estudios computacionales sugieren que la unión metal-metal está ausente en muchos compuestos en los que los metales están separados por ligandos puente. Por ejemplo, los cálculos sugieren que Fe2(CO)9 carece de enlace hierro-hierro en virtud de un enlace 3-centro de 2 electrones que implica a uno de los tres ligandos puente de CO[5].
Representaciones de dos tipos de interacciones μ-ligando puente, enlace 3-centro, 4-electrón (izquierda) y enlace 3-centro, 2-electrón.[5]
Intercambio puente-terminal
[editar]
El intercambio de ligandos puente y terminales se denomina intercambio puente-terminal. El proceso se invoca para explicar las propiedades fluxionales de los complejos de carbonilo metálico e isocianuro metálico.[6] Algunos complejos que presentan este proceso son el carbonilo de cobalto y el dímero de ciclopentadienil hierro dicarbonilo:
- Co2(μ-CO)2(CO)6 ⇌ Co2(μ-CO)2(CO)4(CO)2
- (C5H5)2Fe2(μ-CO)2(CO)2 ⇌ (C5H5)2Fe2(μ-CO)2(CO)2
Estos procesos dinámicos, que son degenerados, proceden a través de un intermediario en el que los ligandos de CO son todos terminales, es decir, (CO)4Co-Co(CO)4 y (C5H5)(CO)2Fe-Fe(CO)2C5H5.
Ligandos polifuncionales
[editar]Los ligandos polifuncionales pueden unirse a los metales de muchas maneras y, por tanto, pueden establecer puentes entre metales de diversas formas, como compartiendo un átomo o utilizando varios átomos. Ejemplos de estos ligandos poliatómicos son los oxoaniones CO2−
3 y los carboxilatos relacionados, PO3−
4, y los polioxometalatos. Se han desarrollado varios ligandos organofosforados que unen pares de metales, un ejemplo bien conocido es Ph
2PCH
2PPh
2
Véase también
[editar]Referencias
[editar]- ↑ Unión Internacional de Química Pura y Aplicada. «bridging ligand». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Union internationale de chimie pure et appliquée, ed. (2005). Nomenclature of inorganic chemistry: IUPAC recommendations 2005. Royal society of chemistry. ISBN 978-0-85404-438-2. Consultado el 2 de agosto de 2023.
- ↑ Werner, H. (2004). «The Way into the Bridge: A New Bonding Mode of Tertiary Phosphanes, Arsanes, and Stibanes». Angew. Chem. Int. Ed. 43 (8): 938-954. PMID 14966876. doi:10.1002/anie.200300627.
- ↑ Koo, H.-J.; Whangbo, M.; VerNooy, P. D.; Torardi, C. C.; Marshall, W. J. (2002). «Flux growth of vanadyl pyrophosphate, (VO)2P2O7, and spin dimer analysis of the spin exchange interactions of (VO)2P2O7 and vanadyl hydrogen phosphate, VO(HPO4).0.5H2O.». Inorg. Chem. 41 (18): 4664-72. PMID 12206689. doi:10.1021/ic020249c.
- ↑ a b Green, J. C.; Green, M. L. H.; Parkin, G. (2012). «The occurrence and representation of three-centre two-electron bonds in covalent inorganic compounds». Chem. Commun. 2012 (94): 11481-503. PMID 23047247. doi:10.1039/c2cc35304k.
- ↑ Adams, R. D.; Cotton, F. A. (1973). «Pathway of Bridge-Terminal Ligand Exchange in Some Binuclear Metal Carbonyls. Bis(pentahapto-cyclopentadienyldicarbonyliron) and Its Di(methyl Isocyanide) Derivative and Bis(pentahapto-cyclopentadienylcarbonylnitrosylmanganese)». Journal of the American Chemical Society 95 (20): 6589-6594. doi:10.1021/ja00801a012.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Bridging ligand» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.


 French
French Deutsch
Deutsch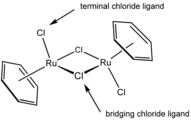



![El clúster [Au6C(PPh3) 6]2+ presenta un ligando μ6-carburo, aunque de nuevo no se suele utilizar el designador "μ".](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5f/Au6C%28PPh3%296.png/138px-Au6C%28PPh3%296.png)