Receptor 5-HT3 , la enciclopedia libre
El receptor 5-HT 3 es un subtipo de receptor 5-HT que sirve de ligando al neurotransmisor endógeno de la serotonina (5-hydroxytryptamine, 5-HT o receptores de serotonina). Pertenece a la superfamilia Cys-loop de canales iónicos controlados por ligandos (LGIC) y, por lo tanto, difiere estructural y funcionalmente de todos los demás receptores 5-HT en el grupo de receptores acoplados a proteína G.[1][2][3] Este canal iónico es selectivo para cationes y media la despolarización y excitación neuronal dentro de los sistemas nerviosos central y periférico .[1]
Al igual que con otros canales iónicos activados por ligando, el receptor 5-HT3 consta de cinco subunidades dispuestas alrededor de un poro central que es permeable a los iones de sodio (Na), potasio (K) y calcio (Ca). La unión del neurotransmisor 5-hidroxitriptamina (serotonina) al receptor 5-HT3 abre el canal que, a su vez, conduce a una respuesta excitatoria en las neuronas. La corriente interna de rápida activación y desensibilización es transportada predominantemente por iones de sodio y potasio.[2] Están más estrechamente relacionados por homología con el receptor nicotínico de acetilcolina.
Estructura
[editar]El receptor 5-HT3 difiere notablemente en estructura y mecanismo de los otros subtipos de receptores 5-HT acoplados a proteína G. Por lo general, el canal funcional está compuesto por cinco subunidades 5-HT3A idénticas (homopentaméricas). Puede también constar de una combinación del 5-HT3A con una de las otras cuatro subunidades (heteropentaméricas) 5-HT3B,[4][5][6][7] 5-HT3C, 5-HT3D o 5-HT3E.[8] Al parecer, sólo las subunidades 5-HT3A forman canales homopentaméricos funcionales. Todos los demás subtipos de subunidades deben heteropentamerizarse con subunidades 5-HT3A para formar canales funcionales. Además, actualmente no se ha encontrado ninguna diferencia farmacológica entre el receptor heteromérico 5-HT3AC, 5-HT3AD, 5-HT3AE y el receptor homomérico 5-HT3A.[9] La glicosilación N-terminal de las subunidades del receptor es fundamental para el ensamblaje de la subunidad y el tráfico de la membrana plasmática.[10]
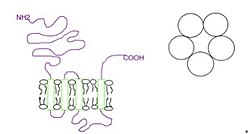
Las subunidades rodean un canal iónico central de manera pseudosimétrica. Cada subunidad comprende:
- un dominio N-terminal extracelular que comprende el sitio de unión al ligando ortostérico;
- un dominio transmembrana que consta de cuatro hélices alfa interconectadas (M1-M4), con el bucle extracelular M2-M3 involucrado en el mecanismo de activación;
- un gran dominio citoplasmático entre M3 y M4 involucrado en el tráfico y la regulación del receptor; y
- un extremo C extracelular corto (Fig. 1).[1]
El dominio extracelular es el sitio de acción de los agonistas y antagonistas competitivos, mientras que el dominio transmembrana contiene el poro de iones central, la puerta del receptor y el filtro de selectividad principal que permite que los iones atraviesen la membrana celular.[2]
Genes humanos y de ratón
[editar]Los genes que codifican los receptores 5-HT3 humanos se encuentran en los cromosomas 11 (HTR3A, HTR3B) y 3 (HTR3C, HTR3D, HTR3E), por lo que parece que provienen de duplicaciones de genes. Los genes HTR3A y HTR3B codifican las subunidades 5-HT3A y 5-HT3B, mientras que los genes HTR3C, HTR3D y HTR3E codifican las subunidades 5-HT3C, 5-HT3D y 5-HT3E. Los genes HTR3C y HTR3E no parecen formar canales homoméricos funcionales, pero cuando se expresan conjuntamente con HTR3A forman complejos heteroméricos con eficacias 5-HT disminuidas o aumentadas. Aún no se ha identificado el papel fisiopatológico de estas subunidades adicionales.[11]
El gen del receptor 5-HT3A humano tiene una estructura similar al gen del ratón que tiene 9 exones y se distribuye en ~13 kb. Cuatro de sus intrones están exactamente en la misma posición que los intrones en el gen homólogo del receptor de acetilcolina α7, lo que muestra claramente su relación evolutiva.[12][13]

Expresión Los genes que codifican para el 5-HT3C, 5-HT3D y 5-HT3E tienden a mostrar un patrón de expresión periférico restringido, con altos niveles particularmente a nivel del intestino. En el duodeno y en el estómago de seres humanos, por ejemplo, el ARNm del receptor 5-HT3C y 5-HT3E podría ser mayor que los del 5-HT3A y 5-HT3B .
Polimorfismo En pacientes tratados con fármacos quimioterapéuticos, cierto polimorfismo del gen HTR3B podría predecir el éxito del tratamiento antiemético. Esto podría indicar que la subunidad del receptor 5-HTR3B podría usarse como biomarcador de la eficacia del fármaco antiemético.
Distribución
[editar]El receptor 5-HT3 se expresa a través de los sistemas nerviosos central y periférico y es mediador de una variedad de funciones fisiológicas.[14] A nivel celular, se ha demostrado que los receptores postsinápticos 5-HT3 median la transmisión sináptica excitatoria rápida en las interneuronas neocorticales de rata, la amígdala y el hipocampo, y en la corteza visual del hurón.[15][16][17][18] Los receptores 5-HT3 también están presentes en las terminaciones nerviosas presinápticas. Existe alguna evidencia de un papel en la modulación de la liberación de neurotransmisores,[19][20] pero la evidencia no es concluyente.[21]
Agonistas
[editar]Cuando los agonistas activan el receptor y abren el canal iónico, se suelen observar los siguientes efectos:
- SNC: activación del centro de náuseas y vómitos en el tronco encefálico, ansiedad,[22] así como actividad anticonvulsiva[23] y pronociceptiva .[24][25]
- SNP : excitación neuronal (en neuronas autonómicas, nociceptivas), emesis[22]
Los agonistas del receptor incluyen:
Antagonistas
[editar]Algunos antagonistas del receptor (clasificados por su respectiva aplicación terapéutica) incluyen:
Moduladores alostéricos positivos
[editar]Los siguientes agentes no son agonistas sobre el receptor, pero aumentan la afinidad o eficacia de los receptores cuando está presente un agonista:
- Derivados del indol
- 5-cloroindol[30]
- Anestésicos orgánicos pequeños
Historia
[editar]El descubrimiento del receptor 5-HT3 se produjo en 1986, careciendo de herramientas farmacológicas selectivas.[14] Sin embargo, con el descubrimiento de que el receptor 5-HT3 desempeña un papel destacado en los vómitos inducidos por quimioterapia y radioterapia, y el desarrollo concomitante de antagonistas selectivos del receptor 5-HT <sub id="mwAWk">3</sub> para suprimir estos efectos secundarios, despertó un gran interés en la industria farmacéutica.[2][33] Desde entonces, siguió rápidamente la identificación de receptores 5-HT3 en líneas celulares y tejidos nativos.[14]
Referencias
[editar]- ↑ a b c Barnes NM, Hales TG, Lummis SC, Peters JA (January 2009). «The 5-HT3 receptor--the relationship between structure and function». Neuropharmacology 56 (1): 273-284. PMC 6485434. PMID 18761359. doi:10.1016/j.neuropharm.2008.08.003.
- ↑ a b c d Thompson AJ, Lummis SC (2006). «5-HT3 Receptors». Current Pharmaceutical Design 12 (28): 3615-3630. PMC 2664614. PMID 17073663. doi:10.2174/138161206778522029.
- ↑ Reeves DC, Lummis SC (2002). «The molecular basis of the structure and function of the 5-HT3 receptor: a model ligand-gated ion channel (review)». Molecular Membrane Biology 19 (1): 11-26. PMID 11989819. doi:10.1080/09687680110110048.
- ↑ Davies PA, Pistis M, Hanna MC, Peters JA, Lambert JJ, Hales TG, Kirkness EF (1999). «The 5-HT3B subunit is a major determinant of serotonin-receptor function». Nature 397 (6717): 359-363. Bibcode:1999Natur.397..359D. PMID 9950429. doi:10.1038/16941.
- ↑ Dubin AE, Huvar R, D'Andrea MR, Pyati J, Zhu JY, Joy KC, Wilson SJ, Galindo JE, Glass CA, Luo L, Jackson MR, Lovenberg TW, Erlander MG (1999). «The pharmacological and functional characteristics of the serotonin 5-HT3A receptor are specifically modified by a 5-HT3B receptor subunit». J Biol Chem 274 (43): 30799-30810. PMID 10521471. doi:10.1074/jbc.274.43.30799.
- ↑ Monk SA, Desai K, Brady CA, Williams JM, Lin L, Princivalle A, Hope AG, Barnes NM (2001). «Generation of a selective 5-HT3B subunit-recognising polyclonal antibody; identification of immunoreactive cells in rat hippocampus». Neuropharmacology 41 (8): 1013-1016. PMID 11747906. doi:10.1016/S0028-3908(01)00153-8.
- ↑ Boyd GW, Low P, Dunlop JI, Ward M, Vardy AW, Lambert JJ, Peters J, Conolly CN (2002). «Assembly and cell surface expression of homomeric and heteromeric 5-HT3 receptors: The role of oligomerisation and chaperone proteins». Mol Cell Neurosci 21 (1): 38-50. PMID 12359150. doi:10.1006/mcne.2002.1160.
- ↑ Niesler B, Walstab J, Combrink S, Moeller D, Kapeller J, Rietdorf J, Boenisch H, Goethert M, Rappold G, Bruess M (2007). «Characterization of the Novel Human Serotonin Receptor Subunits 5-HT3C, 5- HT3D and 5-HT3E». Mol Pharmacol 72 (Mar 28): 8-17. PMID 17392525. doi:10.1124/mol.106.032144.
- ↑ Niesler, Beate (February 2011). «5-HT3 receptors: potential of individual isoforms for personalised therapy». Current Opinion in Pharmacology 11 (1): 81-86. PMID 21345729. doi:10.1016/j.coph.2011.01.011.
- ↑ Quirk, Phillip L.; Rao, Suma; Roth, Bryan L.; Siegel, Ruth E. (15 de agosto de 2004). «Three putative N-glycosylation sites within the murine 5-HT3A receptor sequence affect plasma membrane targeting, ligand binding, and calcium influx in heterologous mammalian cells». Journal of Neuroscience Research 77 (4): 498-506. ISSN 0360-4012. PMID 15264219. doi:10.1002/jnr.20185.
- ↑ Sanger GJ (September 2008). «5-hydroxytryptamine and the gastrointestinal tract: where next?». Trends in Pharmacological Sciences 29 (9): 465-471. PMID 19086255. doi:10.1016/j.tips.2008.06.008.
- ↑ a b c Uetz, P; Abdelatty, F; Villarroel, A; Rappold, G; Weiss, B; Koenen, M (1994). «Organisation of the murine 5-HT3 receptor gene and assignment to human chromosome 11». FEBS Letters 339 (3): 302-306. PMID 8112471. doi:10.1016/0014-5793(94)80435-4.
- ↑ Uetz, P. (1992) Das 5HT3-Rezeptorgen der Maus. Diploma Thesis, University of Heidelberg, 143 pp.
- ↑ a b c Yakel, JL (2000). Endo, M; Kurachi, Y, eds. The 5-HT3 receptor channel: function, activation and regulation in Pharmacology of Ionic Channel Function: Activators and Inhibitors (Handbook of Experimental Pharmacology) 147. Berlin: Springer-Verlag. pp. 541-560. ISBN 3-540-66127-1.
- ↑ Férézou I, Cauli B, Hill EL, Rossier J, Hamel E, Lambolez B (2002). «5-HT3 receptors mediate serotonergic fast synaptic excitation of neocortical vasoactive intestinal peptide/cholecystokinin interneurons». J Neurosci 22 (17): 7389-7397. PMC 6757992. PMID 12196560. doi:10.1523/JNEUROSCI.22-17-07389.2002.
- ↑ Kazuyoshi Kawa (1994). «Distribution and Functional Properties of 5HT3 Receptors in the Rat Hippocampus Dentate Gyrus». Journal of Neurophysiology 71 (5): 1935-1947. PMID 7520482. doi:10.1152/jn.1994.71.5.1935.
- ↑ Sugita S, Shen KZ, North RA (1992). «5-hydroxytryptamine is a fast excitatory transmitter at 5-HT3 receptors in rat amygdala». Neuron 8 (1): 199-203. PMID 1346089. doi:10.1016/0896-6273(92)90121-S.
- ↑ Roerig B, Nelson DA, Katz LC (1992). «Fast synaptic signaling by nicotinic acetylcholine and serotonin 5-HT3 receptors in developing visual cortex». J Neurosci 17 (21): 199-203. PMC 6573745. PMID 9334409.
- ↑ Rondé P, Nichols RA (1998). «High calcium permeability of serotonin 5-HT3 receptors on presynaptic nerve terminals from rat striatum». J Neurochem 70 (3): 1094-1103. PMID 9489730. doi:10.1046/j.1471-4159.1998.70031094.x.
- ↑ Rondé P, Nichols RA (1997). «5-HT3 receptors induce rises in cytosolic and nuclear calcium in NG108-15 cells via calcium-induced calcium release». Cell Calcium 22 (5): 357-365. PMID 9448942. doi:10.1016/S0143-4160(97)90020-8.
- ↑ van Hooft JA, Vijverberg HP (2000). «5-HT3 receptors and neurotransmitter release in the CNS: a nerve ending story?». Trends Neurosci 23 (12): 605-610. PMID 11137150. doi:10.1016/S0166-2236(00)01662-3.
- ↑ a b c d e Rang, H. P. (2003). Pharmacology. Edinburgh: Churchill Livingstone. ISBN 0-443-07145-4., page 187.
- ↑ Gholipour T, Ghasemi M, Riazi K, Ghaffarpour M, Dehpour AR (January 2010). «Seizure susceptibility alteration through 5-HT(3) receptor: modulation by nitric oxide». Seizure 19 (1): 17-22. PMID 19942458. doi:10.1016/j.seizure.2009.10.006.
- ↑ Patel, Ryan; Dickenson, Anthony H. (September 2018). «Modality selective roles of pro-nociceptive spinal 5-HT2A and 5-HT3 receptors in normal and neuropathic states». Neuropharmacology 143: 29-37. ISSN 0028-3908. PMC 6277848. PMID 30240783. doi:10.1016/j.neuropharm.2018.09.028.
- ↑ Suzuki, Rie; Rahman, Wahida; Rygh, Lars J; Webber, Mark; Hunt, Stephen P; Dickenson, Anthony H (October 2005). «Spinal-supraspinal serotonergic circuits regulating neuropathic pain and its treatment with gabapentin». Pain 117 (3): 292-303. ISSN 0304-3959. PMID 16150546. doi:10.1016/j.pain.2005.06.015.
- ↑ Mineur YS, Picciotto MR (December 2010). «Nicotine receptors and depression: revisiting and revising the cholinergic hypothesis». Trends Pharmacol. Sci. 31 (12): 580-586. PMC 2991594. PMID 20965579. doi:10.1016/j.tips.2010.09.004.
- ↑ Imanishi, N.; Iwaoka, K.; Koshio, H.; Nagashima, S. Y.; Kazuta, K. I.; Ohta, M.; Sakamoto, S.; Ito, H. et al. (2003). «New thiazole derivatives as potent and selective 5-hydroxytriptamine 3 (5-HT3) receptor agonists for the treatment of constipation». Bioorganic & Medicinal Chemistry 11 (7): 1493-1502. PMID 12628674. doi:10.1016/S0968-0896(02)00557-6.
- ↑ Delagrange, Philippe; Emerit, M.Boris; Merahi, Nacera; Abraham, Christine; Morain, Philippe; Rault, Sylvain; Renard, Pierre; Pfeiffer, Bruno et al. (1996). «Interaction of S 21007 with 5-HT3 receptors. In vitro and in vivo characterization». European Journal of Pharmacology 316 (2–3): 195-203. ISSN 0014-2999. PMID 8982686. doi:10.1016/S0014-2999(96)00680-2.
- ↑ Ashoor, A.; Nordman, J.; Veltri, D.; Susan Yang, K. -H.; Shuba, Y.; Al Kury, L.; Sadek, B.; Howarth, F. C. et al. (2013). «Menthol Inhibits 5-Ht3 Receptor-Mediated Currents». Journal of Pharmacology and Experimental Therapeutics 347 (2): 398-409. PMID 23965380. doi:10.1124/jpet.113.203976.
- ↑ Newman, A. S.; Batis, N; Grafton, G; Caputo, F; Brady, C. A.; Lambert, J. J.; Peters, J. A.; Gordon, J et al. (2013). «5-Chloroindole: A potent allosteric modulator of the 5-HT3 receptor». British Journal of Pharmacology 169 (6): 1228-1238. PMC 3831704. PMID 23594147. doi:10.1111/bph.12213.
- ↑ Davies, Paul A (2011). «Allosteric modulation of the 5-HT3 receptor». Current Opinion in Pharmacology (Elsevier BV) 11 (1): 75-80. ISSN 1471-4892. PMC 3072441. doi:10.1016/j.coph.2011.01.010.
- ↑ a b c Solt, Ken; Stevens, Renna J.; Davies, Paul A.; Raines, Douglas E. (4 de agosto de 2005). «General Anesthetic-Induced Channel Gating Enhancement of 5-Hydroxytryptamine Type 3 Receptors Depends on Receptor Subunit Composition». Journal of Pharmacology and Experimental Therapeutics (American Society for Pharmacology & Experimental Therapeutics (ASPET)) 315 (2): 771-776. ISSN 0022-3565. doi:10.1124/jpet.105.090621.
- ↑ Thompson AJ, Lummis SC (2007). «The 5-HT3 receptor as a therapeutic target». Expert Opin Ther Targets 11 (4): 527-540. PMC 1994432. PMID 17373882. doi:10.1517/14728222.11.4.527.


 French
French Deutsch
Deutsch