Électron de valence — Wikipédia
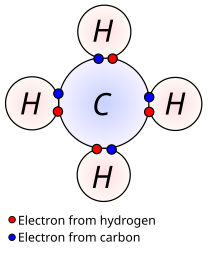
En chimie et en physique, les électrons de valence sont ceux situés dans la couche externe d'un atome, et qui peuvent participer à la formation d'une liaison chimique si cette couche extérieure n'est pas totalement remplie. Dans une liaison covalente chacun des atomes liés partage un électron de valence.
Les propriétés physiques d'un élément sont largement déterminées par leur configuration électronique, notamment la configuration de la couche de valence. La présence d'un ou plusieurs électrons de valence joue un rôle important dans cette définition des propriétés chimiques (en) car elle permet de déterminer la valence — c'est-à-dire la capacité de l'élément à se lier avec d'autres éléments pour former des molécules. Lorsqu'un atome a une couche de valence incomplète, il peut partager ou donner des électrons de valence avec d'autres atomes pour remplir sa couche externe et former une liaison chimique stable.
Le nombre d'électrons de valence d'un élément peut être déterminé à partir de sa position dans le tableau périodique. Les éléments situés dans la même colonne ont le même nombre d'électrons de valence, et les éléments ayant le même nombre d'électrons de valence ont tendance à avoir des propriétés chimiques similaires. Par exemple, tous les éléments du groupe des halogènes ont sept électrons de valence, ce qui leur permet de former une liaison covalente avec un atome d'hydrogène pour former une molécule diatomique, telle que HCl, HBr, HI, etc.
Ils sont impliqués dans de nombreux processus chimiques, tels que les réactions d'oxydoréduction et la formation de complexes chimiques et dans les réactions de transfert d'électron (en), qui jouent un rôle important dans la production d'énergie dans les cellules vivantes.
L'électron de valence est similaire à un électron de cœur, il a la capacité d'absorber ou de libérer de l'énergie sous forme de photon. Un gain d'énergie peut déclencher le déplacement (saut, transfert) de l'électron vers une couche externe, phénomène connu sous le nom d'excitation atomique. L'électron peut également se libérer de la couche associée de son atome, phénomène connu sous le nom d'ionisation, pour former un ion positif. Lorsqu'un électron perd de l'énergie (ce qui entraîne l'émission d'un photon), alors il peut se déplacer vers une couche interne qui n'est pas complètement occupée.
Références
[modifier | modifier le code]Notes
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Valence electron » (voir la liste des auteurs).
Références
[modifier | modifier le code]Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) Encyclopedia Britannica, The Editors of Encyclopaedia, (lire en ligne), valence electron
- (en) A Dictionary of Chemistry, Daintith, J., coll. « Oxford University Press », (ISBN 9780199204632 et 9780191726569, lire en ligne), valence electron
Liens externes
[modifier | modifier le code]- « Valence and core electrons », sur www.energyeducation.ca


 French
French Deutsch
Deutsch