Topicité — Wikipédia
En chimie, la topicité est la relation stéréochimique entre atomes ou groupements identiques (par exemple deux atomes H) relativement au reste de la structure dont ils font partie. Dépendant de cette relation, de tels groupes sont homotopes, énantiotopes, ou diastéréotopes. Ce concept permet, par exemple, de prévoir si les atomes concernés ont le même déplacement chimique en RMN, ou s'ils se comporteront de façon similaire vis-à-vis d'un réactif chiral.
Homotope
[modifier | modifier le code]Les groupements homotopes dans un composé chimique sont équivalents. Deux groupements A et B sont homotopes si la molécule reste la même (y inclus en ce qui concerne leur stéréochimie) quand ces groupements sont interchangés en gardant les autres parties de la molécule fixes. Deux atomes homotopes sont en tout temps identiques, en tout environnement. Les noyaux magnétiquement actifs auront le même déplacement chimique dans le spectre RMN. Par exemple, les quatre atomes d'hydrogène du méthane (CH4) sont homotopes, comme le sont les deux hydrogènes ou les deux chlores dans le dichlorométhane (CH2Cl2).
Énantiotope
[modifier | modifier le code]La désignation stéréochimique énantiotope fait référence à la relation entre deux groupements dans une molécule qui, si l'un ou l'autre était remplacé, créerait un centre chiral et donnerait donc un composé chiral. Les deux produits possibles de ce remplacement seraient des énantiomères.
Par exemple, les deux atomes d'hydrogène attachés au deuxième carbone dans le butane sont énantiotopes. Le remplacement de l'un d'eux (en bleu) par un atome de brome produira le (R)-2-bromobutane. Le remplacement de l'autre (en rouge) produira l'énantiomère, le (S)-2-bromobutane.
 | 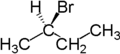 |  |
| Butane | (R)-2-bromobutane | (S)-2-bromobutane |
Les groupements énantiotopes sont identiques et indiscernables, sauf en milieux chiraux. Par exemple, les hydrogènes CH2 dans l'éthanol (CH3CH2OH) sont énantiotopes, mais deviennent différents (diastéréotopes) si l'éthanol est lié à un centre chiral, par exemple par conversion à un ester d'un acide carboxylique chiral, tel que l'acide lactique, ou s'il est coordonné à un centre métallique chiral, ou s'il est associé au site actif d'un enzyme, puisque les enzymes sont constitués d'acides aminés chiraux. En effet, en présence de l'enzyme ADH, un seul des hydrogènes CH2 de l'éthanol est enlevé lors de son oxydation à l'acétaldéhyde. Il n'y a nul besoin que le milieu chiral soit optiquement pure pour avoir cet effet.
Les groupements énantiotopes se miroitent d'un côté et de l'autre d'un plan de symétrie interne. Un milieu chiral détruit cette symétrie. S'ils sont énantiotopes, une paire de noyaux actifs en RMN seront aussi indiscernables par la RMN et produiront un seul signal.
Les groupements énantiotopes ne sont pas nécessairement attachés au même atome. Par exemple, les deux atomes d'hydrogène adjacent au groupement carbonyle dans le cis-2,6-diméthylecyclohexanone sont énantiotopes ; l'un est le miroir de l'autre avec le plan du miroir cisaillant la molécule au milieu et traversant le carbonyle, mais les déprotonations d'un côté et de l'autre du carbonyle créeront deux énantiomères. De la même manière, remplacement de l'un par un atome de deutérium créera l'énantiomère de la molécule où l'autre est plutôt remplacé.
Diastéréotope
[modifier | modifier le code]La désignation stéréochimique diastéréotope fait référence à la relation entre deux groupements dans une molécule qui, si l'un ou l'autre était remplacé, créerait des diastéréoisomères. Les groupements diastéréotopes sont souvent, mais pas toujours, des groupes identiques liés au même atome dans une molécule contenant au moins un centre chiral.
Par exemple, les deux atomes d'hydrogène du CH2 dans le (S)-2-bromobutane sont diastéréotopes. Remplacement d'un atome d'hydrogène (en bleu) par un atome de brome produira le (2S,3R)-2,3-dibromobutane. Remplacement de l'autre (en rouge) produira le diastéréomère (2S,3S)-2,3-dibromobutane.
 |  | 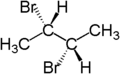 |
| (S)-2-bromobutane | (2S,3R)-2,3-dibromobutane | (2S,3S)-2,3-dibromobutane |
Dans une molécule chirale qui contient des groupements diastéréotopes, tel que le 2-bromobutane, il n'est pas nécessaire que la molécule soit énantiopure ; quelle que soit sa proportion, chaque énantiomère générera des paires énantiomériques de diastéréomères à la suite d'une substitution de l'un ou de l'autre groupe diastéréotope (bien que, dans le cas de la substitution par le brome des hydrogènes diastéréotopes du 2-bromobutane, l'isomère méso n'a, strictement parlant, pas d'énantiomère).
Les groupements diastéréotopes ne sont pas des images en miroir l'un de l'autre d'une part et d'autre d'aucun plan. Ils sont en tout temps différents, en tout environnement, mais pourraient ne pas être discernables. Par exemple, les deux paires d'hydrogènes CH2 dans l'hydrochlorure du phenylalaninate d'éthyle (PhCH2CH(NH3+)COOCH2CH3 Cl−) sont diastéréotopes et les deux groupes donnent une paire de signaux RMN du proton dans le DMSO-d6 à 300 MHz[1], mais, dans le cas du très semblable 2-nitrobutanoate d'éthyle (CH3CH2CH(NO2)COOCH2CH3), seul le CH2 près du centre chiral donne des signaux distincts provenant de ses deux hydrogènes avec le même instrument dans le CDCl3[2]. De tels signaux sont souvent compliqués à cause de déplacements chimiques peu différents, de chevauchement et à cause du nouveau couplage puissant entre hydrogènes géminaux. Par ailleurs, les deux groupements CH3 dans l'ipsénol, qui se trouvent séparés du centre chiral par trois liaisons chimiques, donnent en RMN du proton des doublets séparés et deux signaux en RMN du carbone dans le CDCl3 à 300 MHz[3], mais les signaux provenant des hydrogènes diastéréotopes de l'hydrochlorure de l'alaninate d'éthyle (CH3CH(NH3+)COOCH2CH3 Cl−), qui se trouvent aussi séparés par trois liaisons chimiques du centre chiral, sont à peine discernables[4].

Les groupements diastéréotopes peuvent aussi survenir dans des molécules achirales. Par exemple, l'une ou l'autre des paires d'hydrogènes CH2 dans le 3-pentanol (Figure 1) sont diastéréotopes, parce que les deux carbones CH2 sont énantiotopes. Substitution d'un des quatre hydrogènes CH2 crée deux centres chiraux à la même fois, et les deux produits de substitution des hydrogènes d'un des groupements CH2 seront des diastéréomères. Cette sorte de relation est souvent plus facile à voir dans les molécules cycliques. Par exemple, chaque paire d'hydrogènes CH2 dans le cyclopentanol (Figure 1) sont diastéréotopes de la même manière, et ceci est facilement discernable car l'un de ces hydrogènes sera cis au groupement OH (sur la même face du cycle) tandis que l'autre sera trans (sur la face opposée).
La désignation diastéréotope s'applique aussi aux groupes identiques attachés au même bout d'un groupement alcène qui, si remplacés, donneraient des isomères géometriques (qui sont aussi classifiés diastéréomères). Donc, les hydrogènes du CH2 du propène sont diastéréotopes, l'un étant cis au CH3, et l'autre étant trans, et un remplacement de l'un ou de l'autre par un CH3 donnerait le cis- ou le trans--2-butène.

La diastéréotopicité n'est pas limitée aux molécules organiques, ni aux groupements attachés au carbone, ni aux molécules aux centres chiraux tétrahédriques (hybride sp3): par exemple, les paires d'hydrogènes de n'importe lequel des groupements CH2 ou NH2 dans l'ion tris(éthylènediamine)chrome(III) (Cr(en)33+), où le centre métallique est chiral, sont diastéréotopes (Figure 2).
Les termes énantiotope et diastéréotope sont aussi utilisés pour désigner les faces de groupements planaires (surtout les groupements carbonyle et alcène). Voir l'article en anglais sur les règles de priorité Cahn-Ingold-Prelog.
Articles connexes
[modifier | modifier le code]Références
[modifier | modifier le code]- Spectre RMN du proton de l'hydrochlorure du phenylalaninate d'éthyle à 300 MHz dans le DMSO-d6, de Sigma-Aldrich Co.
- Spèctre RMN du proton du 2-nitrobutanoate d'éthyle à 300 MHz dans le CDCl3, de Sigma-Aldrich Co.
- Silverstein, R. et al.: Spectrometric Identification of Organic Compounds, 7th ed., John Wiley & Sons, 2005
- Spèctre RMN du proton de l'hydrochlorure de l'alaninate d'éthyle à 300 MHz dans le DMSO-d6, de Sigma-Aldrich Co.


 French
French Deutsch
Deutsch