Prochiralité — Wikipédia
En chimie, les molécules prochirales sont des molécules achirales qui peuvent être converties en molécules chirales dans une seule étape[1].
Deux groupements identiques (énantiotopes ou diastéréotopes) attachés à un atome hybridé sp3 sont distingués par les désignations pro-R et pro-S. Si le groupement pro-R est, par substitution, promu à une priorité plus élevée que l'autre groupement selon les règles de Cahn-Ingold-Prelog (sans toutefois changer l'ordre de priorité des autres substituants), un nouveau centre chiral résultera avec chiralité R, et vice versa.
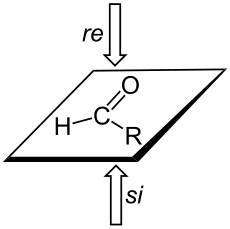
Les faces prochirales d'un atome trigonal planaire (hybride sp2) peuvent donner un centre chiral par réaction d'addition sur l'une ou l'autre des faces. Un alcène peut ainsi générer deux centres chiraux par addition. Chaque face de l'atome est désignée re ou si, selon que les trois atomes ou groupements attachés, vu depuis cette face, sont disposés en ordre de priorité Cahn-Ingold-Prelog décroissant dans le sens de la montre (re) ou dans le sens contraire (si), mais la désignation de la chiralité résultante (R ou S) dépendra de la priorité accordée au groupement ajouté.
Notes et références
[modifier | modifier le code]- John McMurry, Organic Chemistry, Brooks/Cole, 6e éd., p. 301–303
Voir aussi
[modifier | modifier le code]Lien externe
[modifier | modifier le code]- (en) « prochirality », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)


 French
French Deutsch
Deutsch