Acide azothydrique — Wikipédia
| Acide azothydrique | |
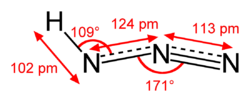 Dimensions et géométrie de la molécule  Représentation de Lewis de l'acide azothydrique  Structure tridimensionnelle. | |
| Identification | |
|---|---|
| Nom UICPA | acide azothydrique |
| Synonymes | azoture d'hydrogène |
| No CAS | |
| No ECHA | 100.029.059 |
| No CE | 231-965-8 |
| PubChem | 22937 |
| SMILES | |
| Apparence | liquide incolore[1] |
| Propriétés chimiques | |
| Formule | HN3 [Isomères] |
| Masse molaire[3] | 43,028 ± 0,000 7 g/mol H 2,34 %, N 97,66 %, |
| pKa | 4.6 à 4.7 |
| Moment dipolaire | 1,70 ± 0,09 D |
| Propriétés physiques | |
| T° fusion | −80 °C[1] |
| T° ébullition | 35,7 °C[1] |
| Masse volumique | 1,09 g·cm-3 (25 °C)[1] |
| Thermochimie | |
| ΔvapH° | 30,5 kJ·mol-1 (1 atm, 35,7 °C)[4] |
| Précautions | |
| SIMDUT[5] | |
Produit non classé | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
L'acide azothydrique, ou azoture d'hydrogène, est un composé chimique de formule brute HN3. C'est un monoacide faible de pK = 4,72, dont la base conjuguée est l'ion azoture N3−, distinct de l'ion nitrure N3−.
Description
[modifier | modifier le code]
C'est un hydracide. On le désigne également par les noms d'acide hydrazoïque et d'azoture d'hydrogène. Le nom d'azoture d'hydrogène désigne en principe le corps pur (HN3 gazeux), alors que celui d'acide azothydrique ou hydrazoïque désigne plutôt la solution aqueuse. Malgré la ressemblance de formule avec l'ammoniac et l'hydrazine, l'acide azothydrique n'a de parenté structurale avec ces composés de l'azote.
C'est un réducteur très puissant, ainsi que le montre le diagramme de Frost de l'azote ci-contre. Il est instable, très explosif.
Il est synthétisé par action de l'acide nitreux HNO2 sur l'hydrazine N2H4 en milieu acide[6] :
ou encore par action du trichlorure d'azote NCl3 ou du chlorure de nitrosyle NOCl sur l'hydrazine N2H4, voire enfin par réaction d'un azoture avec un acide.
Toxicité
[modifier | modifier le code]Des travailleurs exposés à 0,5 ppm d’acide azothydrique ont présenté des céphalées et une congestion nasale. D’autres symptômes, tels qu’une faiblesse et une irritation oculaire et nasale, ont pu être observés par suite d’une exposition à 3 ppm pendant moins d’une heure. La fréquence du pouls était variable et la tension artérielle basse ou normale. Des symptômes similaires ont été rapportés parmi des travailleurs employés à la production de l’azoture de plomb. Ils ont présenté une nette hypotension, qui s’est accentuée au cours de la journée de travail et qui est revenue à la normale après qu’ils ont quitté leur poste.
L’exposition de rongeurs à des vapeurs d’acide azothydrique provoque une inflammation pulmonaire aiguë. Les vapeurs de cet acide sont environ huit fois moins toxiques que celles du cyanure d’hydrogène, une concentration de 1 024 ppm étant mortelle pour la souris après 60 minutes (contre 135 ppm pour le cyanure d’hydrogène)[7].
Références
[modifier | modifier le code]- Entrée « Hydrazoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 mars 2009 (JavaScript nécessaire)
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- ↑ « Acide hydrazoïque » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Cotton A. F. & Wilkinson G. (1972). Advanced Inorganic Chemistry, a comprehensive text. 3e édition, Interscience publishers, John Wiley & Sons. p. 353.
- ↑ Encyclopédie de sécurité et de santé au travail http://www.ilo.org/public/french/protection/safework/cis/products/encyclo/pdf/vol4/4104chff.pdf


 French
French Deutsch
Deutsch