Bulbe olfactif — Wikipédia
| Nom latin | Bulbus olfactorius |
|---|---|
| MeSH | D009830 |
| TA98 | A14.1.09.429 |
| TA2 | 5538 |
| FMA | 77624 |
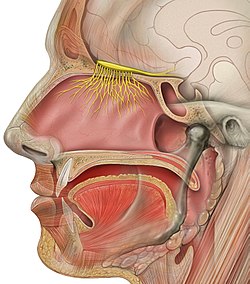
Le bulbe olfactif (BO), parfois appelé lobe olfactif, est une région du cerveau des vertébrés dont la fonction principale est de traiter les informations olfactives en provenance des neurones chémorécepteurs olfactifs. C'est une structure paire – il y a deux bulbes olfactifs – légèrement détachée du reste du cerveau et la plus proche de la cavité nasale.
Le bulbe olfactif est la première région du système nerveux central à traiter l'information olfactive. Il reçoit l'information olfactive en provenance de l'épithélium olfactif qui est la structure de réception des odeurs. Le bulbe olfactif effectue un traitement et un codage de l'information avant de l'envoyer vers les structures supérieures du cerveau. Les neurones principaux du bulbe olfactif sont les cellules mitrales qui reçoivent l'information directement des récepteurs olfactifs ; après intégration, elles l'envoient via leurs axones aux autres régions du cerveau via le pédoncule olfactif.
Chez de nombreux vertébrés, le bulbe olfactif est la structure cérébrale la plus rostrale (en avant). Chez l'espèce humaine, en revanche, le bulbe olfactif est situé dans la partie inférieure du cerveau, juste au-dessus de la lame criblée de l'os ethmoïde (région osseuse dont les perforations laissent passer les rameaux du nerf olfactif), directement en relation avec l'épithélium olfactif, en contact avec l'air inspiré, de l'autre côté de la lame criblée.
Contrairement à ce qui se passe chez les rongeurs (neurogenèse adulte), les cellules nerveuses du bulbe olfactif humain ne se renouvellent pas ou très peu chez l'adulte : moins de 1 % en 100 ans[1],[2],[3].
Organisation anatomique
[modifier | modifier le code]
Le bulbe olfactif est constitué d'un paléocortex laminaire, c'est-à-dire un cortex où les corps cellulaires des neurones sont organisés en trois couches superposées, contrairement aux six couches du néocortex. Cette organisation témoigne de l'origine ancienne, sur le plan phylogénique, du cortex olfactif.
De l'extérieur vers l'intérieur, les différentes couches concentriques et constitutives du bulbe olfactif sont :
- la couche des nerfs
- la couche glomérulaire
- la couche plexiforme externe
- la couche des cellules mitrales
- la couche plexiforme interne
- la couche des cellules granulaires
La couche des nerfs
[modifier | modifier le code]Il s'agit de la couche la plus périphérique des bulbes olfactifs. Les bulbes olfactifs reçoivent les fins filets nerveux (ensembles d'axones) en provenance de l'épithélium olfactif qui propagent donc l'information sur les odeurs captée au niveau de chimiorécepteurs. Ces fibres, dont la distribution respecte la topographie de l'épithélium, pénètrent dans quelques milliers de glomérules olfactifs. Dans cette couche se situe également une population gliale particulière car spécifique au bulbe olfactif.
La couche glomérulaire
[modifier | modifier le code]Les terminaisons axonales des neurones récepteurs olfactifs convergent ainsi vers chacun de ces amas glomérulaires de 150 à 250 μm, délimités par une capsule gliale, et formés uniquement par des milliers de synapses groupées autour de 2 à 5 dendrites apicales de gros neurones, appelés cellules mitrales, dont les corps cellulaires sont placés 200-300 micromètres au-dessous (dans la couche des cellules mitrales).
Le glomérule
[modifier | modifier le code]Le glomérule est une structure sphérique de 150 à 250 µm de diamètre. Elle est située dans la périphérie des BOs et en constitue une couche spécifique. Chez le rongeur (souris, rat), on compte en moyenne 1 800 glomérules au sein d'un BO. Il s'agit d'une structure conservée à travers l'évolution des espèces et dévolue au traitement de l'information olfactive. C'est dans ces glomérules que les axones des neurones récepteurs olfactifs font synapses avec les dendrites apicales des cellules mitrales, cellules principales du BO. La périphérie des glomérules est constituée d'interneurones particuliers appelés cellules périglomérulaires. Ces cellules interviennent lors du traitement de l'information olfactive, elles modulent la transmission de l'information entre les neurones récepteurs olfactifs et les cellules mitrales.
Une particularité du contenu intraglomérulaire est le fait qu'on y rencontre une partie des terminaisons nerveuses en cours de dégénérescence, une autre partie de fibres est en cours de repousse et le reste, dans une proportion qui dépend des situations olfactives antérieures est en état opérationnel. Ainsi, même si on détruit totalement le neuroépithélium par le tétroxyde d'osmium, les glomérules se vident partiellement de leurs synapses mais d'autres repoussent pour les remplacer. Les neurones périglomérulaires et la névroglie occupent l'espace. Mais en moins de 8 jours, les synapses ont repoussé et reconstituent le potentiel d'identification des odeurs antérieur, sauf si on stimule pendant cette période en se servant de nouvelles odeurs. Dans ce cas, la mémoire juste antérieure à la destruction du neuroépithélium se restructure. En ce sens, le bulbe olfactif contient potentiellement beaucoup d'informations sur la formidable plasticité du tissu nerveux, une partie des cellules du BO (les cellules granulaires et périglomérulaires) sont en effet la cible d'un renouvellement permanent via le processus de neurogenèse à l'âge adulte. Ces cellules sont renouvelées à partir d'une niche de cellules progénitrices située dans la zone sous-ventriculaire.
Les voies olfactives
[modifier | modifier le code]Les axones qui sortent des cellules mitrales se rendent en partie au bulbe opposé et en partie vers le noyau olfactif antérieur. Les fibres ré-émises vont au cortex olfactif, vers le cortex limbique, vers l'hippocampe ou les corps mamillaires. On comprend ainsi le rôle inconscient de l'olfaction dans beaucoup de comportements fondamentaux dépendants de l'hypothalamus et du système limbique (sexualité, faim, sociabilité...). Les voies olfactives sont les seules voies à ne pas faire relai d'abord dans le thalamus. Mais des informations traitées dans le cortex olfactif entrent dans le thalamus antérieur, de sorte que nous avons souvent une mémoire associative des odeurs plutôt qu'une mémoire absolue. L'anecdote rapportée par Proust pour qui des madeleines rappelaient des souvenirs d'enfance précis est une illustration de l'importance des liens cognitifs à la mémoire olfactive.
Bulbe olfactif accessoire
[modifier | modifier le code]Le bulbe olfactif accessoire est une structure distincte, qui se situe dans la région dorsale-postérieure du bulbe olfactif, notamment chez les macrosmates (ex. : rat). Il forme un système sensoriel parallèle et indépendant du traitement des odeurs par le bulbe olfactif. C'est en effet la seconde structure de traitement du système olfactif accessoire. Il reçoit des informations de l'organe voméronasal, un épithélium particulier de la cavité nasale, chargé de détecter notamment les phéromones, entre autres stimuli chimiques. Comme le bulbe olfactif principal, il contient des glomérules où les récepteurs forment des synapses avec les cellules mitrales. Par contre, les cellules mitrales du bulbe olfactif accessoire projettent leurs axones vers l'amygdale et l'hypothalamus et non vers le cortex. Le système olfactif accessoire est impliqué dans les comportements d'agression et d'accouplement.
Cette structure n'est pas présente chez l'Homme adulte, même si le bulbe olfactif principal peut également jouer ce rôle. Diverses expériences montrent ainsi des capacités de reconnaissance olfactives mère-enfants chez l'Homme, ou encore des influences sur le choix d'un partenaire chez la femme, qui peuvent être assimilées à la présence d'un système olfactif accessoire. Néanmoins, certaines structures présentes pendant l'embryogenèse disparaissent, ou se retrouvent intégrées, dans le bulbe. Pourtant, on parle de bulbe olfactif accessoire et de complexe glomérulaire modifié (dans le bulbe, c'est une dizaine de très gros glomérules), des structures qui permettent au nouveau-né de reconnaître sa mère parmi les autres individus du groupe. On pense aussi que l'organe voméronasal, quelques cellules olfactives placées dans la cloison nasale, sont présentes peu avant la naissance du bébé humain. Ainsi, s'il n'est plus visible, il laisse des traces d'une calbindine spécifique du système primitif identifiables plusieurs mois après la naissance.
Pathologies
[modifier | modifier le code]Du fait de leur position profonde, il y a peu d'images montrant des anomalies bulbaires relatives à des neuropathies. Pourtant, certaines pathologies décrivent une diminution de taille du bulbe, voire son absence :
- le syndrome de Kallmann (dysplasie olfacto-génitale) dans lequel l'altération du gène KAL1 qui produit une protéine, l'anosmine, impliquée dans la formation du système olfactif, peut induire une agenèse du bulbe.
- l'holoproencéphalie, problème de séparation des hémisphères cérébraux, selon son degré de sévérité et la microcéphalie et la septodysplasie, une forme moins sévère d'holoprosencéphalie, sont souvent accompagnées de l'absence de bulbe olfactif.
La dégénérescence bulbaire : elle est décrite dans diverses maladies neurodégénératives telle Alzheimer, Parkinson, mais aussi dans divers troubles neuropsychiatriques dans lesquels certaines analyses montrent une régression bulbaire. Il apparaît en particulier que des troubles olfactifs chroniques, des hallucinations olfactives peuvent être associés à des altérations neurologiques aussi variées que l'épilepsie ou la maladie de Parkinson.
Bulbe olfactif et rythme circadien des corticoïdes
[modifier | modifier le code]Le rythme circadien est un système chrono-biologique endogène synchronisant les fonctions physiologiques et les adaptant aux variations de lumière durant la journée. Le rythme circadien génère notamment des pics hormonaux à différents moments de la journée, mélatonine la nuit et cortisol le matin. Ce système peut se re-synchroniser en utilisant les variations lumineuses captées au niveau de cellules spécialisées de l’œil se projetant sur une structure spécialisée de l'hypothalamus, le noyau suprachiasmatique, centre de contrôle du rythme circadien. On a ainsi pu observer qu'une ablation des nerfs optiques conduisait à des modifications de ces variations hormonales.
En cherchant d'autres structures cérébrales pouvant modifier ces rythmes hormonaux circadiens, une équipe de recherche italienne a montré, en , que l'ablation des bulbes olfactifs chez le chien produisait, un mois après l'opération, une altération temporaire du rythme circadien des corticoïdes plasmatiques. Les rythmes étaient ainsi inversés avec un maximum à 20 h au lieu de 08 h et un minimum à 08 h au lieu de 20 h. Cette altération du rythme adrénocorticale n'a cependant pas perduré ; après 2 mois le rythme normal était rétabli[4]. Les auteurs de conclure que la perte du synchroniseur externe que constitue les stimuli olfactifs pourrait expliquer cette inversion mais que plus probablement, la perte d'un sens aussi fondamental pour un organisme macrosmique comme le chien pouvait conduire aux troubles fonctionnels du système neurovégétatif qui étaient observés.
Odorat sans bulbe olfactif
[modifier | modifier le code]Une équipe israélienne de l’Institut Weizmann des Sciences de Rehovot rapporte dans Neuron avoir identifié deux femmes (gauchères et possédant une jumelle) dotées d’un sens de l’odorat normal alors qu’elles sont dépourvues de bulbe olfactif. Les chercheurs présentent plusieurs interprétations qui pourraient expliquer ce phénomène mais sans certitude, restent perplexes[5],[6].
Notes et références
[modifier | modifier le code]- ↑ (en) Ernst A et Frisén J., « Adult neurogenesis in humans- common and unique traits in mammals. », PLoS Biol., vol. 13, no 1, , e1002045 (PMID 25621867, PMCID PMC4306487, DOI 10.1371/journal.pbio.1002045, lire en ligne [PDF], consulté le )
- ↑ (en) Bergmann O, Liebl J, Bernard S, Alkass K, Yeung MS, Steier P, Kutschera W, Johnson L, Landén M, Druid H, Spalding KL et Frisén J., « The age of olfactory bulb neurons in humans », Neuron, vol. 74, no 4, , p. 634-639 (PMID 22632721, DOI 10.1016/j.neuron.2012.03.030, lire en ligne [PDF], consulté le )
- ↑ « Les cellules nerveuses du bulbe olfactif ne se renouvellent pas »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- ↑ (en) P. Arcangeli, V. Digiesi, G. Madeddu et R. Toccafondi, « Temporary displacement of plasma corticoid circadian peak induced by ablation of olfactory bulbs in dog », Experientia, vol. 29, no 3, , p. 358–359 (ISSN 0014-4754 et 1420-9071, PMID 4708731, DOI 10.1007/BF01926530, lire en ligne, consulté le )
- ↑ (en) Weiss T, Soroka T, Gorodisky L, Shushan S, Snitz K, Weissgross R, Furman-Haran E, Dhollander T et Sobel N., « Human Olfaction without Apparent Olfactory Bulbs. », Neuron, vol. 105, no 1, , p. 35-45 (PMID 31706696, PMCID PMC6953431, DOI 10.1016/j.neuron.2019.10.006, lire en ligne [PDF], consulté le )
- ↑ Marc Gozlan, « Un odorat normal… en l’absence de bulbe olfactif », sur Réalités Biomédicales, (consulté le )
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) Gordon M. Shepherd (editor), The Synaptic Organization of the Brain, New York, Oxford University Press, , 4e éd., 638 p. (ISBN 978-0-19-511824-7), chap. 5 (« Olfactory bulb »), p. 159-203.
Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- Site du Centre de Recherche en Neurosciences de Lyon : Équipe CMO - Codage et Mémoire Olfactive et NEUROPOP - Neuroplasticité & Neuropathologie de la Perception Olfactive


 French
French Deutsch
Deutsch