Compartiment sous-fluvial — Wikipédia
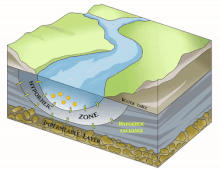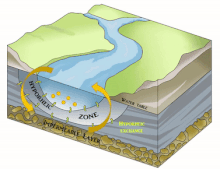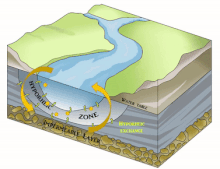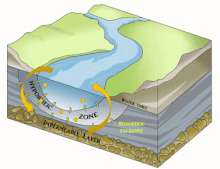
Dans le domaine de l'hydrographie, de l'hydrobiologie, de l'hydroécologie et de l'écologie souterraine, la notion de Compartiment sous-fluvial désigne le compartiment du fleuve (ou de la rivière) qui est invisible mais présent dans l'épaisseur du substrat sous-jacent ou adjacent quand celui-ci est poreux (volume sédimentaire) ou karstique et constitue un habitat permanent ou intermittent pour des espèces (appartenant à la stygofaune, qui comprend aussi la faune des interstices des fonds sous-marins) et biocénoses aquatiques (bactériennes à composantes invertébrées ou vertébrées plus complexes et évoluées).
Il est en grande partie constitué du milieu hyporhéique (sous le courant et à faible courant), qui est le milieu existant dans les interstices d'un sédiment ou substrat saturé en eau. On parle aussi des « eaux épigées »[1].
L'écologie souterraine a ainsi ajouté une dimension verticale sous le niveau du sol aux « hydrosystèmes fluviaux » ; le compartiment sous-fluvial est maintenant aussi considéré comme un véritable corridor biologique[2] souterrain, fonctionnellement et hydrologiquement couplé au fleuve, mais évoluant à un autre rythme[3] (on parle aussi de trame bleue en France et Belgique).
La science qui traite de ces milieux est la « Stygologie », en référence au Styx, la rivière qui traverse les enfers dans la mythologie grecque. Ce mot a été créé par l’hydrobiologiste Husmann en 1971 avant d'être diffusé à partir de 1985 par les Éditions E.J. Brill[4].
Une revue spécialisée Stygologia traite de ces milieux et des espèces que les scientifiques y trouvent et décrivent[5].
Enjeux
[modifier | modifier le code]Ce compartiment est constitué d'une masse d'eau en mouvement lent. Il est très discret mais volumiquement souvent bien plus important que le fleuve (sous un fleuve mode mais s'écoulant sur une zone alluviale perméable, il peut se mesurer en kilomètres cubes. Il contribue à la dynamique fluviale (parfois de manière importante en situation d'étiage). Et il peut, dans les interstices des sédiments ou dans des « vides » plus importants, abriter des écosystèmes et biocénoses encore mal inventoriés et mal compris dans certaines zones du monde, mais qui semblent importants en termes de biodiversité[6], à laquelle vient s'ajouter celle de biocénoses plus profondes (plus de 5 000 espèces étaient déjà répertoriées vers 1985, dans un ouvrage intitulé Stygofauna mundi[7],[8] et de services écosystémiques.
Certaines espèces du compartiment sous-fluvial pourrait peut-être être utilisées comme Bioindicateurs de l'état des nappes sous-jacentes ou connexes aux fleuves et rivières[9], y compris en système karstique[10].
Le compartiment sous-fluvial est fonctionnellement[11] lié au fleuve et à une grande partie (tout ce qui n'est pas nappe perchée) l'eau de la plaine alluviale et il joue a priori un rôle de zone tampon important en termes d'inertie thermique du fleuve (très important dans les régions chaudes).
Il joue aussi parfois un rôle régulateur (ou plus rarement aggravant) des inondations et sécheresses.
Il peut compliquer la gestion locale de certaines pollutions accidentelles ou chroniques, car il augmente parfois l'inertie en cas de pollution sous-jacente du fleuve par des contaminants photodégradables, ou pas ou peu dégradables (POPs par exemple) ou non-biodégradables (plomb, mercure, cadmium, radionucléides...) ; Un polluant qui serait rapidement emporté en mer sur un fonds totalement imperméable pourrait au contraire persister des décennies à plusieurs siècles ou millénaires dans le compartiment sous-jacent, ce qui peut nuire à l'alimentation en eau potable ou d'un autre point de vue peut être perçu comme contribuant à un risque moindre de pollution (plus ou moins différée dans l'espace et le temps) de la mer.
Via l'activité des bactéries (dénitrification...) des phénomènes importants d'épuration de l'eau (ou de pollution le cas échéant) s'y déroulent, notamment pour des polluants très solubles et mobiles tels que les nitrates. pour Janine Gibert, Pierre Marmonier, Marie-José Dole-Olivier, la biodiversité souterraine propre à ces milieux et à leurs interfaces (écotones) « joue un rôle de régulateur intervenant aussi sur le fonctionnement énergétique des grands fleuves et sur la qualité de la ressource en eau. Les recherches actuelles s'intéressent de plus en plus aux processus se déroulant à l'interface entre eau de surface et eau souterraine. Le rôle de cette interface dans la décomposition de la matière organique circulant dans les cours d'eau ou dans la protection des aquifères est encore à découvrir. De même en va-t-il du rôle des peuplements microbiens qui se développent à la surface des graviers et contribuent à l'immobilisation des polluants (par insolubilisation et bioprécipitation des métaux lourds) et à la protection des réserves d'eau potable pour les générations futures »[3].
Les grands barrages artificiels, dérivations ou création de certains canaux, les pompages d'eau douce (surtout avec rabattement de nappe), les drainages, l'irrigation, le colmatage des lits consécutif à une augmentation de la turbidité ou à la disparition d'espèce jouant un rôle de décolmatage (lamproies par exemple quand elles construisent leurs nids) peuvent bouleverser l'écosystème d'un compartiment sous-fluvial. La disparition ou au contraire le retour d'espèces telle que le Castor, là où peut faire des barrages pourrait également profondément affecter le compartiment sous fluvial.
Ces derniers sont généralement pas ou mal pris en compte, y compris dans les études d'impacts et mesures compensatoires
Description du milieu
[modifier | modifier le code]Éléments physiques
[modifier | modifier le code]Selon les cas, périodes et lieux, ce compartiment sous-fluvial mesure de quelques décimètres dépaisseur à près d'une centaine de mètres de profondeur[3]. Il peut subir d'importantes variations géographiques et temporelles liées aux processus géomorphologiques actifs durant la vie du fleuve.
Il est principalement généralement constitué d'aquifères poreux (macroporosité) où l'eau circule, par exemple dans les lits de galets, graviers, sables, silex ou même argiles délitées, dès que des interstices permettent la circulation d'une nappe d'eau souterraine qui pourra réalimenter le fleuve en aval, rester souterraine ou aboutir en mer sous le niveau de la marée basse parfois.
Ces nappes sous-jacentes suivent généralement la direction du fleuve, par écoulement gravitaire, de manière générale, beaucoup plus lentement (ex : Vers Miribel en amont de Lyon, le Rhône a un débit de 1 m/s, soit un débit moyen de 500 m3/s, alors que sa nappe sous-jacente ne le suit qu'à une vitesse de quelques millimètres par seconde (débit moyen : 470 m3/h. L'eau est notamment freinée par les phénomènes de capillarité[3].
Ce compartiment sous-fluvial s'écoule de manière non-uniforme dans un milieu souvent très hétérogène, selon les obstacles qu'il rencontre liés à la complexité de la structure de l'aquifère généralement composé d'alternance de couches hétérogènes plus ou moins épaisses et poreuses.
Lien hydrauliques et connectivité écopaysagère entre compartiment sous-jacent et fleuve
[modifier | modifier le code]Il est plus ou moins fort ou ténu[12], régie par la loi de Darcy, elle-même liée à la porosité du substrat et à d'autres paramètres tels que la distance horizontale et la profondeur de la nappe par rapport à « son » fleuve.
L'épaisseur de chacune des deux masses d'eau dans chacun de ces deux milieux joue un rôle important dans cette relation. Plus la hauteur d'eau d'un fleuve est importante, plus - à substrat égal - il alimente la nappe (quand c'est le fleuve qui alimente la nappe et pas le contraire).
La pente du fleuve en accélère le débit (sauf présence de barrages)
Deux phénomènes contradictoires sont souvent en jeu, et susceptibles de s'inverser selon les saisons ou années[3] :
- un drainage de la nappe vers le fleuve,
- un drainage du fleuve par la nappe.
L'hétérogénéité structurale du plafond de l'aquifère sous-jacent varie aussi dans le temps, au rythme des crues et - là où le lit mineur peut encore « errer » dans son lit majeur - en créant de nouvelles tresses ou méandres et en abandonnant des chenaux secondaires.
La canalisation et l'artificialisation des cours d'eau a probablement beaucoup modifié la qualité et le fonctionnement des nappes sous-jacente.
Dans les cas où la masse d'eau est très volumineuse et profonde, des mouvements différentiés de masse d'eau et des effets d'endo-upwelling et d'Upwelling peuvent apparaitre et expliquer certaines variations d'abondance ou des changements dans les espèces[13].
Corridors biologiques liquides et souterrains
[modifier | modifier le code]Sous la trame bleue visible au sol et de satellite, un autre fleuve (compartiment sous-jacent) coule souvent, plus profond, bien plus large et plus lent et constituant une mosaïque d'habitats différents, formant un autre corridor biologique, invisible sauf pour les spéléologues parfois, réellement fonctionnels et vitaux pour des espèces souvent récemment découvertes. Stanford et Ward, en 1993 proposait déjà - dans une perspective écosystémique - de les considérer comme corridors biologiques. Ils pourraient donc être considérés en Europe et France respectivement comme éléments du réseau écologique paneuropéen et de la trame bleue[2] et donc à prendre en compte dans le cadre de la directive cadre sur l'eau (bon état écologique à conserver ou retrouver en 2015) et dans les études d'impacts et mesures compensatoires[3]. Ce corridor aquatique souterrain est souvent connecté aux milieux annexes et connexes du fleuve, et il contribue à les garder en relation (hydraulique) via le plafond de la nappe et son niveau piézométrique. Il s'étend souvent sous tout le lit majeur, voire sous la totalité de la plaine alluviale, toujours en contact avec les milieux de surface (zones humides notamment, de manière directe et forte (sources quand il ne s'agit pas de puits artésiens) ou diffuse (percolation presque horizontale via les berges), contribuant à atténuer les chocs dans le milieu (effet tampon, dont en termes de microclimat) et à enrichir la richesse et diversité écosystémique de la plaine alluviale[3].
Stygofaune
[modifier | modifier le code]Biodiversité des corridors sous-fluviaux
[modifier | modifier le code]Elle recoupe en partie celle des cavernes souterraines, mais est encore mal connue.
Elle semble notamment contrôlée par de multiples facteurs, dont la teneur en oxygène et la température de l'eau, son pH, les processus biogéochimiques encore mal compris de la zone hyporhéique (oxydoréduction, méthylation, biodégradation, etc.) pour partie dépendants de la charge des eaux souterraines en solutés biodisponibles (nutriments ou toxiques), lesquels dopent ou modèrent la production biologique.
Les biofilms bactériens et près de la surface les mycéliums liés aux racines profondes d'arbres ou autres végétaux ou encore des apports directs en plancton et organismes benthiques venant de la surface semblent aussi jouer un rôle.
Dès le début des années 1990, Stanford et Ward supposent[2] que comme dans le véritable fleuve, il existe dans ce corridor souterrain une zonation des communautés souterraines, de l'amont vers l'aval, qui pourraient être à l'avenir mieux comprises, voire prévisibles au vu de ce qu'on connait de la surface et des processus géomorphologiques. Stanford et Ward pensent qu'il existe aussi dans ce corridor d'autres propriétés liées à des convergences entre aquifère et cours d'eau, tout au long du couloir souterrain, de la source à l'[2]. Ils estiment que la signification écopaysagère de ces corridors, ainsi que la connectivité des processus le long du corridor hyporhéique doivent être mieux compris si l'on veut correctement protéger et restaurer les écosystèmes fluviaux, en particulier ceux qui sont situés dans les grandes plaines inondables[2].
Les écologues distingue deux troupes d'espèces[2] ;
- les espèces de surface (hypogées) qui n'effectuent qu'une partie de leur cycle de vie en profondeur ; l'amphibionte
- les espèces qui ne peuvent vivre qu'en profondeur (endogés « obligatoires ») dans les eaux souterraines ; le stygobionte. quand il s'agit de formes adaptées d'espèces de surfaces ces formes sont dites « stygobies ».
Spécificité des espèces « stygobies »
[modifier | modifier le code]En général[3] :
- Elles sont petites (moins de 1 cm de long, voire moins de un millimètre, en général).
- Elles sont adaptées à l'absence de lumière (dépigmentation, œil embryonnaire ou caché). Par exemple, les Niphargus (crustacés amphipodes) sont blancs, dépourvus d'yeux et même de nerf optique, mais ils sont dotés de soies et appendices tactiles ou sensoriels surdéveloppés (ex. : antennes très allongées).
- Celles vivant dans les substrats sableux sont plus fusilignes ou ermiformes que ne le sont les espèces homologues de surface, probablement par sélection naturelle et convergence évolutive ; seule cette forme facilitant la circulation entre les galets, cailloux, grains de sable. Ceci vaut pour des espèces de taille micrométrique telles que protozoaires ciliés, comme pour des espèces plus grosses d'annélides oligochètes, de crustacés Microparasellides (ex. : Microcharon), Syncarides (ex. : Bathynella) ou Harpacticoïdes (ex. : Parastenocaris) toutes longilignes.
- Leur métabolisme est ralenti.
- Leurs déplacements sont lents, ce qui compense probablement le manque d'oxygène et de nutriments, même si certains prédateurs sont capables de sauts ou détentes rapides.
- Leur durée de vie est bien plus longue que celle de leurs homologues de surface (à tous les stades de développement).
- Leurs besoins alimentaires sont réduits : par exemple, les niphargus peuvent se passer de nourriture durant quatre mois et se contenter de très peu d'oxygène grâce à un métabolisme adapté la fermentation du glycogène est couplée à celle des acides aminés permettant au niphargus de synthétiser l'ATP (adénosine triphosphate) même en l'absence d'oxygène[14].
- Bien qu'aveugles, toutes ces espèces sont lucifuges ; ils captent la lumière par des organes internes ou capteurs. Via les modifications saisonnières de qualité de l'eau, leur chronobiologie reste annuelle et saisonnière (pour les espèces plus complexes que les bactéries et vers simples).
- Le réflexe de thigmotactisme est fréquent (les animaux se collent fortement aux parois ou aux grains de sédiments).
- Elles vivent au sein de communautés interstitielles réparties selon un gradient vertical, avec changement spatial et temporel d'espèces, de nombre total d'espèces et de nombre d'individus par espèce, selon la profondeur et la stabilité du milieu. Par exemple, sous la surface, dans son domaine alluvial du Rhône, les espèces stygobies sont d'autant plus nombreuses qu'on s'éloigne du chenal principal du fleuve et des zones de crues fréquentes. Elles sont aussi alors également plus proches de la surface (parfois trouvées à 50 centimètres sous la surface des sédiments, par exemple pour Microcharon reginae ou Salentinella juberthiae alors qu'à proximité du chenal principal du Rhône, on ne les trouve qu'à plusieurs mètres de profondeur. On peut supposer qu'il existe des métapopulations avec des échanges qui sont encore à explorer.
- Près de la surface, les gradients populationnels sont soumis aux rythmes des crues.
- Les crues induisent une descente des espèces stygobies ; quand le débit augmente, la microfaune s'enfonce en profondeur sans qu'on sache encore s'il s'agit d'un mouvement passif (lié au débit d'infiltration) ou d'une sorte de réflexe actif de fuite induit par une augmentation du courant souterrain, ou par l'instabilité des grains du substrat. Toujours est-il qu'après les inondations, beaucoup d'espèces épigées normalement trouvées sur le fond du lit se retrouvent plus nombreuses dans le sédiment, alors que des espèces stygobies normalement présentes dans le sédiment se sont elles-mêmes enfoncées plus profondément dans les alluvions.
- Inversement, l'étiage du cours d'eau provoque une remontée des espèces stygobies, parfois jusqu'à moins de 50 centimètres sous l'écotone sédiment-eau. Il semble qu'alors, la majorité de espèces vivant normalement dans la couche superficielle des sédiments disparaît, mangée ou partie dans l'eau libre du fleuve. Ces mouvements verticaux rythmés jouent sans doute un rôle important en matière de bioturbation et de micromélange des couches les plus fines. Ils sont quasiment supprimés dans les cours d'eau très régulés. À l'étiage, la zone sous-fluviale (dite « hyporhéique ») pourrait constituer un rôle de refuge pour une partie de la faune du fleuve lors des crues perturbations, plus ou moins efficace selon l'épaisseur des alluvions et taille des interstices et leur connectivité avec les milieux souterrains environnants).
- Beaucoup d'espèces semblent effectuer préférentiellement leur premier stade larvaire dans les sédiments sous-fluviaux (hyporhéiques), où l'hydrodynamisme et la pression de prédation et compétition semble moindre qu'en surface. La zone hyporhéique jouerait donc peut-être un rôle de nurserie pour de nombreux organismes du lit de la rivière ou du fleuve, mais c'est aussi une zone qui peut être relativement polluée, au moins dans sa partie supérieure.
Origines possibles des communautés souterraines « hyporhéiques »[3]
[modifier | modifier le code]Elle reste débattue, mais plusieurs hypothèses, éventuellement complémentaires ont été posées :
- Dans les décennies 1950 et 1960, on a pensé[15] qu'il s'agissait d'espèces relique vivant dans une zone aujourd’hui plutôt hostile à la vie des animaux de surface, mais qui aurait pu néanmoins être un « milieu refuge » intéressant durant les crises passées (périodes sèches et/ou glaciaires froides ou crise marine de salinité). Quelques indices plaident en faveur de cette hypothèse : des lignée diversifiée en surface sont peu représentées en profondeur, ou certains organismes rarissimes tels que l'Ostracode Phreatocandona motasi ou le Copépode Harpacticoïde Anthrocamptuscatherinae ne sont en outre trouvés que dans quelques rares habitats, ce qui évoque un phénomène de spéciation.
- En 1987, Raymond Rouch[16] ou Dan Danielopol[17]) ont estimé qu'au contraire, des « colonisations actives[18] » du milieu aquatique souterrain par des taxons préadaptées ainsi que par des organismes généralistes ubiquistes (écologiquement peu exigeants), en y entrant via les nombreux écotones (zones de contact entre berges, sources sédiments et eaux souterraines). Un indice en faveur de cette hypothèse est qu'en Afrique équatoriale, dans des zones n'ayant pas subi de chocs climatiques, sur des îles volcaniques récentes, il y a eu « colonisation active » et rapide par diverses espèces stygobies.
- Plus récemment Nicole Coineau[19] et Claude Boutin[20] ont proposé une hypothèse conciliant les deux précédentes. Des populations issues d'une colonisation active ont pu se retrouver maintes fois isolées par des crises climatiques (régressions marines et périodes sèches et froides lors des glaciations). Un indice en faveur de cette hypothèse est l'existence d'animaux visiblement d'origine marine, le long d'anciens rivages marins aujourd'hui asséchés[21].
Stygologie
[modifier | modifier le code]L'écosystème d'un cours d'eau ou d'une rivière ne se résume pas à l'eau qui coule à la surface : les rivières sont reliées aux zones riveraines adjacentes[22]. Par conséquent, les cours d'eau et les rivières comprennent la zone hyporhéique dynamique qui se trouve en dessous et à côté du canal principal. Comme la zone hyporhéique se trouve sous l'eau de surface, elle peut être difficile à identifier, à quantifier et à observer. Cependant, la zone hyporhéique est une zone d'activité biologique et physique, et a donc une importance fonctionnelle pour les écosystèmes des cours d'eau et des rivières[23]. Les chercheurs utilisent des outils tels que des puits et des piézomètres, des traceurs conservateurs et réactifs[24] et des modèles de transport qui tiennent compte de l'advection et de la dispersion de l'eau à la fois dans le chenal du cours d'eau et dans la subsurface[25]. Ces outils peuvent être utilisés indépendamment pour étudier le mouvement de l'eau à travers la zone hyporhéique et vers le canal du cours d'eau, mais ils sont souvent complémentaires pour obtenir une image plus précise de la dynamique de l'eau dans l'ensemble du canal.
Bibliographie
[modifier | modifier le code]- Stanford, JA & JV Ward. An ecosystem perspective of alluvial rivers : connectivity and the hyporheic corridor. J. N. Am. Benthol. Soc. 12:48-60, 1993. (Résumé, en anglais via jstor)
- Matthias brunke et Tom Gonser, The ecological significance of exchange processes between rivers and groundwater, Special Review, Freshwater Biology, 1997, 37, 1-33 Article intégral (PDF)
Voir aussi
[modifier | modifier le code]- étiage
- lit
- terrasse fluviatile
- plaine alluviale
- méandre
- chenal
- aréisme
- endoréisme
- exoréisme
- alluvion
- estuaire, delta
- bassin versant
- débit
- régime hydrologique
- module
- Liste de fleuves dans le monde classés par continent
- Liste des plus longs fleuves
- Continuum fluvial
- Écologie des systèmes lotiques
- Fleuve côtier, estuaire
- rivière
- berge
- Trame verte, trame bleue
- Ripisylve
Notes et références
[modifier | modifier le code]- Ginet, R & J David, Présence de Niphargus (Amphipode Gammaridae) dans certaines eaux épigées des forêts de la Dombes (département de l´Ain, France). Vie Milieu 14:299-310, 1963.
- Stanford, JA & JV Ward. An ecosystem perspective of alluvial rivers : connectivity and the hyporheic corridor. J. N. Am. Benthol. Soc. 12:48-60, 1993. (Résumé, en anglais via jstor)
- Janine Gibert, Pierre Marmonier, Marie-José Dole-Olivier, Sous les eaux vives prospère un univers de curiosités biologiques Un fleuve peut en cacher un autre, La recherche, no 288, juin 96. - p. 44-46.
- TAK Theoretical & Applied Karstology, TAK-Online
- Revue Stygologia (International journal of general and applied groundwater research, including the marine interstitial), éditée par Leiden : E.J. Brill, 1985 ; v. : ill. ; 25 cm. avec le premier numéro paru en mai 1985 (fréquence : 3 numéros par an)
- Palmer, MA; AP Civich; BJ Finlay; J Gibert; KD Hyde et al. 1997. Biodiversity and ecosystem processes in freshwater sediments. Ambio 26:571- 577.
- Lazare Botoşăneanu, Stygofauna Mundi A Faunistic, Distributional, and Ecological Synthesis of the World Fauna Inhabiting Subterranean Waters (Including Marine Intersti) avril 1987 ; Ed : Brill Academic Pub, (ISBN 9004075712 et 9789004075719)
- Gruner, H.-E. (1987), Botosaneanu, Lazare (ed.) : Stygofauna Mundi. A Faunistic, Distributional, and Ecological Synthesis of the World Fanna inhabiting Subterranean Waters (including the Marine Interstitial). – Leiden (E. J. Brill), 1986; VI + 740 S., zahlr. Abb., hfl. 480. –. – (ISBN 90-04-07571-2). Mitteilungen aus dem Museum für Naturkunde in Berlin. Zoologisches Museum und Institut für Spezielle Zoologie (Berlin), 63: 316. doi: 10.1002/mmnz.19870630209
- Malard F., Plenet S. & J. Gibert, The use of invertebrates in groundwater monitoring: a rising research field. Ground Water Monitoring and Remediation, 1996, 16, 2, 103-116
- Malard F., Reygrobellet J.L., Mathieu J. & Lafont M., Biomonitoring groundwater contamination : application to a karst area in southern France ; Aquatic Sciences, 1996, 58, 2, 158-187.
- Boulton, AJ; S Findlay; P Marmonier; EH Stanley & HM Valett. The functional significance of the hyporheic zone in streams and rivers. Annu. Rev. Ecol. Syst. 29:59-81, 1998.
- Boulton, AJ. 1993. Stream ecology and surface hyporheic exchange: implications, techniques and limitations. Aust. J. Mar. Fresh. Res. 44:553-564.
- voir schéma de la page 6 in Matthias brunke et Tom Gonser, The ecological significance of exchange processes between rivers and groundwater, Special Review, Freshwater Biology, 1997, 37, 1-33
- Hervant, F. & Mathieu, J. (1996) - « Adaptations à l'hypoxie chez des Crustacés souterrains et superficiels », Mémoires de biospéologie, tome XXIII, Laboratoire souterrain du C.N.R.S., Moulis, p. 211-216
- L. Botosaneanu et J.R. Holsinger, Stygologia , 6 (1) , 11-39, 1987
- Laboratoire souterrain du CNRS de Moulis, Ariège
- Institut de limnologie de Mondsee, Autriche
- R. Rouch et D. Danielopol, Stygologia , 3/4 , 345-372, 1987
- Laboratoire Arago de l'université Paris-VI à Banyuls-sur-Mer
- Laboratoire d'hydrobiologie de l'université Paul-Sabatier de Toulouse
- C. Boutin et N. Coineau, Revue de micropaléontologie , 33 , 3-4, 303-322, 1990
- (en) « An ecosystem perspective of alluvial rivers: connectivity and the hyporheic corridor | Scinapse | Academic search engine for paper », sur Scinapse (consulté le )
- Andrew J. Boulton, Stuart Findlay, Pierre Marmonier, Emily H. Stanley et H. Maurice Valett, « The functional significance of the hyporheic zone in streams and rivers », Annual Review of Ecology and Systematics, vol. 29, no 1, , p. 59–81 (ISSN 0066-4162, DOI 10.1146/annurev.ecolsys.29.1.59)
- (en) Patrick J. Mulholland, Jennifer L. Tank, Diane M. Sanzone, Wilfred M. Wollheim, Bruce J. Peterson, Jackson R. Webster et Judy L. Meyer, « Nitrogen Cycling in a Forest Stream Determined by a 15n Tracer Addition », Ecological Monographs, vol. 70, no 3, , p. 471–493 (ISSN 1557-7015, DOI 10.1890/0012-9615(2000)070[0471:NCIAFS]2.0.CO;2, hdl 10919/46856
 )
) - (en) Kenneth E. Bencala et Roy A. Walters, « Simulation of solute transport in a mountain pool-and-riffle stream: A transient storage model », Water Resources Research, vol. 19, no 3, , p. 718–724 (ISSN 1944-7973, DOI 10.1029/WR019i003p00718, Bibcode 1983WRR....19..718B, hdl 2027/uc1.31210024756569
 )
)


 French
French Deutsch
Deutsch