Luminol — Wikipédia
| Luminol | ||
 | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 5-amino-2,3-dihydro-1,4-phtalazinedione | |
| Synonymes | o-aminophtaloyl hydrazide | |
| No CAS | ||
| No ECHA | 100.007.556 | |
| No CE | 208-309-4 | |
| PubChem | ||
| SMILES | ||
| InChI | ||
| Apparence | cristaux brillants, jaune verdâtre | |
| Propriétés chimiques | ||
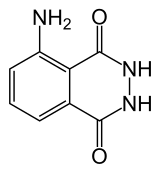
| Formule | C8H7N3O2 [Isomères] | |
| Masse molaire[2] | 177,160 1 ± 0,008 1 g/mol C 54,24 %, H 3,98 %, N 23,72 %, O 18,06 %, | |
| Propriétés physiques | ||
| T° fusion | 319 à 320 °C[réf. souhaitée] | |
| Solubilité | Soluble dans l'éthanol et l'acétone. Insoluble dans l'eau | |
| Précautions | ||
| SGH | ||
| Directive 67/548/EEC | ||
| Écotoxicologie | ||
| DL50 | rats, peroral 500 mg kg−1[réf. souhaitée] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||

Le luminol est un composé organique présentant une chimiluminescence, avec un éclat bleu caractéristique, lorsqu'il est mélangé avec un oxydant adéquat. Il s'agit d'un solide cristallin, blanc à légèrement jaune qui est soluble dans la plupart des solvants organiques polaires, mais insoluble dans l'eau.
Le luminol est utilisé en criminalistique pour détecter les faibles traces de sang laissées sur les scènes de crime. Il est également utilisé par les biologistes pour détecter le cuivre, le fer et le cyanure.
Histoire
[modifier | modifier le code]Bien que le luminol soit connu depuis 1902, ce n'est qu'en 1913 qu'a été découverte sa chimiluminescence. Curtius et Semper, deux scientifiques, l'ont découverte par hasard après l'avoir dissous dans de l'hydroxyde de sodium et ensuite oxydé avec du peroxyde d'hydrogène ou de l'hypochlorite de sodium, le mélange a alors émis une forte lumière verte plus intense que n'importe quelle autre réaction chimique connue[3].
Le luminol a été synthétisé pour la première fois en 1934[4] pour démontrer la chimiluminescence.
Le luminol a ensuite été utilisé comme agent de test pour observer l'apparition de peroxyde d'hydrogène lors d'une réaction[5].
Chimie
[modifier | modifier le code]Synthèse
[modifier | modifier le code]Le luminol peut être synthétisé à partir de l'acide 3-nitrophtalique. De l'hydrazine (N2H4) est d'abord chauffée avec l'acide 3-nitrophtalique dans un solvant à haut point d'ébullition tel que le triéthylène glycol. Une réaction de condensation avec perte d'eau se produit, formant du 3-nitrophtalhydrazide[6]. La réduction du groupe nitrate en un groupe amine avec du dithionite de sodium (Na2S2O4) produit du luminol[7].
Chimiluminescence
[modifier | modifier le code]Un oxydant est nécessaire afin de provoquer la luminescence du luminol. Habituellement, une solution de peroxyde d'hydrogène (H2O2) et un sel hydroxyde aqueux sont utilisés comme activateur. En présence d'un catalyseur — comme un composé ferreux —, le peroxyde d'hydrogène est décomposé en eau et en dioxygène :
- 2H2O2 → O2 + 2H2O
Dans le cadre d'un laboratoire, le catalyseur utilisé est souvent du ferricyanure de potassium. Pour la détection criminologique de sang, le catalyseur est le fer présent dans l'hémoglobine. Les enzymes de beaucoup de systèmes biologiques sont également susceptibles de catalyser la décomposition de peroxyde d'hydrogène.

Lorsque le luminol réagit avec le sel hydroxyde, un dianion se forme. L'oxygène issu de la décomposition du peroxyde d'hydrogène réagit alors avec ce dianion. Le produit de cette réaction, un peroxyde organique, est très instable et se décompose immédiatement avec une perte d'azote pour produire de l'acide 3-aminophtalique possédant des électrons dans un état excité. La désexcitation des électrons provoque l'émission d'énergie sous forme d'un photon de lumière bleue visible.
Utilisation en criminalistique
[modifier | modifier le code]
Histoire
[modifier | modifier le code]En 1937, le chimiste et criminologue allemand Walter Specht (de) teste un mélange utilisant comme réactif le luminol sur différents supports souillés de sang (pelouse, briques, fer rouillé, dalles de pierre, meubles) et révèle l'hémoglobine par la photographie. Son test est efficace aussi bien sur des taches de sang fraîches qu'anciennes et peut détecter le sang dans les liquides[8]. En 1939, Proesher et Moody testent positivement la composition de Specht sur du sang animal et humain. Ils améliorent l'efficacité de la détection en ajoutant préalablement un activateur à base d'acide chlorhydrique, rendant possible la détection de taches de sang préalablement nettoyées[9]. Depuis lors, différents kits de terrain sont proposés, constitués de poudres composées de luminol à dissoudre dans une solution alcaline en présence d'un activateur (Grodsky en 1951[10], Weber en 1966[11], révélateur de sang Bluestar de Loïc Blum en 2000[12]).
Théorie
[modifier | modifier le code]Le luminol est utilisé par la police scientifique pour repérer les traces de sang invisibles, même lorsqu’elles ont été nettoyées. Pour révéler des traces de sang visibles, un test plus simple est utilisé : le sang est mis en contact avec de l'eau oxygénée, ce qui produit une réaction qui mousse par dégagement d'oxygène gazeux.
Les traces peu visibles à l'œil nu sont d'abord mises en évidence par de puissants projecteurs — du type Crimelite et Crimescope —, qui peuvent émettre une fréquence qui va « assombrir » le sang (415 nm) et « éclaircir » les autres surfaces pour le détecter sur des fonds sombres. Sur des fonds clairs, ils sont utilisés en lumière blanche rasante pour rechercher des traces rougeâtres[13].
L'enquêteur ayant détecté des traces de sang invisibles grâce à ce type de projecteurs utilise le luminol en complément, ce procédé de luminescence permettant, par la photographie de la scène, la morphoanalyse des traces de sang, qui détermine le scénario du crime — nature de l'arme, nombre de coups portés… — et sa chronologie. L'enquêteur prépare une solution de luminol et d'activateur et la pulvérise sur toute la surface du lieu d'investigation. Le fer présent dans le sang va alors catalyser la réaction chimique, qui provoque la luminescence, révélant l'emplacement du sang. La quantité de catalyseur nécessaire à la réaction est très faible par rapport à la quantité de luminol, ce qui permet la détection de quantités de sang infinitésimales. L'éclat est bleu et dure environ trente secondes. La pièce doit être assez sombre afin de détecter celui-ci. Toute émission de lumière doit être archivée par une photographie à temps de pose élevé.
Inconvénients
[modifier | modifier le code]Le luminol possède des inconvénients pouvant limiter son utilisation dans les enquêtes criminelles :
- le luminol réagit en présence de cuivre ou d'un alliage de cuivre, de raifort, et de certains décolorants, oxydants ou désinfectants biocides – ainsi, si une scène de crime est soigneusement nettoyée à l'aide d'une solution diluée d'eau de Javel, celle-ci va devenir entièrement fluorescente et peut camoufler les éventuelles traces organiques comme le sang (humain ou animal)[14]. Cependant même après javellisation, la détection de traces de sang est possible[15] ;
- le luminol va également détecter les petites quantités de sang présentes dans l'urine ;
- le luminol réagit aux matières fécales, produisant le même éclat que s'il s'agissait de sang ;
- la présence de luminol peut empêcher de pratiquer d'autres tests ; cependant, il a été montré que l'ADN peut être extrait avec succès d'échantillons traités avec du luminol[16].
Autres utilisations
[modifier | modifier le code]- Médicale : utilisé pour procéder à des tests biochimiques.
- Éducation : permettre aux jeunes de s'intéresser aux sciences.
- Loisir et sécurité : enfermé dans des baguettes que l'on craque en pliant pour mélanger les réactifs. Les bâtonnets lumineux servent lors d'une fête (décoration) ou pour une signalisation de sécurité (évacuation, accident) ou en milieu aquatique (plongée). Il est également utile pour les spéléologues.
Notes et références
[modifier | modifier le code]- (en) Luminol RN: 521-31-3, base de données NLM ChemIDplus.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) R.E.D Clark, Chemiluminescence, School Sci. Rev., 1937/38, 19, 489.
- (en) E.H. Huntress, L.N. Stanley et A.S. Parker (1934), The preparation of 3-aminophthalhydrazide for use in the demonstration of chemiluminescence, J. Am. Chem. Soc., 56, 241.
- (en) H.H. Roetorfer et M.J. Cornier (1957), Formation of « hydrogen peroxide » in the reaction of oxyhemoglobin with methemoglobin forming agents, Arch. Biochem., 71: 235, 1957.
- (en) 5-Nitro-2,3-dihydro-1,4-phthalazinedione, Organic Syntheses, vol. 3, p. 656 (1955) ; vol. 29, p. 78 (1949).
- (en) 5-Amino-2,3-dihydro-1,4-phthalazinedione, Organic Syntheses, vol. 3, p. 69 (1955) ; vol. 29, p. 8 (1949).
- (de) W. Specht, Die Chemiluminescenz des Hämins, ein Hilfsmittel zur Auffindung und Erkennung forensisch wichtiger Blutspuren, Angewandte Chemie, 50, 1937, p. 155-157.
- (en) Proescher F. et Moody A.M., Detection of blood by means of chemiluminescence, J. Lab. Clin. Med., 1939, 24, p. 1183–1189.
- (en) Grodsky M., Wright K. et Kirk P.L., Simplified preliminary blood testing: an improved technique and a comparative study of methods, J. Crimin. Law Criminol. Police Sci., 1951, 42, 95–104.
- Jean-Claude Martin, Investigation de scène de crime : fixation de l'état des lieux et traitement des traces d'objets, PPUR, (lire en ligne), p. 22.
- La chimie du Bluestar Forensic.
- Jacques Pradel, Police scientifique, la révolution : Les vrais experts parlent, Telemaque, , 304 p. (ISBN 978-2-7533-0126-9 et 2-7533-0126-3).
- « Quelles sont les failles ? », sur luminol-tpe.e-monsite.com (consulté le ).
- « Performances du Bluestar Forensic - Javel », sur bluestar-forensic.com (consulté le ).
- P. de Brem, « Police scientifique : des recherches tous azimuts - 02/ Biologie : faire parler le sang », Banques des savoirs, 8 octobre 2007.


 French
French Deutsch
Deutsch
