Méthyldiborane — Wikipédia
| Méthyldiborane | |
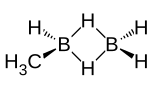 | |
| Structure du méthyldiborane | |
| Identification | |
|---|---|
| No CAS | [1] |
| Propriétés chimiques | |
| Formule | CH8B2 |
| Masse molaire[2] | 41,696 ± 0,015 g/mol C 28,81 %, H 19,34 %, B 51,86 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Le méthyldiborane est un composé organoboré de formule chimique H2B(μ-H)2BHCH3. C'est le plus simples des alkyldiboranes. À température ambiante, il est à l'équilibre avec le 1,1-diméthylborane H2BH2B(CH3)2, le 1,2-diméthyldiborane CH3HBH2BHCH3, le triméthyldiborane CH3HBH2B(CH3)2, le tétraméthyldiborane (CH3)2BH2B(CH3)2, et le triméthylborane B(CH3)3[3]. Il se présente sous la forme d'un gaz pyrophorique qui se condense à −43 °C[4] et dont le liquide a une masse volumique de 0,546 g/cm3 à −126 °C[5].
Histoire et préparation
[modifier | modifier le code]Les méthylboranes ont été préparés pour la première fois dans les années 1930[6],[7]. On les obtient en faisant réagir du diborane H2BH2BH2 et du triméthylborane B(CH3)3, ce qui donne quatre composés différents : le méthyldiborane H2BH2BHCH3, le 1,1-diméthyldiborane H2BH2B(CH3)2, le 1,2-diméthyldiborane CH3HBH2BHCH3 et le tétraméthyldiborane (CH3)2BH2B(CH3)2[8]. C'est une réaction complexe. À 0 °C avec du diborane en excès, il se forme en premier du méthyldiborane, qui reste à faible concentration tandis que le 1,1-diméthyldiborane s'accumule jusqu'à ce que tout le triméthylborane soit consommé. Il s'établit un équilibre entre le diborane, le méthyldiborane et le diméthyldiborane :
- 2 H2BH2BHCH3 H2BH2BH2 + CH3HBH2BHCH3.
À 0 °C, la constante d'équilibre de cette réaction vaut environ 0,07 de sorte que le méthyldiborane est majoritaire dans le mélange mais avec une quantité significative de diborane et de diméthyldiborane[9]. Le meilleur rendement en méthyldiborane est obtenu avec un rapport diborane:triméthyldiborane de 4:1[10].
La réaction de méthyllithium CH3Li avec du diborane donne environ 20 % de méthyldiborane[11].
On peut également obtenir des méthylboranes en chauffant du triméthylborane en présence d'hydrogène sous pression entre 80 et 200 °C. Le triméthylborane réagit avec les sels métalliques de borohydrure en présence de chlorure d'hydrogène HCl, de chlorure d'aluminium AlCl3 ou de trichlorure de bore BCl3. Il y a libération de méthane avec le borohydrure de sodium NaBH4, mais pas avec le borohydrure de lithium LiBH4[7]. Le diméthylchloroborane BCl(CH3)2 et le méthyldichloroborane BCl2CH3 sont également des produits gazeux de ces réactions.
La réaction de Cp2Zr(CH3)2 avec du borane BH3 dissous dans le tétrahydrofurane (THF) conduit à l'insertion d'un groupe borohydro dans la liaison Zr–C et à la production de dérivés méthylés du diborane[12].
La réaction du triméthylgallium Ga(CH3)3 avec le diborane à −45 °C donne du méthyldiborane avec du borohydrure de diméthylgallium (CH3)2GaBH4[13] :
À température ambiante, le triméthylgallium réagit avec le diborane en donnant une substance volatile qui se décompose en méthyldiborane et en gallium avec libération d'hydrogène H2[13] :
Propriétés et réactions
[modifier | modifier le code]Si l'on note B2 l'atome de bore lié au groupe méthyle, B1 l'autre atome de bore, et Hµ chacun des deux atomes d'hydrogène pontants, les dimensions de la molécule H2B1Hµ2B2HCH3 sont les suivantes : la liaison B1–B2 est longue de 182 pm ; les liaisons B1–H ne sont pas identiques et mesurent 119,5 pm et 118,7 pm ; la liaison B2–H mesure 196 pm ; les liaisons B–Hµ mesurent 134 pm et forment un angle de 47° avec l'axe B1–B2, tandis que la liaison B2–C mesure 149 pm et forme un angle de 120° avec cet axe ; le moment dipolaire de la molécule est de 0,56 D[14].
La chromatographie en phase gazeuse peut être utilisée pour déterminer les proportions de boranes méthylés dans un mélange. La séquence d'extraction est la suivante : diborane, méthyldiborane, triméthylborane, 1,1-diméthyldiborane, 1,2-diméthyldiborane, triméthyldiborane et tétraméthyldiborane[15].
Le méthyldiborane H2BH2BHCH3 se dismute lentement à −78,5 °C, d'abord en diborane H2BH2BH2 et 1,1-diméthyldiborane CH3HBH2BHCH3[5]. En solution, le méthylborane BH2CH3 est plus stable par rapport à la dismutation que le diméthylborane BH(CH3)2[8],[16].
- 2 H2BH2BHCH3 H2BH2B(CH3)2 + H2BH2BH2.
Le méthyldiborane s'hydrolyse en acide méthylboronique CH3B(OH)2[3] et réagit avec la triméthylamine N(CH3)3 pour donner un adduit solide triméthylamine-méthylborane (CH3)3N·BH2CH3 et triméthylamine-borane (CH3)3N·BH3[3].
L'oxydation du méthyldiborane à 150 °C donne du 2-méthyl-1,3,4-trioxadiboralane, formé d'un cycle constitué de trois atomes d'oxygène et deux atomes de bore avec un groupe méthyle lié à l'un des atomes de bore. Il se forme également du diméthyltrioxadiboralane et de la triméthylboroxine ainsi que des hydrocarbures, du diborane, de l'hydrogène et du diméthoxyborane (ester diméthylméthylboronique)[17].
Le chauffage d'un mélange de méthyldiborane ou de diméthyldiborane et d'ammoniac à 180 °C donne des borazines B-substituées avec zéro, un, deux ou trois groupes méthyle sur les atomes de bore[18],[19] — de formules respectivement B3N3H6, B3N3H5CH3, B3N3H4(CH3)2 ou B3N3H3(CH3)3.
La réaction de méthyldiborane avec une quantité suffisante d'une base de Lewis conduit à la formation de méthylborane BH2CH3 et à sa dimérisation en 1,2-diméthyldiborane CH3HBH2BHCH3[20].
Le méthyldiborane peut également méthyler le tétraborane B4H10[21] :
Notes et références
[modifier | modifier le code]- (en) Jane E. Macintyre, Dictionary of Organometallic Compounds, 1994, p. 463. (ISBN 978-0412430602).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) R. P. Bell et H. J. Emeléus, « The boron hydrides and related compounds », Quarterly Reviews, Chemical Society, vol. 2, no 2, , p. 132-151 (DOI 10.1039/QR9480200132, lire en ligne)
- (en) John H. Lamneck Jr. et Samuel Kaye, « Thermal reaction of diborane with trimethylborane », sur digital.library.unt.edu, Université de North Texas, (consulté le ).
- (en) Roger K. Bunting, « 55 1-Methyldiborane », Duward F. Shriver, Inorganic Syntheses, vol. 19, John Wiley and Sons, 22 septembre 2009, p. 237–238. (ISBN 978-0471045427)
- (en) H. I. Schlesinger et A. O. Walker, « Hydrides of Boron. IV. The Methyl Derivatives of Diborane », Journal of the American Chemical Society, vol. 57, no 4, , p. 621-625 (DOI 10.1021/ja01307a009, lire en ligne)
- (en) L. H. Long et M. G. H. Wallbridge, « 646. The chemistry of boron. Part VI. New preparative methods and decomposition studies relating to methyldiboranes », Journal of the Chemical Society (Resumed), , p. 3513-3520 (DOI 10.1039/JR9650003513, lire en ligne)
- (en) Herbert C. Brown, Thomas E. Cole, Morris Srebnik et Kee Won Kim, « Hydroboration. 79. Preparation and properties of methylborane and dimethylborane and their characteristics as hydroborating agents. Synthesis of tertiary alcohols containing methyl groups via hydroboration », The Journal of Organic Chemistry, vol. 51, no 25, , p. 4925-4930 (DOI 10.1021/jo00375a031, lire en ligne)
- (en) Lloyd van Alten, G. R. Seely, John Oliver et D. M. Ritter, « Kinetics and Equilibria in the Alkylation of Diborane », Advances in Chemistry, vol. 12, (DOI 10.1021/ba-1961-0032.ch012, lire en ligne)
- (en) J. H. Carpenter, W. J. Jones, R. W. Jotham et L. H. Long, « The Raman spectra of the methyldiboranes—II: Monomethyldiborane and trimethyldiborane, and characteristic frequencies of the methyldiboranes », Spectrochimica Acta Part A: Molecular Spectroscopy, vol. 27, no 9, , p. 1721-1734 (DOI 10.1016/0584-8539(71)80227-1, Bibcode 1971AcSpA..27.1721C, lire en ligne)
- (en) A. G. Massey, « Chapter 2. The typical elements. Part II: Group III », Annual Reports Section "A" (Inorganic Chemistry), vol. 76, , p. 13-58 (DOI 10.1039/IC9797600013, lire en ligne)
- (en) John A. Marsella et Kenneth G. Caulton, « Dealkylation of zirconium(IV) by borane: the intimate mechanism of an alkyl transfer reaction », Journal of the American Chemical Society, vol. 104, no 9, , p. 2361-2365 (DOI 10.1021/ja00373a005, lire en ligne)
- (en) H. I. Schlesinger, Herbert C. Brown et George W. Schaeffer, « The Borohydrides of Gallium », Journal of the American Chemical Society, vol. 65, no 9, , p. 1786-1787 (DOI 10.1021/ja01249a512, lire en ligne)
- (en) C. W. Chiu, A. B. Burg et R. A. Beaudet, « Molecular structure determination of methyldiborane », Inorganic Chemistry, vol. 21, no 3, , p. 1204-1208 (DOI 10.1021/ic00133a064, lire en ligne)
- (en) G. R. Seely, J. P. Oliver et D. M. Ritter, « Gas-Liquid Chromatographic Analysis of Mixtures Containing Methyldiboranes », Analytical Chemistry, vol. 31, no 12, , p. 1993-1995 (DOI 10.1021/ac60156a032, lire en ligne)
- (en) Thomas Onak, « Carboranes and Organo-Substituted Boron Hydrides », F. G. A. Stone et Robert West, Advances in Organometallic Chemistry, Academic Press, janvier 1966, p. 284. (ISBN 978-0080580043)
- (en) Lawrence Barton, John M. Crump et Jeffrey B. Wheatley, « Trioxadiborolanes from the oxidation of methyldiborane », Journal of Organometallic Chemistry, vol. 72, no 1, , C1-C3 (DOI 10.1016/S0022-328X(00)82027-6, lire en ligne)
- (en) J. C. Sheldon et B. C. Smith, « The borazoles », Quarterly Reviews, Chemical Society, vol. 14, no 2, , p. 200-219 (DOI 10.1039/QR9601400200, lire en ligne)
- (en) H. I. Schlesinger, Leo Horvitz et A. B. Burg, « Hydrides of Boron. VI. The Action of Ammonia on the Methyl Diboranes », Journal of the American Chemical Society, vol. 58, no 3, , p. 409-414 (DOI 10.1021/ja01294a008, lire en ligne)
- (en) Kenneth Wade, « The General Chemistry of the Boron Hydrides », Electron Deficient Compounds, Thomas Nelson, 1971, p. 91-92. (ISBN 978-1-4684-6056-8)
- (en) Thomas Onak, Organoborane chemistry, Academic Press, 1975, p. 193–194. (ISBN 978-0-12-526550-8)


 French
French Deutsch
Deutsch