Chlorure d'aluminium — Wikipédia
| Chlorure d'aluminium(III) | |
   | |
| Identification | |
|---|---|
| Nom UICPA | trichloroalumane |
| Synonymes | trichlorure d'aluminium |
| No CAS | |
| No ECHA | 100.028.371 |
| No CE | 231-208-1 |
| No RTECS | BD0525000 |
| Code ATC | D10 |
| PubChem | 24012 |
| SMILES | |
| InChI | |
| Apparence | solide jaune pâle |
| Propriétés chimiques | |
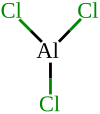
| Formule | AlCl3 [Isomères] |
| Masse molaire[1] | 133,341 ± 0,006 g/mol Al 20,23 %, Cl 79,76 %, |
| Propriétés physiques | |
| T° fusion | 190 °C[réf. souhaitée] |
| T° ébullition | 182,7 °C à 752 mmHg (sublimation)[2] |
| Solubilité | dans l'eau : 439 g l−1 (0 °C), 449 g l−1 (10 °C), 458 g l−1 (20 °C) 466 g l−1 (30 °C) 473 g l−1 (40 °C) 481 g l−1 (60 °C) 486 g l−1 (80 °C) 490 g l−1 (100 °C). éthanol : 1 000 g l−1 (12,5 °C). chloroforme : 0,7 g l−1 (20 °C). CCl4 : soluble. éther : soluble[réf. souhaitée] |
| Masse volumique | 2,44 à 2,48 g/cm3[2] |
| Point critique | 26,3 bar, 346,85 °C[3] |
| Cristallographie | |
| Système cristallin | Monoclinique |
| Réseau de Bravais | mC |
| Symbole de Pearson | [4] |
| Classe cristalline ou groupe d’espace | C2/m (no 12)[4] |
| Strukturbericht | D015[4] |
| Structure type | YCl3 |
| Précautions | |
| SGH[5] | |
| H314 | |
| NFPA 704 | |
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 3 450 mg kg−1[réf. souhaitée] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Le chlorure d'aluminium (AlCl3) aussi appelé trichlorure d’aluminium, ou chlorure d'aluminium(III), est un sel d'aluminium et de chlore. La forme anhydre possède une structure particulière : bien qu'étant un halogénure d'un métal très électropositif, les liaisons chimiques sont principalement covalentes et non pas ioniques comme on pourrait s'y attendre. Cela a notamment pour conséquence qu'AlCl3 possède des températures de fusion et de sublimation basses (178 °C pour cette dernière), et qu'à l'état liquide, il conduit mal l'électricité contrairement aux halogénures ioniques comme le chlorure de sodium. Ce composé existe à l'état solide sous la forme d'un réseau hexacoordiné. Il fond en formant un dimère tétracoordiné, Al2Cl6 qui peut se vaporiser, mais qui se dissocie à température plus élevée pour former une espèce AlCl3 analogue à BF3.
Le chlorure d'aluminium est très déliquescent et il peut exploser au contact de l'eau sous l'effet de l'hydratation. Il s'hydrolyse partiellement en présence d'eau pour former du chlorure d'hydrogène (acide chlorhydrique). En solution aqueuse, AlCl3 est totalement ionisé et la solution conduit bien le courant électrique. Cette solution est acide. De manière simplifiée, le cation produit par l'hydrolyse du chlorure d'aluminium s'écrit :
- .
AlCl3 est probablement l'acide de Lewis le plus couramment utilisé et parmi les plus puissants. Ce composé possède de très nombreuses applications dans l'industrie chimique, notamment comme catalyseur pour les réactions de Friedel-Crafts, à la fois l'alkylation et l'acylation. Il est également utilisé pour des réactions de polymérisation ou d'isomérisation de composés organiques.
Il existe également un chlorure d'aluminium(I) (AlCl), mais il est très instable et n'est connu qu'à l'état gazeux.
Propriétés physico-chimiques
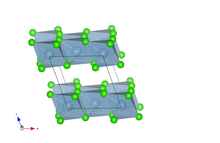
[modifier | modifier le code]À l'état solide, le chlorure d'aluminium cristallise suivant la structure type YCl3, avec les ions Al3+ formant un réseau cubique à faces centrées.
Le chlorure d'aluminium est un acide de Lewis puissant, capable de réagir selon des réactions acide-base de Lewis avec des bases de Lewis même faibles comme la benzophénone ou le mésitylène. En présence d'un ion chlorure, il réagit pour former AlCl4−.
L'hydrolyse partielle en présence d'eau forme du chlorure d'hydrogène et/ou de l'acide chlorhydrique. Les solutions aqueuses de chlorure d'aluminium se comportent de la même manière que les solutions d'autres sels contenant des ions Al3+ hydratés. Par exemple, mis en présence de la quantité appropriée de soude, il forme un précipité gélatineux d'hydroxyde d'aluminium :
Structure cristalline
[modifier | modifier le code]À l'état solide, le chlorure d'aluminium cristallise dans une structure monoclinique type RhCl3, de groupe d'espace C 2/m[6]. Ses paramètres de maille sont a = 5,914 Å, b = 10,234 Å et c = 6,148 Å avec β = 108,25°. Dans la maille, l'aluminium occupe la position de Wyckoff 4g (y = 0,166) et le chlore les positions 4i (x = 0,215 et z = 0,226) et 8j (x = 0,252, y = 0,321, z = 0,225). La structure obtenue est une structure en feuillets dans le plan (a, c), l'aluminium étant placé au centre d'octaèdres d'aluminium, et en nid d'abeille dans le plan (a, b).

Préparation
[modifier | modifier le code]Le chlorure d'aluminium est produit industriellement par la réaction directe de l'aluminium et du dichlore :
- 2 Al + 3 Cl2 → 2 AlCl3
ou à partir d'aluminium et d'acide chlorhydrique :
- 2 Al + 6 HCl → 2 AlCl3 + 3 H2.
Cette réaction est exothermique et nécessite un refroidissement du ballon dans un bain d'eau froide.
La couche de passivation de l'aluminium (composée d'oxyde d'aluminium (Al2O3)) le rend peu réactif au début mais une fois cette couche éliminée, l'aluminium devient plus réactif. Il est donc conseillé de décaper l'aluminium dans de l'acide chlorhydrique concentré à 23 % et une fois que la réaction est démarrée, diluer l'acide avec son volume en eau distillée (pour diviser sa concentration par deux) afin de limiter l'échauffement local (à la surface de l'aluminium) qui risquerait (malgré le refroidissement global du milieu réactionnel via le bain d'eau froide) de dégazer la solution d'acide chlorhydrique en émettant du chlorure d'hydrogène gazeux.
Le ballon doit également être ouvert car comme mentionné ci-dessus, la réaction dégage du dihydrogène mais il est conseillé de poser un entonnoir afin de limiter l'émission de chlorure d'hydrogène (la vapeur d'eau se condensant sur la surface de l'entonnoir, une part importante du chlorure d'hydrogène gazeux dégagé par l'échauffement de l'acide chlorhydrique se dissout dans les gouttes d'eau pour reformer l'acide chlorhydrique qui va retomber dans le milieu réactionnel tout en permettant au dihydrogène (et un peu de chlorure d'hydrogène) de s'échapper via le trou de l'entonnoir).
Utilisations
[modifier | modifier le code]- La principale utilisation du chlorure d'aluminium concerne la fabrication de composés par la réaction de Friedel-Crafts dont il est un catalyseur, par exemple la fabrication d'anthraquinone (pour l'industrie de la teinture) à partir du benzène et du phosgène. Au cours de la réaction de Friedel-Crafts, un chlorure d'acyle ou un halogénure d'alkyle réagit avec un composé aromatique suivant :
Avec les dérivés du benzène, le produit principal de la réaction est l'isomère para. La réaction d'alkylation posant de nombreux problèmes, elle est moins largement utilisée que la réaction d'acylation. Dans les deux cas, le chlorure d'aluminium (ou l'appareillage utilisé) ne doit pas être totalement anhydre, des traces d'humidité étant nécessaires pour la mise en œuvre de la réaction. L'un des problèmes de la réaction de Friedel-Crafts est que le catalyseur (chlorure d'aluminium) doit être présent en quantité stœchiométrique pour que la réaction soit totale parce qu'il forme un complexe stable avec le produit. Cette particularité le rend très difficile à recycler, si bien qu'ils doivent être détruits après usage, ce qui génère une quantité importante d'effluents corrosifs. Pour cette raison, les chimistes étudient la possibilité d'utiliser des catalyseurs plus neutres vis-à-vis de l'environnement tels que le trifluorométhanesulfonate d'ytterbium(III) ou le trifluorométhanesulfonate de dysprosium(III) qui sont plus coûteux mais peuvent être recyclés.
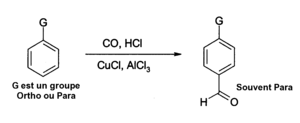
- Le chlorure d'aluminium peut également être utilisé dans des réactions d'insertion de fonctions aldéhyde dans des noyaux aromatiques, par exemple suivant une réaction de Gatterman-Koch qui utilise du monoxyde de carbone, du chlorure d'hydrogène et du chlorure de cuivre(I) comme co-catalyseur :
- Le chlorure d'aluminium a de nombreuses autres applications en chimie organique :
- AlCl3 est utilisé dans des réactions de polymérisation ou d'isomérisation de composés organiques. Des applications importantes sont la fabrication d'éthylbenzène (utilisé pour fabriquer le styrène puis le polystyrène), et la production de dodécylbenzène (utilisé pour fabriquer des détergents) ;
- AlCl3 catalyse notamment la réaction de Diels-Alder ;
- AlCl3 catalyse aussi l'addition de 3-butèn-2-one sur le carvone :
- C'est enfin un coagulant inorganique très utilisé par certains processus de potabilisation de l'eau, sous forme de polychlorure d'aluminium (PAC)[7]. Il peut aussi dans ce cadre éliminer le fluor en excès dans l'eau. Pour ne pas contaminer l'eau potable par de l'aluminium et pour une bonne coagulation, le pH du processus de coagulation doit être bien maitrisé, de même que les doses utilisées[7]. L'agitation de l'eau doit être adéquate de même que le système de filtration (qui doit éliminer les agglomérats d'aluminium)[7]. Le chitosane et la bentonite sont des additifs utiles[7].
Sécurité
[modifier | modifier le code]AlCl3 peut provoquer une explosion s'il est mis en contact avec une base ou de l'eau. C'est un réactif à manier avec précaution, en utilisant des gants et des lunettes de sécurité. Il doit être manipulé sous une hotte. Lorsqu'il est manipulé à l'air humide, le chlorure d'aluminium absorbe rapidement l'humidité pour devenir hautement acide, et il attaque rapidement un grand nombre de matériaux dont notamment l'acier inoxydable et le caoutchouc.
Hexahydrate de chlorure d'aluminium
[modifier | modifier le code]Formule brute : AlCl3(H2O)6.
Ce produit, stable, n'est pas agressif pour la peau ; il entre même dans la composition de topiques cutanés en dermatologie (voir hyperhidrose).
C'est la forme la plus courante de conditionnement du chlorure d'aluminium quand on ne recherche pas le sel anhydre. Son numéro CAS est 7784-13-6. Sa masse molaire vaut 241,432 g/mol.
Principaux synonymes :
- Nom français : trichlorure d'aluminium hexahydraté ;
- Nom anglais : aluminum trichloride hexahydrate.
Voir aussi
[modifier | modifier le code]Références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) « The AlCl3 (D015) Structure », sur cst-www.nrl.navy.mil (consulté le ).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- S.I. Troyanov, Zhurnal Neorganicheskoi Khimii, 37, 266 (1992).
- Sohrabi Y., Shokoohizadeh M.J., Tabar F.R., Mirzaei N., Bagheri A., Ghadiri S.K., … et Charganeh S.S. (2018), Surveying the utilization of aluminum chloride in water treatment, Advanced Scientific Research (résumé).
Bibliographie
[modifier | modifier le code]- N. N. Greenwood et A. Earnshaw, Chemistry of the Elements, Pergamon Press, Oxford, UK, 1984.
- Handbook of Chemistry and Physics, 71e éd., CRC Press, Ann Arbor, Michigan, 1990.
- G. A. Olah (éd.), Friedel-Crafts and Related Reactions, vol. 1, Interscience, New York, 1963.
- L. G. Wade, Organic Chemistry, 5e éd., Prentice Hall, Upper Saddle River, New Jersey, USA, 2003.
- P. Galatsis, dans Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents (H. J. Reich et J. H. Rigby, éds.), p. 12-15, Wiley, New York, 1999.
- B. B. Snider, Accounts of Chemical Research, 13, 426, 1980.


 French
French Deutsch
Deutsch



![{\displaystyle {\ce {[Al(H2O)6]^3+ + H2O <=> [Al(H2O)5OH]^2+ + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca99634e7b52aac56a62d879a5eccde92f41ea87)