Pinacol — Wikipédia
| Pinacol | ||
 | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2,3-diméthylbutane-2,3-diol | |
| Synonymes | tétraméthyléthylène glycol, 1,1,2,2-tétraméthyléthylène glycol, pinacone | |
| No CAS | ||
| No ECHA | 100.000.849 | |
| No CE | 200-933-5 | |
| No RTECS | EK1720000 | |
| PubChem | 6425 | |
| SMILES | ||
| InChI | ||
| Apparence | solide jaune clair[1] | |
| Propriétés chimiques | ||
| Formule | C6H14O2 [Isomères] | |
| Masse molaire[2] | 118,174 2 ± 0,006 4 g/mol C 60,98 %, H 11,94 %, O 27,08 %, | |
| Propriétés physiques | ||
| T° fusion | 40 à 43 °C[1] | |
| T° ébullition | 171 à 172 °C (985 hPa)[1] | |
| Point d’éclair | 77 °C (coupelle fermée)[1] | |
| Précautions | ||
| SGH[1] | ||
| H228, H315 et P210 | ||
| NFPA 704[1] | ||
| Écotoxicologie | ||
| DL50 | 3 380 mg kg−1 (souris, oral)[3] | |
| LogP | 0,540[4] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
Le pinacol ou 2,3-diméthylbutane-2,3-diol est un composé organique de la famille des diols vicinaux. Il se présente sous la forme d'un solide jaune clair.
Synthèse
[modifier | modifier le code]Le pinacol peut être produit par la réaction de couplage pinacolique à partir de l'acétone[5] :
Réactions
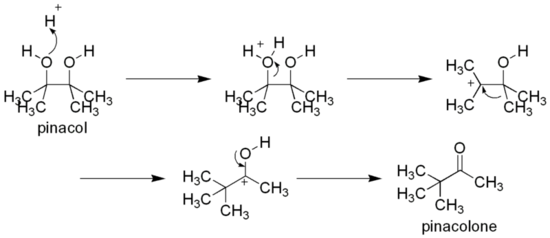
[modifier | modifier le code]Comme les diols vicinaux, il peut se réarranger en une cétone — la pinacolone — par le réarrangement pinacolique, par exemple en le chauffant en présence d'acide sulfurique[6] :
Le pinacol peut réagir avec le borane ou le trichlorure de bore pour produire des intermédiaires synthétiques utiles tels que le pinacolborane, le bis(pinacolato)dibore[7] et le pinacolchloroborane.
Utilisations
[modifier | modifier le code]Le pinacol a peu d'usages industriels. Comme précurseur de la synthèse du soman, gaz de combat neurotoxique aujourd'hui interdit, il fait l'objet d'un suivi par la Convention sur l'interdiction des armes chimiques.
Notes et références
[modifier | modifier le code]- Fiche Sigma-Aldrich du composé Pinacol, consultée le 24 juin 2012.
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Food and Cosmetics Toxicology, vol. 14, p. 841, 1976.
- ↑ (en) « Pinacol », sur ChemIDplus (consulté le 24 juin 2012).
- ↑ Roger Adams et E. W. Adams, Pinacol Hydrate, Org. Synth., coll. « vol. 1 », p. 459
- ↑ G. A. Hill et E. W. Flosdorf, Pinacolone, Org. Synth., coll. « vol. 1 », , p. 462
- ↑ Tatsuo Ishiyama, Miki Murata, Taka-aki Ahiko et Norio Miyaura, Bis(pinacolato)diboron, Org. Synth., coll. « vol. 10 », , p. 115
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pinacol » (voir la liste des auteurs).


 French
French Deutsch
Deutsch