Séquençage 454 — Wikipédia
Le séquençage 454 est une technique de séquençage de l'ADN basée sur l'amplification de l'ADN par PCR en émulsion et sur le pyroséquençage. Elle a été développée par la société Roche Diagnostics. Cette technique permet le séquençage d'un grand nombre de bases en peu de temps.
Préparation des librairies d’ADN simple brin
[modifier | modifier le code]
L’ADN provenant de l’échantillon biologique est fragmenté mécaniquement (fragmentation aléatoire) en utilisant par exemple la nébulisation. Avant d’ajouter les adaptateurs nécessaires à l’étape de PCR en émulsion et à la réaction de séquençage (adaptateur A et adaptateur B), les fragments d’ADN double brin doivent être réparés pour posséder des extrémités franches compatibles avec les extrémités des adaptateurs. Pour cela, l’ADN est traité avec le fragment de Klenow qui possède une activité exonucléase 3'→5' et une activité polymérase 5'→3'. Ces deux activités permettent d’obtenir, à partir d’extrémités cohésives produites par la fragmentation mécanique, les extrémités franches assurant la ligature avec les adaptateurs.
Les adaptateurs sont ajoutés à l’ADN en présence de ligase. Pour éviter l’association de plusieurs molécules d’adaptateurs entre elles celles-ci sont dé-phosphorylées sur leurs extrémités 5’. La ligature n’étant pas orientée, les fragments d’ADN peuvent être bornés par deux adaptateurs A, deux adaptateurs B ou un de chaque. Seuls les fragments correspondant à ce dernier cas de figure pourront être amplifiés lors de l’étape suivante et donc par la suite séquencés. Afin de purifier ce type de fragment, l’adaptateur B est biotinylé sur l’un de ses brins. Les fragments sont ensuite mis en contact avec des billes sur lesquelles se trouve de la streptavidine. Les fragments uniquement bornés par deux adaptateurs A ne pourront donc pas être récupérés sur ces billes et seront donc éliminés. L’ADN fixé sur ces billes subit alors une dénaturation et seuls les molécules d’ADN simple brin bornées par un adaptateur A et un adaptateur B pourront se décrocher des billes. En effet, les deux brins d’ADN des molécules possédant deux adaptateurs B restent piégés par les billes.
La PCR en émulsion (EmPCR)
[modifier | modifier le code]
L’ADN simple brin est mis en contact avec des billes sur lesquelles sont fixées par l’extrémité 5’ des amorces A (billes A) ou B (billes B) respectivement complémentaires de la séquence de l’un ou l’autre des adaptateurs. En respectant un ratio nombre de molécules d’ADN/nombre de billes, on va fixer un seul fragment d’ADN sur chaque bille. Les billes sont ensuite mises dans une émulsion contenant les composés nécessaires à la réaction de polymérisation en chaîne et permettant d’individualiser chaque bille. Chaque goutte d’émulsion devient un microréacteur dans lequel l’unique fragment d’ADN fixé sur la bille va pouvoir être amplifié. En prenant l’exemple des billes B, au cours du premier cycle de PCR, l’amorce B associée au fragment d’ADN initial va assurer la synthèse de son brin complémentaire. Au cycle suivant, après dénaturation, la molécule d’ADN simple néo-synthétisée reste fixée sur la bille et va être utilisée pour la synthèse d’une autre matrice à partir de l’amorce A présente dans le milieu réactionnel. La molécule d’ADN simple brin de départ est quant à elle réutilisée par une autre amorce B fixée sur la bille. Après plusieurs cycles de PCR la bille est ainsi recouverte de plusieurs millions de molécules d’ADN simple brin identiques fixées par l’amorce B et orientées 5’ → 3’ de la bille vers l’extérieur.
La réaction de Pyroséquençage
[modifier | modifier le code]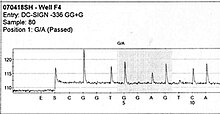
Après amplification, on dépose les billes sur une plaque PTP (Pico Titer Plate) contenant plusieurs millions de puits dont les diamètres vont permettre de ne récupérer qu’une seule bille. C’est au sein de chacun de ces puits que va se réaliser la réaction de pyroséquençage. Contrairement à un séquençage de type Sanger, les types de nucléotides (A, T, C, G) seront rajoutés de manière séquentielle et ce plusieurs fois de suite définissant ainsi le « flow cycle ». Après chaque ajout d’un nucléotide, un traitement par une apyrase permet d’éliminer le surplus, puis le nucléotide suivant est incorporé et ainsi de suite. La détermination de la séquence repose sur la mise en évidence d’une émission de lumière résultant de l’incorporation d’un ou plusieurs nucléotides lors de la polymérisation de l’ADN en utilisant le brin d’ADN fixé sur la bille comme matrice. L’amorce A (dans le cas de billes B) est utilisée pour initier cette polymérisation. Si le nucléotide ajouté correspond à celui devant être intégré son incorporation il y a libération de pyrophosphate inorganique. Celui-ci est alors utilisé par l’ATPsulphurylase pour produire de l’ATP. La luciférase utilise cet ATP et la luciférine pour produire de l’oxyluciférine et de la lumière Le signal lumineux est capté par un capteur CDD (Charge-Coupled Device) et les résultats sont présentés sous forme d’un pyrogramme.
Tous les résultats sont ensuite analysés grâce aux techniques de la bioinformatique et vont permettre l’identification de la séquence initiale d’ADN.
Notes et références
[modifier | modifier le code]Internet :
• www.roche.com/
• http://454.com/products/technology.asp
Article :
• « Les technologies de Laboratoires. » N°-, tiré de www.technolabo.ma/TL5-1.pdf
• « Nouvelles technologies de séquençage :quelques applicationsen écologie moléculaire. », Jawad Abdelkrim. 19 déc. 2007 tiré de http://gepv.univ-lille1.fr/downloads/enseignements/M2-S9/M2-S9-Abdelkrim-NouvTechSeq.pdf


 French
French Deutsch
Deutsch