Formaldeide
| Formaldeide | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| formaldeide (preferito) metanale (sistematico) | |
| Nomi alternativi | |
| aldeide fòrmica formalina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH2O |
| Massa molecolare (u) | 30,03 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 200-001-8 |
| PubChem | 712 |
| DrugBank | DBDB03843 |
| SMILES | C=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,13 (a −19 °C) |
| Temperatura di fusione | −116,9 °C (156,2 K) |
| Temperatura di ebollizione | −19,0 °C (254,1 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −108,6 |
| ΔfG0 (kJ·mol−1) | −102,5 |
| S0m(J·K−1mol−1) | 218,8 |
| C0p,m(J·K−1mol−1) | 35,4 |
| Indicazioni di sicurezza | |
| Punto di fiamma | −53 °C (220 K) |
| Limiti di esplosione | 7 - 73% vol. |
| Temperatura di autoignizione | 430 °C (703 K) |
| Simboli di rischio chimico | |
     | |
| pericolo | |
| Frasi H | 350 - 341 - 301 - 311 - 331 - 314 - 317 |
| Consigli P | 301+310 - 303+361+353 - 305+351+338 - 320 - 361 - 405 - 501 [1] |
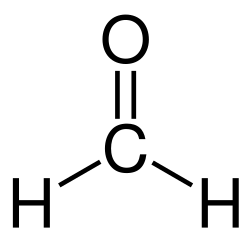
La formaldeide (o aldeide fòrmica, nome IUPAC: metanale) è un composto organico la cui formula molecolare è CH2O. Si tratta dell'aldeide più semplice, composta dal gruppo funzionale carbonilico (C=O) e due atomi di idrogeno.[2] Strutturalmente può essere rappresentata anche così: H2C=O.[3] A pressione e temperatura ambiente, si presenta come un gas incolore,[4] dal caratteristico odore pungente e fortemente irritante.[5]
A causa della mancanza di un gruppo funzionale alchilico (−R) legato al carbonile, come invece accade per tutte le altre aldeidi (R−CHO) e per tutti gli altri chetoni (R2−CO), la formaldeide ha delle significative differenze di reattività.[6]
Rientra nel gruppo 1 delle sostanze classificate dall'Agenzia internazionale per la ricerca sul cancro (IARC) in quanto ha mostrato evidenze di cancerogenicità per l'uomo.[7]
Storia
[modifica | modifica wikitesto]Osservazioni astronomiche risalenti al 1969 hanno trovato formaldeide in comete, asteroidi e altri oggetti orbitanti attorno al Sole. Questo suggerisce che essa possa essere stata una delle prime molecole organiche formatisi nell'universo primordiale.[8]
La formaldeide fu sintetizzata per la prima volta nel 1859 dal chimico russo Aleksandr Butlerov. Nel suo articolo, Butlerov si riferiva alla formaldeide come "diossimetilene" (o biossido di metilene), sbagliando la sua formula empirica (C4H4O4). Fu definitivamente identificata dal chimico tedesco August Wilhelm von Hofmann, che per primo annunciò la produzione di formaldeide facendo passare il vapore di metanolo nell'aria su un filo di platino caldo. Con modifiche, il metodo di Hoffmann rimane la base dell'attuale percorso industriale.[8][9]
Dagli anni 1880 in poi la produzione industriale di formaldeide è cresciuta sempre di più fino ad arrivare ai giorni nostri con una produzione annuale mondiale di circa 4 milioni di tonnellate.[8]
Caratteristiche chimico-fisiche
[modifica | modifica wikitesto]
Gassosa a temperatura ambiente, si trova commercialmente in due forme: come formalina, una soluzione acquosa al 37%, o come paraformaldeide, cioè una miscela di prodotti di polimerizzazione della formaldeide, prevalentemente poliossimetileni con grado di polimerizzazione da 8 a 100 unità; in particolare forma l'1,3,5-triossano, una molecola eterociclica formata dall'unione di tre molecole di formaldeide. La ciclizzazione, favorita da un ambiente acido, è una reazione reversibile. La paraformaldeide può essere riconvertita in glicole metilenico.
In soluzione acquosa, la formaldeide è in equilibrio con la sua forma idrata, il metandiolo. Tale equilibrio a temperatura ambiente è quasi completamente spostato a destra (K > 1000); pertanto una "soluzione acquosa di formaldeide" è di fatto una soluzione acquosa di metandiolo.[10]

Le sue soluzioni acquose sono incolori e posseggono un odore caratteristico.
Struttura
[modifica | modifica wikitesto]La formaldeide è un composto termodinamicamente alquanto stabile, ΔHƒ° = -115,90 kJ/mol.[11] La sua molecola è planare, simmetria C2v,[12] ed è notevolmente polare, μ = 2,332 D,[13] più di H2O (1,86 D). L'atomo di carbonio ha ibridazione sp2 ed è al centro di un triangolo non esattamente equilatero, ai cui vertici si trovano i due atomi di idrogeno e quello di ossigeno.
Da indagini spettroscopiche rotazionali nella regione delle microonde risulta che la lunghezza dei legami C–H è di 111,6 pm, quella del legame C–O di 120,78 pm e che l'angolo HCO è di 121,8° (da cui segue che l'angolo HCH è di 116,4°).[14][15]
Quest'ultimo è un valore lievemente minore dell'angolo ideale (120°) per l'ibridazione sp2, ma questo è in accordo qualitativo con la previsione del modello VSEPR, per il quale un doppio legame (qui C=O) richiede più spazio angolare rispetto a un legame singolo;[16][17] fenomeni analoghi si hanno anche, ad esempio, per l'acetaldeide (117,5°),[18] per l'acetone (116°),[19] ma anche per l'etene e il fosgene.
Reattività
[modifica | modifica wikitesto]La formaldeide è il composto più semplice che contiene il carbonile, cioè il gruppo funzionale bivalente >C=O, dove il doppio legame, a causa della maggiore elettronegatività dell'ossigeno, è polarizzato (δ+C=Oδ−), cosa che facilita reazioni di attacco di nucleofili sul carbonio, ma che non avviene per un alchene, il quale contiene un doppio legame non polarizzato (C=C).[20]
La formaldeide presenta il tipico comportamento chimico delle aldeidi, con la differenza significativa di mostrare una maggiore reattività e, a volte, una reattività di tipo specifico, anche differente. Ad esempio, è l'unica aldeide che per progressiva ossidazione in condizioni non drastiche, arriva a formare l'anidride carbonica (CO2, C+4), passando per l'acido formico nello stadio intermedio, mentre le altre sono facili da ossidare ai corrispondenti acidi carbossilici (R−COOH, C+3) ma poi lì si fermano, non volendo forzare le condizioni.[21] Altri esempi di specificità, nel seguito.
Minor ingombro sterico
[modifica | modifica wikitesto]La maggiore reattività della formaldeide dipende anche, in certa misura, dal fatto che il suo carbonile ha l'ingombro sterico che è il minimo possibile; questo si può riscontrare nelle condizioni più blande che sono richieste per la sua idrogenazione catalitica, che fornisce il metanolo.[22]
Maggior polarizzazione
[modifica | modifica wikitesto]La reattività dei composti carbonilici può essere sintetizzata nella scala seguente:[23]
H2C=O > RHC=O > RR'C=O
Un altro fattore che rende la formaldeide più reattiva è che essa non ha alcun alchile (gruppo a rilascio elettronico) legato al carbonile[24] e questo fa sì che tale carbonile sia un po' più elettrofilo rispetto a quello delle altre aldeidi; questo consente maggiore reattività nei confronti di nucleofili, a partire dall'acqua: mentre nella soluzione acquosa di formaldeide il metandiolo è del 99,99%, in quella di acetaldeide si scende al 58% di 1,1-etandiolo e per l'acetone l'idrato è trascurabile.[25]
I nucleofili vengono addizionati al carbonile della formaldeide, alcuni reversibilmente (ioni alogenuro, ione ossidrile), altri permanentemente, come nei casi di cianuri, acetiluri, ioni idrogenosolfito, carbanioni organometallici (reattivi di Grignard R−MgX, composti di alchil-litio R−Li); questi addotti intermedi vengono poi trattati con acidi diluiti e si ottengono così i corrispondenti composti stabili, che sono alcoli primari eventualmente sostituiti (ogni altra aldeide dà alcoli secondari):[26]
N≡C− + CH2=O → N≡C−CH2−O− → (+H+) → N≡C−CH2OH (la cianidrina)
H-C≡C− + CH2=O → H-C≡C−CH2−O− → (+H+) → HC≡C−CH2OH (alcol propargilico)
CH3−MgBr + CH2=O → CH3−CH2−O−MgBr → (+HX) → CH3−CH2OH (alcol etilico) + MgBrX
Con nucleofili all'azoto la formaldeide reagisce in certi casi in maniera diversa dalle altre aldeidi: con l'ammoniaca in soluzione acquosa si forma l'esametilentetrammina con ottima resa, attraverso diversi stadi intermedi di addizione ed eliminazione,[27] mentre le altre non danno composti ben definiti:
4 NH3 + 6 CH2O → C6H12N4
Reazione di Cannizzaro
[modifica | modifica wikitesto]Per riscaldamento con basi forti concentrate, subisce la reazione di Cannizzaro, tipica delle aldeidi prive di idrogeni in alfa, trasformandosi in acido formico e metanolo. Questa è una reazione disproporzione, ossia una reazione in cui una molecola subisce un'ossidazione mentre un'altra molecola uguale subisce una riduzione.[28] Può anche partecipare a reazioni di Cannizzaro incrociate: con la benzaldeide, ad esempio, si ha come risultato l'alcool benzilico e l'acido formico.
Condensazioni aldoliche incrociate
[modifica | modifica wikitesto]La formaldeide da sola, non avendo idrogeni in alfa, non può dare le condensazioni aldoliche ma, anche qui, può dare quelle incrociate con altra aldeide con idrogeni in alfa. L'acetaldeide ad esempio, che può enolizzare, reagendo in ambiente basico e a temperatura moderata con la formaldeide in eccesso, addiziona tre molecole di formaldeide a dare la tris(idrossimetil)acetaldeide (condensazione aldolica); questa molecola, una volta formata, non ha più idrogeni in alfa; a questo punto, riscaldando unteriormente, avviene una reazione di Cannizzaro incrociata con una quarta molecola di formaldeide che, dopo la cattura di un ossidrile, funge da donatrice di idruro, per cui si formano l'acido formico e il pentaeritritolo:[29]
CH3−CHO + 3 CH2O → (CH2-OH)3C−CHO
(CH2-OH)3C−CHO + CH2O → HCOOH + C(CH2-OH)4
Addizioni elettrofile e sostituzioni elettrofile aromatiche
[modifica | modifica wikitesto]Quando poi il carbonile della formaldeide viene protonato o comunque attivato dall'interazione con forti acidi di Lewis, il suo atomo di carbonio diviene ancora più elettrofilo:
H2CO + H+ ⇄ [ H2C=O+–H ↔ H2C+–O–H ]
In quanto tale, diviene capace di attaccare olefine dando addizioni elettrofile e anelli aromatici dando le reazioni di sostituzione elettrofila aromatica.
Chimica ionica in fase gassosa
[modifica | modifica wikitesto]La molecola H2C=O ha un potenziale di ionizzazione pari a 10,88 eV,[30] un po' più alto di quello dell'acetaldeide CH3-CHO (10,23 eV)[31] e significativamente maggiore dell'acetone (CH3)2CO (9,70 eV).[32]
L'affinità elettronica della formaldeide porta a uno ione radicale distonico[33] non planare[34] e risulta sperimentalmente negativa (-0,65±0,05 eV, valore adiabatico).[35]
L'affinità protonica della formaldeide, che è una misura della sua basicità intrinseca, è pari a 712,9 kJ/mol:[36]
- H2C=O (g) + H+ (g) → [ H2C=O+–H ↔ H2C+–O–H ] (g)
Questo valore dell'affinità protonica è ben maggiore di quello dell'acqua (691 kJ/mol), che quindi è meno basica,[37] ma inferiore a quello dell'acetaldeide (768,5 kJ/mol)[31] e ancor più rispetto a quello dell'acetone, (812 kJ/mol),[32] entrambi essendo quindi più basici della formaldeide: l'affinità protonica cresce al crescere dei metili uniti al carbonile, evidenziando la loro maggiore capacità, rispetto ad H, di stabilizzare centri con carica positiva (effetto induttivo +I), come accade anche per i potenziali di ionizzazione visti sopra.
Come fa il protone H+, anche lo ione Li+ può legarsi in fase gassosa alla formaldeide, ma l'energia liberata è molto minore, 151 kJ/mol e così pure accade con lo ione Al+ (115 kJ/mol) e lo ione Fe+ (138 kJ/mol).[38]
Produzione
[modifica | modifica wikitesto]Sintesi di laboratorio
[modifica | modifica wikitesto]Il metodo inventato da Hoffmann nel 1868 rimane la base dell'attuale percorso industriale, sebbene con alcune modifiche. Si fa passare il vapore di metanolo nell'aria su un filo di platino caldo.
Le vie di sintesi in soluzione alla formaldeide comportano anche l'ossidazione del metanolo o dello ioduro di metile.
Sintesi industriale
[modifica | modifica wikitesto]La formaldeide è prodotta industrialmente dall'ossidazione catalitica del metanolo. I catalizzatori più comuni sono l'argento metallico o una miscela di un ossido di ferro e ossidi di molibdeno o vanadio. Nel processo Formox comunemente usato, il metanolo e l'ossigeno reagiscono a 250-400 °C in presenza di ossido di ferro in combinazione con molibdeno e/o vanadio per produrre formaldeide:
Il catalizzatore a base d'argento normalmente opera a una temperatura più alta, circa 650 °C. Due reazioni chimiche su di esso producono simultaneamente formaldeide: quella mostrata sopra e la reazione di deidrogenazione:
In linea di principio, la formaldeide potrebbe essere generata dall'ossidazione del metano, ma questa via non è praticabile industrialmente perché il metanolo è più facilmente ossidabile del metano.
Sintesi biologica
[modifica | modifica wikitesto]La formaldeide viene prodotta tramite diverse vie catalizzate da enzimi.[39] Gli esseri viventi, compresi gli esseri umani, producono formaldeide come parte del loro metabolismo. La formaldeide è fondamentale per diverse funzioni corporee (ad esempio l'epigenetica)[40], ma la sua quantità deve anche essere strettamente controllata per evitare l'auto-avvelenamento.[41]
- La serina idrossimetiltransferasi può scomporre la serina in formaldeide e glicina;
- I microbi metilotrofi convertono il metanolo in formaldeide ed energia tramite la metanolo deidrogenasi: CH3OH → CH2O + 2e− + 2H+
- Altre vie per la sintesi di formaldeide includono demetilazioni ossidative, ammine ossidasi sensibili alla semicarbazide, dimetilglicina deidrogenasi, perossidasi lipidiche, ossidasi P450 e demetilasi del gruppo N-metilico.[39]
La formaldeide viene catabolizzata dall'alcol deidrogenasi ADH5 e dall'aldeide deidrogenasi ALDH2.[42]
Utilizzi
[modifica | modifica wikitesto]La formaldeide è un importante intermedio, utilizzato nella produzione di composti e materiali più complessi. In ordine approssimativo di consumo decrescente, i prodotti generati a partire dalla formaldeide includono la resina urea formaldeide, la resina melamminica, le resine fenoliche, il poliossimetilene, l'1,4-butandiolo e il difenilmetano diisocianato. L'industria tessile utilizza resine a base di formaldeide nel finissaggio per rendere i tessuti resistenti alle pieghe.
In particolare, se trattata con fenolo, urea o melammina, la formaldeide produce, rispettivamente, resina fenolo-formaldeide (un polimero duro e termoindurente), resina urea-formaldeide e resina melamminica. Questi polimeri sono adesivi permanenti utilizzati nel compensato e nella moquette, oltre che utilizzati per produrre schiume isolanti, o colati in prodotti stampati. La produzione di resine rappresenta più della metà del consumo di formaldeide.
La formaldeide è anche un precursore di alcoli polifunzionali come il pentaeritritolo, che viene utilizzato per produrre vernici ed esplosivi. Altri derivati della formaldeide includono metilene difenil diisocianato, un componente importante nelle vernici e nelle schiume poliuretaniche, e l'esametilentetrammina, che viene utilizzata nelle resine fenolo-formaldeide e nell'esplosivo RDX.
Usi quantitativamente meno significativi sfruttano le proprietà battericide della formaldeide; per questo motivo, soluzioni acquose che la contengono trovano largo impiego come disinfettanti per uso domestico; nella produzione di tessuti a livello industriale viene utilizzata come battericida. Soluzioni di formaldeide vengono anche utilizzate per conservare campioni di materiale biologico. Trova del resto vasto impiego anche nelle tecniche di imbalsamazione.
Viene anche utilizzata in soluzione acquosa (formalina) per la produzione di vaccini, sia per produrre anatossine (o tossoidi), cioè tossine che perdono la tossicità ma mantengono la immunogenicità, a partire da tossine batteriche, sia per produrre vaccini basati su microrganismi uccisi. La maggior parte della formaldeide prodotta è destinata però alla produzione di polimeri e di altri composti chimici.
Tra gli additivi alimentari è identificata dalla sigla E 240, ed è usata come conservante. Difatti è presente nel fumo di legno ed è, insieme ai polifenoli, responsabile della conservazione dei prodotti alimentari affumicati. La formaldeide, insieme all'urea, è impiegata come vernice collante di pannelli in legno di truciolato, nobilitato o Medium-density fibreboard (MDF); è contenuta, inoltre, nei pannelli fonoassorbenti dei controsoffitti e nelle pareti divisorie degli uffici open space. Negli anni tende a volatilizzarsi nell'ambiente circostante. Viene utilizzata per la produzione di isoprenolo. Nella tintura tessile è usata nell'applicazione con i naftoli per dare maggiore stabilità alle soluzioni naftoliche e nel trattamento successivo di alcune tinture ottenute con coloranti diretti con lo scopo di migliorarne la solidità all'acqua ed ai lavaggi in generale.
Effetti sulla salute umana
[modifica | modifica wikitesto]Dato il largo impiego di resine derivate dalla formaldeide nelle produzioni di manufatti, rivestimenti e schiume isolanti, considerato che queste tendono a rilasciare nel tempo molecole di formaldeide nell'ambiente, la formaldeide è uno dei più diffusi inquinanti di interni. A concentrazioni nell'aria superiori a 0,1 ppm può irritare per inalazione le mucose e gli occhi. L'ingestione o l'esposizione a quantità consistenti sono potenzialmente letali. La cancerogenicità è stata accertata sui roditori, dove la formaldeide provoca un tasso di incidenza di cancro al naso ed alla gola superiori al normale; la formaldeide è in grado di interferire con i legami tra DNA e proteine.
L'Agenzia Internazionale per la Ricerca sul Cancro (AIRC) sin dal 2004 ha inserito la formaldeide nell'elenco delle sostanze considerate con certezza cancerogene per la specie umana[7]. Va considerato che le concentrazioni di formaldeide presenti normalmente all'interno degli edifici sono generalmente basse, mentre vanno accuratamente valutati i rischi per gli addetti alle lavorazioni industriali che impiegano formaldeide.
L'Organizzazione Mondiale della Sanità ha indicato, come limite massimo di concentrazione accettabile di formaldeide in casa, 100 microgrammi / metrocubo (pari a 0,1 parti per milione - ppm). Fino al momento in cui il prodotto è stato bandito, era uno degli ingredienti delle pastiglie Formitrol per il mal di gola.
Dal 1º gennaio 2016, la formaldeide è passata dalla classificazione di "sospettato di provocare il cancro" a "può provocare il cancro" (Regolamento (UE) N. 605/2014).
Scandali
[modifica | modifica wikitesto]Scandali sono scoppiati sia nel 2005, con la crisi alimentare in Indonesia, sia nel 2007, con la crisi alimentare in Vietnam, in merito all'aggiunta di formaldeide agli alimenti per prolungarne la durata di conservazione. Nel 2011, dopo un'assenza di quattro anni, le autorità indonesiane hanno trovato alimenti con formaldeide venduti nei mercati di diverse regioni del paese. Nell'agosto 2011, almeno in due supermercati Carrefour, il sottodipartimento di bestiame e pesca di Central Jakarta ha trovato cendol contenente 10 ppm di formaldeide.
Nel 2014, il proprietario di due fabbriche di noodle a Bogor, in Indonesia, è stato arrestato per aver utilizzato formaldeide nei noodle.
In alcuni luoghi, come la Cina, i produttori usano ancora la formaldeide illegalmente come conservante negli alimenti, il che espone le persone all'ingestione di formaldeide.
Nei primi anni del 1900, veniva spesso aggiunta dagli stabilimenti del latte statunitensi alle bottiglie del latte come metodo di pastorizzazione a causa della mancanza di conoscenza e preoccupazione riguardo alla tossicità della formaldeide.
Note
[modifica | modifica wikitesto]- ^ scheda della formaldeide in soluzione acquosa al 25% su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ CHAPTER 1. Introduction to Formaldehyde, Royal Society of Chemistry, 2018, pp. 1–19, DOI:10.1039/9781788010269-00001, ISBN 978-1-78262-973-3. URL consultato il 17 febbraio 2024.
- ^ (EN) Aldehyde | Definition, Structure, Examples, & Facts | Britannica, su www.britannica.com, 26 agosto 2024. URL consultato il 18 ottobre 2024.
- ^ GESTIS-Stoffdatenbank, su gestis.dguv.de. URL consultato il 17 febbraio 2024.
- ^ (EN) PubChem, Formaldehyde, su pubchem.ncbi.nlm.nih.gov. URL consultato il 27 luglio 2022.
- ^ R.O.C. Norman, CHIMICA ORGANICA Principi e Applicazioni alla Sintesi, traduzione di Paolo Da Re, Piccin, 1973, p. 566.
- ^ a b (EN) IARC Monographs on the Evaluation of Carcinogenic Risks to Humans - Vol. 88 (PDF), su monographs.iarc.fr. URL consultato il 18 settembre 2012 (archiviato dall'url originale il 14 novembre 2009).
- ^ a b c (EN) History of Formaldehyde, su Formacare. URL consultato il 3 novembre 2024.
- ^ CHAPTER 1. Introduction to Formaldehyde, Royal Society of Chemistry, 2018, pp. 1–19, DOI:10.1039/9781788010269-00001, ISBN 978-1-78262-973-3. URL consultato il 3 novembre 2024.
- ^ Kinetics and chemical equilibrium of the hydration of formaldehyde (PDF), su dissertations.ub.rug.nl (archiviato dall'url originale il 21 luglio 2013).
- ^ M. W. Chase, NIST-JANAF Themochemical Tables, Fourth Edition, 1998, pp. 1–1951. URL consultato il 16 febbraio 2024.
- ^ CCCBDB listing of experimental data page 2, su cccbdb.nist.gov. URL consultato il 1º agosto 2022.
- ^ Patrice Theulé, Andrea Callegari e Thomas R. Rizzo, Fluorescence detected microwave Stark effect measurements in excited vibrational states of H2CO, in The Journal of Chemical Physics, vol. 119, n. 17, 1º novembre 2003, pp. 8910–8915, DOI:10.1063/1.1614771. URL consultato il 16 febbraio 2024.
- ^ (EN) Takeshi Oka, Microwave Spectrum of Formaldehyde II. Molecular Structure in the Ground State, in Journal of the Physical Society of Japan, vol. 15, n. 12, 1960-12, pp. 2274–2279, DOI:10.1143/JPSJ.15.2274. URL consultato l'8 giugno 2022.
- ^ (EN) Kojiro Takagi e Takeshi Oka, Millimeter Wave Spectrum of Formaldehyde, in Journal of the Physical Society of Japan, vol. 18, n. 8, 1963-08, pp. 1174–1180, DOI:10.1143/JPSJ.18.1174. URL consultato l'8 giugno 2022.
- ^ G. L. Miessler e D. A. Tarr, Inorganic Chemistry, 2nd, Prentice-Hall, 1999, pp. 54.–62, ISBN 978-0-13-841891-5.
- ^ J.E. Huheey, E.A. Keiter e R.L. Keiter, 6 - La struttura e la reattività delle molecole, in Chimica Inorganica, Seconda edizione italiana, sulla quarta edizione inglese, Piccin Nuova Libraria, Padova, 1999, pp. 209-223, ISBN 88-299-1470-3.
- ^ H. Hollenstein e Hs. H. Günthard, Solid state and gas infrared spectra and normal coordinate analysis of 5 isotopic species of acetaldehyde, in Spectrochimica Acta Part A: Molecular Spectroscopy, vol. 27, n. 10, 1º ottobre 1971, pp. 2027–2060, DOI:10.1016/0584-8539(71)80102-2. URL consultato il 17 febbraio 2024.
- ^ (EN) K. Kuchitsu (a cura di), Structure of Free Polyatomic Molecules, in SpringerLink, 1998, DOI:10.1007/978-3-642-45748-7. URL consultato il 17 febbraio 2024.
- ^ Francis A. Carey e Richard J. Sundberg, Advanced organic chemistry, 5th ed, Springer, 2007, pp. 43-44, ISBN 978-0-387-44897-8.
- ^ Robert T. Morrison e Robert N. Boyd, ORGANIC CHEMISTRY, 6ª ed., Prentice-Hall of India Private Limited, 2002, p. 634, ISBN 81-203-0765-8.
- ^ I. L. Finar, ORGANIC CHEMISTRY The fundamental principles, Fourth Edition, Longmans, 1963, pp. 149-150.
- ^ R. Fusco, G. Bianchetti e V. Rosnati, CHIMICA ORGANICA, volume primo, L. G. Guadagni, 1974, p. 575.
- ^ Un alchile è un gruppo a rilascio elettronico sia per effetto induttivo +I che per effetto iperconiugativo.
- ^ Michael B. Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, Wiley, 2020, p. 1095, ISBN 978-1-119-37180-9.
- ^ I. L. Finar, ORGANIC CHEMISTRY The fundamental principles, Fourth Edition, Longmans, 1963, pp. 151-153.
- ^ (EN) Ullmann's Encyclopedia of Industrial Chemistry, 1ª ed., Wiley, 11 marzo 2003, DOI:10.1002/14356007.a02_001, ISBN 978-3-527-30385-4. URL consultato il 16 febbraio 2024.
- ^ Peter Sykes, A guidebook to mechanism in organic chemistry, sesta, Longman, 1986, pp. 216-217, ISBN 978-0-582-44695-3.
- ^ R.O.C. Norman, CHIMICA ORGANICA Principi e Applicazioni alla Sintesi, traduzione di Paolo Da Re, Piccin, 1973, pp. 225-226.
- ^ (EN) Koichi Ohno, Kohji Okamura e Hideo Yamakado, Penning Ionization of HCHO, CH2CH2, and CH2CHCHO by Collision with He(23S) Metastable Atoms, in The Journal of Physical Chemistry, vol. 99, n. 39, 1995-09, pp. 14247–14253, DOI:10.1021/j100039a010. URL consultato il 1º agosto 2022.
- ^ a b (EN) Acetaldehyde, su webbook.nist.gov. URL consultato il 1º agosto 2022.
- ^ a b (EN) Acetone, su webbook.nist.gov. URL consultato il 1º agosto 2022.
- ^ Distonico, perché l'elettrone spaiato e la carica formale, negativa in questo caso, non sono sullo stesso atomo.
- ^ (EN) Joseph S. Francisco e John W. Thoman, Adiabatic ionization potential and electron affinity of formaldehyde, in Chemical Physics Letters, vol. 300, n. 5, 12 febbraio 1999, pp. 553–560, DOI:10.1016/S0009-2614(98)01447-X. URL consultato il 1º agosto 2022.
- ^ (EN) P. D. Burrow e J. A. Michejda, Electron transmission study of the formaldehyde electron affinity, in Chemical Physics Letters, vol. 42, n. 2, 1º settembre 1976, pp. 223–226, DOI:10.1016/0009-2614(76)80351-X. URL consultato il 1º agosto 2022.
- ^ (EN) Edward P. L. Hunter e Sharon G. Lias, Evaluated Gas Phase Basicities and Proton Affinities of Molecules: An Update, in Journal of Physical and Chemical Reference Data, vol. 27, n. 3, 1998-05, pp. 413–656, DOI:10.1063/1.556018. URL consultato il 30 giugno 2022.
- ^ (EN) Water, su webbook.nist.gov. URL consultato il 31 luglio 2022.
- ^ (EN) Formaldehyde, su webbook.nist.gov. URL consultato il 1º agosto 2022.
- ^ a b (EN) Jos J. A. G. Kamps, Richard J. Hopkinson e Christopher J. Schofield, How formaldehyde reacts with amino acids, in Communications Chemistry, vol. 2, n. 1, 7 novembre 2019, pp. 1–14, DOI:10.1038/s42004-019-0224-2. URL consultato il 3 novembre 2024.
- ^ (EN) Vanha N. Pham, Kevin J. Bruemmer e Joel D. W. Toh, Formaldehyde regulates S -adenosylmethionine biosynthesis and one-carbon metabolism, in Science, vol. 382, n. 6670, 3 novembre 2023, DOI:10.1126/science.abp9201. URL consultato il 3 novembre 2024.
- ^ (EN) Jiaxin Chen, Wenhui Chen e Jinjia Zhang, Dual effects of endogenous formaldehyde on the organism and drugs for its removal, in Journal of Applied Toxicology, vol. 44, n. 6, 2024-06, pp. 798–817, DOI:10.1002/jat.4546. URL consultato il 3 novembre 2024.
- ^ Jun Nakamura, Darcy W. Holley e Toshihiro Kawamoto, The failure of two major formaldehyde catabolism enzymes (ADH5 and ALDH2) leads to partial synthetic lethality in C57BL/6 mice, in Genes and Environment, vol. 42, n. 1, 3 giugno 2020, pp. 21, DOI:10.1186/s41021-020-00160-4. URL consultato il 3 novembre 2024.
Bibliografia
[modifica | modifica wikitesto]- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 37-42, ISBN 3-527-30578-5.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «formaldeide»
Wikizionario contiene il lemma di dizionario «formaldeide» Wikimedia Commons contiene immagini o altri file su formaldeide
Wikimedia Commons contiene immagini o altri file su formaldeide
Collegamenti esterni
[modifica | modifica wikitesto]- formalina, su sapere.it, De Agostini.
- (EN) formaldehyde, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) ChemSub Online: Formaldeide, su chemsub.online.fr.
- Formaldeide, sulla Matrice di esposizione a cancerogeni - MATline, su dors.it.
| Controllo di autorità | Thesaurus BNCF 21880 · LCCN (EN) sh85050805 · GND (DE) 4017845-6 · BNF (FR) cb12062041r (data) · J9U (EN, HE) 987007545720905171 · NDL (EN, JA) 00563450 |
|---|


 French
French Deutsch
Deutsch
