Selenocisteina
| Selenocisteina | |
|---|---|
 | |
| Nome IUPAC | |
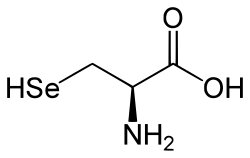
| acido 3-selenil-2(R)-amminopropanoico | |
| Abbreviazioni | |
| U J SEC | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H7NO2Se |
| Massa molecolare (u) | 168,1 |
| Numero CAS | |
| Numero EINECS | 808-428-7 |
| PubChem | 25076 e 163189568 |
| DrugBank | DBDB02345 |
| SMILES | C(C(C(=O)O)N)[SeH] |
| Indicazioni di sicurezza | |
La selenocisteina (SEC) è un amminoacido naturale, osservato per la prima volta nel 1986. È il 21° amminoacido conosciuto, considerato marginale fino alla scoperta di un ulteriore amminoacido, il 22°, la pirrolisina.
Non è un derivato della cisteina, ma deriva dalla serina. Il nome è dovuto alla sua struttura, simile a quella della cisteina ma con un atomo di selenio al posto di quello di zolfo. È codificato dal codone UGA, normalmente un codone di stop, che tuttavia in presenza di un particolare segmento di mRNA viene interpretato come elemento costitutivo.
La amminoacilazione del tRNA per la selenocisteina è indiretta e prevede prima il caricamento di un residuo di serina sul proprio tRNA da parte della Ser-RS. Successivamente un enzima detto SelA, con cofattore PLP, catalizza la trasformazione della serina in selenocisteina. In ultimo, questo amminoacido viene portato al ribosoma da un analogo di EF-Tu detto SelB.
La mancanza di selenio nella dieta provoca la malattia di Keshan. Questa rara cardiomiopatia è diffusa nelle regioni del mondo ove la quantità di selenio nel suolo, e quindi nell'alimentazione, è bassa (regione di Keshan in Cina, Finlandia, Nuova Zelanda). In assenza di selenio gli mRNA delle selenio-proteine vanno incontro a NMD (non-sense-mediated decay).
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Selenocisteina
Wikimedia Commons contiene immagini o altri file su Selenocisteina


 French
French Deutsch
Deutsch