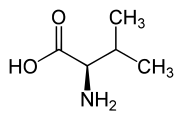
Valina
| Valina | |
|---|---|
 | |
| Nome IUPAC | |
| Acido 2-ammino-3-metilbutanoico | |
| Abbreviazioni | |
| V VAL | |
| Nomi alternativi | |
| Valina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5H11NO2 |
| Massa molecolare (u) | 117,15 |
| Aspetto | solido cristallino biancastro |
| Numero CAS | |
| Numero EINECS | 200-773-6 |
| PubChem | 6287, 88733505 e 6971018 |
| DrugBank | DBDB00161 |
| SMILES | CC(C)C(C(=O)O)N |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 293 K | pK1: 2,39 pK2: 9,74 |
| Punto isoelettrico | 6,00 |
| Solubilità in acqua | 85 g/l a 293 K |
| Temperatura di fusione | 315 °C (588 K) con decomposizione |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −617,9 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
La valina è un amminoacido utilizzato dagli esseri viventi per la sintesi delle proteine. Viene indicato comunemente con le sigle V o Val ed è codificato sull'RNA messaggero dai codoni GUU, GUC, GUA e GUG.
Storia
[modifica | modifica wikitesto]La valina fu isolata per la prima volta dalla caseina nel 1901 da Hermann Emil Fischer.[2] Il nome valina deriva dall'acido valerico, che a sua volta prende il nome dalla pianta valeriana per la presenza dell'acido nelle radici della pianta.[3]
Struttura
[modifica | modifica wikitesto]La valina, come tutti gli amminoacidi, è composta da un gruppo amminico () e da uno carbossilico (). La catena laterale è alifatica e ramificata ( sostituente chiamato isopropile), il che rende la molecola apolare. Siccome la molecola presenta un gruppo a carattere basico (quello amminico) ed uno a carattere acido (quello carbossilico), viene definita anfotera in quanto può mostrare entrambi i comportamenti a seconda del pH.
Il punto isoelettrico della valina, ossia il valore di pH in cui l'amminoacido si dissocia nella sua parte acida () e si protona nella sua parte basica (), è 6,00. Questo valore lo si ottiene dalla media tra la costante di dissociazione acida e quella basica. L'amminoacido così dissociato viene definito zwitterione, il quale presenta cariche negative e positive in uguali quantità e dunque, carica globale neutra. Questa proprietà impedisce ad uno zwitterione di subire una migrazione elettroforetica.
Siccome al carbonio 2, chiamato anche carbonio α, sono legati 4 sostituenti differenti (, isopropile, e ), viene identificato in quest'ultimo uno stereocentro. A seconda di come sono orientati tridimensionalmente questi sostituenti, possono identificarsi 2 enantiomeri: l'acido 2(S)-ammino-3-metilbutanoico e l'acido 2(R)-ammino-3-metilbutanoico. Queste due molecole hanno attività ottica e quindi si possono distinguere l'L-valina come la D-valina.
Con il nome "valina" si intendono in genere le miscele racemiche.
- Struttura dell'L-valina
- Struttura della D-valina
L-valina
[modifica | modifica wikitesto]L'enantiomero L della valina è quello utilizzato dagli esseri viventi terrestri come mattoncino per costruire le proteine. Non è sintetizzato nel nostro organismo, per cui rientra in quella categoria di amminoacidi definiti essenziali, che sono da introdurre con la dieta.
Biosintesi
[modifica | modifica wikitesto]La valina, come altri aminoacidi a catena ramificata, è sintetizzata dalle piante, ma non dagli animali.[4] È sintetizzato nelle piante e nei procarioti attraverso diversi passaggi a partire dall'acido piruvico. La parte iniziale del percorso porta anche alla sintesi della leucina. L'intermedio α-chetoisovalerato subisce un'amminazione riduttiva con glutammato.
Metabolismo
[modifica | modifica wikitesto]Come altri aminoacidi a catena ramificata, il catabolismo della valina inizia con la rimozione del gruppo amminico per transaminazione, dando α-chetoisovalerato, che viene convertito in isobutirril-CoA attraverso la decarbossilazione ossidativa da parte del complesso enzimatico α-chetoacido deidrogenasi.[5] Questo viene ulteriormente ossidato in succinil-CoA, che può entrare nel ciclo dell'acido citrico.
Malattie metaboliche
[modifica | modifica wikitesto]La scomposizione della valina è disturbata nelle seguenti malattie metaboliche:
Utilizzi
[modifica | modifica wikitesto]La L-valina è l'amminoacido necessario per la sintesi proteica, ma è utilizzabile dall'organismo umano anche per la produzione di energia da alimenti molto proteici o in caso di mobilizzazione di riserve proteiche endogene. La valina serve per esempio, come gli altri due aminoacidi con catena di idrocarburi ramificata: leucina e isoleucina, al nutrimento del muscolo. Questo è importante durante sforzi prolungati o in fasi di fame, quando il corpo deve attingere alle proprie riserve interne. La distruzione della valina dà luogo a propionil-CoA che, dopo la conversione in succinil-CoA, contribuisce al completamento del ciclo di Krebs.[6]
Resistenza all'insulina
[modifica | modifica wikitesto]Come altri aminoacidi a catena ramificata, anche la L-valina è associata all'insulinoresistenza: si osservano livelli più elevati di valina nel sangue di topi, ratti e umani diabetici.[7] I topi nutriti con una dieta di deprivazione di valina per un giorno hanno migliorato la sensibilità all'insulina e l'alimentazione di una dieta di deprivazione di valina per una settimana riduce significativamente i livelli di glucosio nel sangue.[8] Nei topi obesi e insulinoresistenti, una dieta con livelli ridotti di valina e degli altri aminoacidi a catena ramificata determina una riduzione dell'adiposità e una migliore sensibilità all'insulina.[9] Negli esseri umani, una dieta povera di proteine abbassa i livelli ematici di valina e diminuisce i livelli di glucosio nel sangue a digiuno.
Cellule staminali ematopoietiche
[modifica | modifica wikitesto]La valina è essenziale per l'auto-rinnovamento delle cellule staminali ematopoietiche (HSC), come dimostrato da esperimenti sui topi.[10] La restrizione dietetica di valina esaurisce selettivamente le HSC presenti nel midollo osseo del topo. Il successo del trapianto di cellule staminali è stato ottenuto nei topi dopo 3 settimane di dieta a restrizione di valina. La sopravvivenza a lungo termine dei topi trapiantati è stata raggiunta quando la valina è stata restituita alla dieta gradualmente per un periodo di 2 settimane per evitare la sindrome da rialimentazione.
D-valina
[modifica | modifica wikitesto]Gli enantiomeri D degli amminoacidi a catena ramificata (D-BCAA dall'inglese D-branched-chain amino acid) come la D-leucina, la D-isoleucina e la D-valina sono noti per essere intermedi di antibiotici peptidici ed esibiscono una varietà di attività biologiche.[11] Tra queste è esclusa la sintesi proteica, dunque la D-valina è classificabile come amminoacido non proteinogenico.
Sintesi
[modifica | modifica wikitesto]La D-valina viene sintetizzata tramite l'amminazione enantioselettiva NADPHdipendente. Questa reazione, catalizzata nella sua prima fase dall'enzima D-amminoacido deidrogenasi e nella seconda fase dalla glucosio deidrogenasi, consuma 2 ossiacidi a favore della formazione degli amminoacidi D, consumando come fonte energetica il NADPH.
Abbondanza negli alimenti
[modifica | modifica wikitesto]Tra i cereali, la segale ne è molto ricca, con 530 mg per 100 g.
I seguenti esempi del contenuto di valina si riferiscono a 100 g di alimento. Di fianco è riportata la percentuale di proteine totali.[12]
| Alimento | Proteine totali | Valina | Percentuale |
|---|---|---|---|
| Carne di manzo cruda | 21,26 g | 1055 mg | 5,0 % |
| Petto di pollo crudo | 23,09 g | 1145 mg | 5,0 % |
| Salmone crudo | 20,42 g | 1107 mg | 5,4 % |
| Pollame | 12,58 g | 859 mg | 6,8 % |
| Latte vaccino, materia grassa 3,7% | 3,28 g | 220 mg | 6,7 % |
| Noci | 15,23 g | 753 mg | 4,9 % |
| Farina integrale di frumento | 13,70 g | 618 mg | 4,5 % |
| Farina integrale di mais | 6,93 g | 351 mg | 5,1 % |
| Riso non sbramato | 7,94 g | 466 mg | 5,9 % |
| Piselli secchi | 24,55 g | 1159 mg | 4,7 % |
La stima del fabbisogno giornaliero per un adulto sano oscilla - a seconda del metodo impiegato - tra i 10 e i 29 mg di valina per chilogrammo di peso corporeo.[13]
Note
[modifica | modifica wikitesto]- ^ scheda della valina su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ (EN) valine | chemical compound, su Encyclopedia Britannica. URL consultato il 1º settembre 2021.
- ^ (EN) Definition of VALINE, su www.merriam-webster.com. URL consultato il 1º settembre 2021.
- ^ P. Basuchaudhuri, Nitrogen metabolism in rice, 2016, ISBN 978-1-4987-4668-7, OCLC 945482059. URL consultato il 6 settembre 2021.
- ^ K. E. Van Holde e Kevin G. Ahern, Biochemistry, 3rd ed, Benjamin Cummings, 2000, ISBN 0-8053-3066-6, OCLC 42290721. URL consultato il 6 settembre 2021.
- ^ J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 697–698, 735, 746; ISBN 978-3-8274-1800-5.
- ^ (EN) Christopher J. Lynch e Sean H. Adams, Branched-chain amino acids in metabolic signalling and insulin resistance, in Nature Reviews Endocrinology, vol. 10, n. 12, 2014-12, pp. 723-736, DOI:10.1038/nrendo.2014.171. URL consultato il 6 settembre 2021.
- ^ (EN) Fei Xiao, Junjie Yu e Yajie Guo, Effects of individual branched-chain amino acids deprivation on insulin sensitivity and glucose metabolism in mice, in Metabolism - Clinical and Experimental, vol. 63, n. 6, 1º giugno 2014, pp. 841-850, DOI:10.1016/j.metabol.2014.03.006. URL consultato il 6 settembre 2021.
- ^ Nicole E. Cummings, Elizabeth M. Williams e Ildiko Kasza, Restoration of metabolic health by decreased consumption of branched-chain amino acids.
- ^ (EN) Yuki Taya, Yasunori Ota e Adam C. Wilkinson, Depleting dietary valine permits nonmyeloablative mouse hematopoietic stem cell transplantation, in Science, 2 dicembre 2016, DOI:10.1126/science.aag3145. URL consultato il 6 settembre 2021.
- ^ (EN) Hironaga Akita, Hirokazu Suzuki e Katsumi Doi, Efficient synthesis of d-branched-chain amino acids and their labeled compounds with stable isotopes using d-amino acid dehydrogenase, in Applied Microbiology and Biotechnology, vol. 98, n. 3, 1º febbraio 2014, pp. 1135-1143, DOI:10.1007/s00253-013-4902-1. URL consultato il 6 settembre 2021.
- ^ Database dei principi nutritivi del Ministero dell'agricoltura degli Stati Uniti, ventunesima edizione.
- ^ A. V. Kurpad, M. M. Regan, T. Raj, J. V. Gnanou: Branched-chain amino acid requirements in healthy adult human subjects. In: J. Nutr. 136(1 Suppl); Jan 2006: S. 256S–263S; PMID 16365094.
Voci correlate
[modifica | modifica wikitesto]- Amminoacido
- Amminoacidi essenziali
- Amminoacidi ramificati
- Amminoacidi proteinogenici
- Amminoacidi non proteinogenici
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «valina»
Wikizionario contiene il lemma di dizionario «valina» Wikimedia Commons contiene immagini o altri file su valina
Wikimedia Commons contiene immagini o altri file su valina
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) valine, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.


 French
French Deutsch
Deutsch