Glyoxaal
| Glyoxaal | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
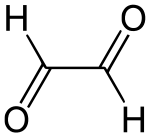 | ||||
Structuurformule van glyoxaal | ||||
| Algemeen | ||||
| Molecuulformule | C2H2O2 | |||
| IUPAC-naam | ethaandial | |||
| Andere namen | oxaalaldehyde, glyoxaldehyde, diformyl | |||
| Molmassa | 58,03608 g/mol | |||
| SMILES | O=CC=O | |||
| InChI | 1/C2H2O2/c3-1-2-4/h1-2H | |||
| CAS-nummer | 107-22-2 | |||
| EG-nummer | 203-474-9 | |||
| PubChem | 7860 | |||
| Wikidata | Q413465 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H317 - H319 - H331 - H341 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P280 - P305+P351+P338 - P311 | |||
| Carcinogeen | mogelijk (IARC-klasse 3B) | |||
| EG-Index-nummer | 605-016-00-7 | |||
| LD50 (ratten) | (oraal) > 2020[1] mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | geel | |||
| Dichtheid | 1,14[2] g/cm³ | |||
| Smeltpunt | 15[2] °C | |||
| Kookpunt | 50,4[2] °C | |||
| Zelfontbrandings- temperatuur | 285[2] °C | |||
| Dampdruk | 29300[2] Pa | |||
| Oplosbaarheid in water | 600[2] g/L | |||
| Goed oplosbaar in | water | |||
| Brekingsindex | 1,3826[3] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Glyoxaal is de triviale naam en tevens de INCI-benaming voor ethaandial. Het is een dialdehyde (glyoxaal is de kleinste molecule met twee aldehydegroepen). Het is een erg reactieve stof; commercieel is het verkrijgbaar als een 40%-oplossing in water, of als het vaste dihydraat. Dit is een niet-hygroscopisch kristallijn poeder.
Synthese
[bewerken | brontekst bewerken]Glyoxaal wordt commercieel geproduceerd door de oxidatie van etheenglycol in de gasfase, in de aanwezigheid van een zilver- of koperkatalysator. Onder meer BASF produceert zo glyoxaal in Ludwigshafen (Duitsland) en in Geismar (Louisiana, VS).[4]
Een andere mogelijkheid is de oxidatie van aceetaldehyde met salpeterzuur of seleenzuur in de vloeibare fase,[5][6][7][8][9] of door hydrolyse van dichloordioxaan.[10]
Voorkomen
[bewerken | brontekst bewerken]Glyoxaal is vastgesteld in een groot aantal voedingswaren en dranken, onder meer geroosterd of gebakken vlees, vis, koffie en bier. De dagelijkse inname van glyoxaal via de voeding, is geschat op maximaal 10 mg.[11] Glyoxaal komt ook voor in sigarettenrook en uitlaatgassen, en sporen van glyoxaal zijn eveneens vastgesteld in drinkwater.
In het lichaam wordt glyoxaal gevormd tijdens gewone cellulaire stofwisselingsprocessen, en bij de metabolisatie van bepaalde andere verbindingen zoals glycolaldehyde of ethyleenglycol. De normale concentratie van glyoxaal in het bloedplasma ligt tussen 0,1 en 1 μmol/liter.[11]
Toepassingen
[bewerken | brontekst bewerken]Glyoxaal is een reactieve stof vanwege de twee aldehydegroepen, en het wordt daarom gebruikt bij de synthese van vele andere chemische stoffen, zoals biologisch actieve stoffen (farmaceutische stoffen en pesticiden, in het bijzonder heterocyclische verbindingen zoals imidazolen).
In papierfabricage gebruikt men het om de sterkte van nat papier te verbeteren of om coatings van papier waterbestendig te maken. Het wordt gebruikt in textielveredeling, om katoen en andere cellulosevezels kreuk- en krimpbestendiger te maken. Het vindt ook toepassing in vochtbestendige lijmen en kleefmiddelen.
Glyoxaal kan de oplosbaarheid van wateroplosbare polymeren verbeteren, bijvoorbeeld van hydroxyethylcellulose. De deeltjes van deze stof hebben de neiging om in water samen te klitten en vlokken te vormen; maar als ze eerst met glyoxaal behandeld zijn, zijn ze wel goed oplosbaar. Dat wordt onder meer toegepast bij de bereiding van bepaalde cosmetische producten die deze stoffen bevatten (maximale glyoxaalconcentratie: 0,01 gewichtsprocent).
Glyoxaal is een ingrediënt in bepaalde desinfecterende middelen.
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Watervrij glyoxaal is niet stabiel en kan enkel in het laboratorium bereid worden. Gewoonlijk wordt het gebruikt als een 40 gewichtsprocent oplossing in water, in mindere mate als vast hydraat.
Bij verhitting van glyoxaal vormt het groene dampen, die branden met een paarse vlam. Mengsels met de lucht kunnen explosief zijn.
Glyoxaal polymeriseert tot oligomeren met de algemene benaming polyglyoxaal. Glyoxaal dient daarom in het donker bewaard te worden, en soms wordt er een polymerisatie-inhibitor aan toegevoegd. De oligomeren ontbinden bij verhitting boven 120°C terug tot glyoxaal.
Zie ook
[bewerken | brontekst bewerken]- ↑ H. F. Smyth et al., J. Ind. Hyg. Toxicol. 23, 259 (1941)
- ↑ a b c d e f (en) Gegevens van glyoxal in de GESTIS-stoffendatabank van het IFA (geraadpleegd op 14 december 2008)
- ↑ Merck 13,4522
- ↑ BASF.com Internetpagina: BASF.com
- ↑ Lubawin. (1875). GEEN TITEL OPGEGEVEN Ber.. 8 pag.: 768
- ↑ Wyss. (1877). GEEN TITEL OPGEGEVEN Ber.. 10 pag.: 1366
- ↑ Kölln. (1918). GEEN TITEL OPGEGEVEN Ann.. 416 pag.: 230
- ↑ Riley et al.. (1932). GEEN TITEL OPGEGEVEN J. Chem. Soc.. 1932 pag.: 1881
- ↑ Ronzio, Waugh. (1955). GEEN TITEL OPGEGEVEN pag.: 438 Collective volume Org. Syn. coll. vol. III
- ↑ Butler, Cretcher. (1932). GEEN TITEL OPGEGEVEN J. Amer. Chem. Soc.. 54 pag.: 2988
- ↑ a b cijfer geciteerd in Opinion on glyoxal (Scientific Committee on Consumer Products, 21 juni 2005). Gearchiveerd op 14 november 2021.


 French
French Deutsch
Deutsch
