Imidazool
| Imidazool | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
 | |||||
Structuurformule van imidazool | |||||
| Algemeen | |||||
| Molecuulformule | C3H4N2 | ||||
| IUPAC-naam | 1H-imidazool | ||||
| Andere namen | 1,3-diazacyclopenta- 2,4-dieen, glyoxaline, iminazool, 1,3-diazool | ||||
| Molmassa | 68,07726 g/mol | ||||
| SMILES | C1=CN=CN1 | ||||
| InChI | 1/C3H4N2/c1-2-5-3-4-1/h1-3H,(H,4,5)/f/h4H | ||||
| CAS-nummer | 288-32-4 | ||||
| EG-nummer | 206-019-2 | ||||
| PubChem | 795 | ||||
| Wikidata | Q328692 | ||||
| Beschrijving | Witte tot lichtgele kristallen met een zoete geur | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H314 - H360d | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P201 - P280 - P305+P351+P338 - P310 | ||||
| VN-nummer | 2923 | ||||
| ADR-klasse | Gevarenklasse 8 | ||||
| LD50 (ratten) | (oraal) 970 mg/kg | ||||
| LD50 (muizen) | (oraal) 880 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit-lichtgeel | ||||
| Dichtheid | 1,03 g/cm³ | ||||
| Smeltpunt | 88-92 °C | ||||
| Kookpunt | 256 °C | ||||
| Vlampunt | 145 °C | ||||
| Zelfontbrandings- temperatuur | 480 °C | ||||
| Dampdruk | 0,3 × 10−4 Pa | ||||
| Oplosbaarheid in water | 633 g/L | ||||
| Goed oplosbaar in | water, ethanol, chloroform, di-ethylether, pyridine | ||||
| Geometrie en kristalstructuur | |||||
| Kristalstructuur | monoklien | ||||
| Dipoolmoment | 3,61 D | ||||
| Evenwichtsconstante(n) | pKa = 14,5 | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Imidazool is een heterocyclische aromatische verbinding met als brutoformule C3H4N2. Imidazool wordt soms als alkaloïde omschreven. De naam imidazool verwijst eveneens naar de groep verbindingen waarbij een imidazoolring deel uitmaakt van de molecule. De stof komt voor als een witte tot lichtbruine kristallijne vaste stof met een aangename zoete geur, die goed oplosbaar is in water en verschillende polaire organische oplosmiddelen.
De imidazoolring is de bouwsteen van veel biologisch belangrijke verbindingen, zoals histidine en het verwante histamine. Imidazool kan als base en als zwak zuur optreden in reacties. Imidazool kan in twee tautomere vormen voorkomen door verschuiving van het waterstofatoom van het ene stikstofatoom naar het andere. Dit is in principe een snel evenwicht zonder echte voorkeur voor een van de stikstofatomen, maar eventuele substituenten kunnen een van beide tautomeren bevoordelen. In de structuur van veel geneesmiddelen kan de imidazoolring herkend worden, bijvoorbeeld in antischimmelmiddelen (econazol, miconazol en sulconazol).[1][2][3][4][5]
Geschiedenis
[bewerken | brontekst bewerken]De eerste beschreven synthese van imidazool zelf werd uitgevoerd door Heinrich Debus in 1858,[6] maar verschillende derivaten van imidazool zijn al in de jaren '40 van de 19e eeuw beschreven. Uit het mengsel van glyoxaal en formaldehyde in ammoniak verkreeg Debus imidazool. Hoewel de opbrengst van deze synthese vrij laag is, wordt hij ook vandaag nog toegepast voor de bereiding van C-gesubstitueerde imidazolen:
Bij de variant die gebruikmaakt van microgolven reageren benzil, formaldehyde en ammoniak in ijsazijn tot 2,4,5-trifenylimidazool.[7]
Synthese
[bewerken | brontekst bewerken]Naast de methode van Debus bestaan er nog vele andere syntheseroutes naar deze verbinding.[2] De syntheses zijn meestal toepasbaar op een hele klasse van verbindingen, waardoor gesubstitueerde imidazolen bereid kunnen worden door de juiste uitgangsstoffen te kiezen. In literatuuroverzichten worden de verschillende methoden vaak gerangschikt naar hoeveel en welke bindingen gevormd worden tijdens het sluiten van de imidazoolring.
Vorming van één binding
[bewerken | brontekst bewerken]De reactie van een imidaat met een α-aminoaldehyde of α-aminoacetaal leidt tot vorming van een acyclische amidine, dat vervolgens cycliseert tot het gesubstitueerd imidazool.
Vorming van twee bindingen
[bewerken | brontekst bewerken]Door een 1,2-diaminoalkaan bij hoge temperatuur te laten reageren met een alcohol, aldehyde of carbonzuur wordt de verzadigde imidazoolring gevormd. Deze dient hierna te worden dehydrogeneerd met platina en alumina:
Een alternatieve methode is de reactie van N-gesubstitueerde α-aminoketonen met formamide. De opbrengst van deze reactie is matig.
Vorming van vier bindingen
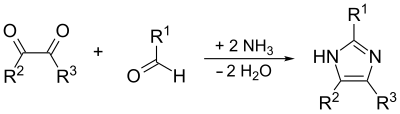
[bewerken | brontekst bewerken]De uitgangsstoffen voor deze synthese zijn gesubstituteerd glyoxaal, een aldehyde, een amine en ammoniak of een ammoniumzout:[8]
Vorming uit andere heterocyclische verbindingen
[bewerken | brontekst bewerken]Imidazool kan via fotolyse ontstaan uit 1-vinyltetrazool. Via deze route is imidazool alleen efficiënt te bereiden als het vinyltetrazool makkelijk te synthetiseren is. Hierbij worden organotinverbindingen gebruikt zoals 2-tributylstannyltetrazool.
Synthese in de gasfase
[bewerken | brontekst bewerken]Imidazool kan ook in de gasfase ontstaan. De reactie treedt op als een mengsel van formamide, ethyleendiamine en waterstofgas over platina op aluminium geleid wordt bij een temperatuur van tussen de 340 en 480 °C. Er wordt hierbij zeer zuivere imidazool gevormd.
Structuur en eigenschappen
[bewerken | brontekst bewerken]Imidazool bestaat uit een vlakke ring met 5 atomen. De verbinding is oplosbaar in water en andere polaire oplosmiddelen. De verbinding beschikt over een aromatisch systeem, waarbij de beide stikstofatomen een verschillende rol spelen. Het vrij elektronenpaar op het ene stikstofatoom neemt deel aan het aromatisch systeem, dat op het andere stikstofatoom niet. Een aantal resonantiestructuren zijn hieronder weergegeven:

Imidazool is een base en een zeer goed nucleofiel. Het reageert via het aromatisch stikstofatoom met alkylerende en acylerende reagentia. De meeste van de optredende reacties verstoren de aromaticiteit in de ring niet. Imidazolen reageren doorgaans slecht met nucleofielen.
Biologische aspecten en toepassingen
[bewerken | brontekst bewerken]Imidazool komt als bouwsteen voor in een groot aantal biologisch belangrijke verbindingen. De belangrijkste is het aminozuur histidine. Histidine wordt ingebouwd in een groot aantal proteïnen, vaak in het reactieve centrum van enzymen en het speelt een belangrijke rol in de structurele integriteit van hemoglobine. Histidine kan gedecarboxyleerd worden tot histamine, eveneens een imidazoolhoudende biologisch actieve verbinding:

Histamine is een van de componenten in het toxine dat netelroos veroorzaakt. Netelroos is eigenlijk een allergische reactie.
Een van de toepassingen van imidazool is de zuivering van histidine-gelabelde proteïnen in immobilised metal affinity chromatografie (IMAC). Imidazool wordt gebruikt om de histidine-gelabelde proteïnen die aan nikkelionen (die op hun beurt vastzitten aan het dragermateriaal van de kolom) gekoppeld zijn te verdrijven van de metaalionen. Een overmaat imidazool wordt over de kolom geleid, waarbij imidazool de plaats van de histidine inneemt. Imidazool treedt dus op als een complexerend reagens; het proteïne komt daardoor vrij.
Imidazool is een belangrijke bouwsteen voor talrijke geneesmiddelen. De toepassingen liggen op het gebied van fungicides en anti-schimmelmiddelen (onder andere ketoconazol en sulconazol), antiprotozoa en antihypertensiva. Imidazool is een bouwsteen van theofylline, dat onder andere voorkomt in theebladeren en koffiebonen. Het is een stimulator voor het centrale zenuwstelsel. Imidazool is een bestanddeel van het anticytostaticum mercaptopurine, dat ingezet kan worden in de bestrijding van leukemie door interferentie met DNA-activiteit.
Industriële toepassingen
[bewerken | brontekst bewerken]Imidazool wordt toegepast om corrosie te bestrijden bij sommige overgangsmetalen, zoals koper. Bescherming van koper tegen corrosie is belangrijk, vooral in vochtige omgevingen. Corrosie heeft immers een negatief effect op het geleidingsvermogen van koper.
Veel technische en industriële verbindingen bevatten imidazoolringen. Bij het thermisch stabiele polybenzimidazool (PBI) is een imidazoolring gefuseerd met een benzeenring tot benzimidazool. De verbinding wordt als vlamvertrager gebruikt. Daarnaast zijn er toepassingen in de fotografie en de elektronica.
Zouten van imidazool
[bewerken | brontekst bewerken]
Zouten waarbij de imidazool-ring deel uitmaakt van het kation worden imidazoliumzouten genoemd. Een voorbeeld is imidazoliumchloride. De zouten worden gevormd door protonering van de stikstofatomen of door alkylering ervan. Imidazoliumzouten worden gebruikt als ionische vloeistoffen en als uitgangsstof voor stabiele carbenen.
Zouten waarbij de imidazool-ring het anion vormt zijn ook mogelijk. Deze zouten staat bekend onder de naam imidazolidezouten (zoals natriumimidazolide). Zij worden gevormd door deprotonering met een zeer sterke base, zoals cyclopentadienylnatrium.
Verwante heterocyclische verbindingen
[bewerken | brontekst bewerken]Externe link
[bewerken | brontekst bewerken]- (en) MSDS van imidazool
- ↑ Katritzky; Rees. Comprehensive Heterocyclic Chemistry. Vol. 5, p.469-498, (1984)
- ↑ a b Grimmett, M. Ross. Imidazole and Benzimidazole Synthesis. Academic Press, (1997)
- ↑ Brown, E.G. Ring Nitrogen and Key Biomolecules. Kluwer Academic Press, (1998)
- ↑ Pozharskii, A.F, et al. Heterocycles in Life and Society. John Wiley & Sons, (1997)
- ↑ Heterocyclic Chemistry TL Gilchrist, The Bath press 1985 ISBN 0-582-01421-2
- ↑ Heinrich Debus (1858). Ueber die Einwirkung des Ammoniaks auf Glyoxal. Annalen der Chemie und Pharmacie 107 (2): 199 – 208. DOI: 10.1002/jlac.18581070209.
- ↑ Microwave-Mediated Synthesis of Lophine: Developing a Mechanism To Explain a Product Crouch, R. David; Howard, Jessica L.; Zile, Jennifer L.; Barker, Kathryn H. J. Chem. Educ. 2006 83 1658
- ↑ US patent 6177575, "Process for Manufacture of Imidazoles" van 23 januari 2001 aan E.I. du Pont de Nemours and Company. Gearchiveerd op 6 augustus 2023.


 French
French Deutsch
Deutsch