Wirus Zachodniego Nilu – Wikipedia, wolna encyklopedia
 Wirus Zachodniego Nilu pod mikroskopem | |
| Systematyka | |
| Rodzina | |
|---|---|
| Rodzaj | |
| Cechy wiralne | |
| Skrót | WNV |
| Kwas nukleinowy | RNA |
| Liczba nici | pojedyncza |
| Wywoływane choroby | |
Wirus Zachodniego Nilu (ang. West Nile virus, WNV) – wirus z rodziny flawiwirusów.
Budowa
[edytuj | edytuj kod]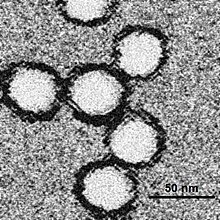
Pojedynczy wirion liczy sobie około 50 nm średnicy[1]. Wirion składa się z dwuwarstwy lipidowej pochodzącej z organizmu gospodarza. Pływają w niej białka błonowe: M (membrane) i E (envelope). Od białek tych zależy choćby tropizm tkankowy wirusa i zakres jego gospodarzy. W środku znajduje się rdzeń nukleokapsydu. Więzi on materiał genetyczny wirusa: pojedynczy kwas rybonukleinowy, nić kodującą liczącą 11 000 reszt nukleotydowych. Można w nim wyróżnić okołostunukleotydowy region niekodujący 5', region kodujący o pojedynczej ramce odczytu, odpowiedzialny za kodowanie trzech białek strukturalnych i siedmiu niestrukturalnych w następującej kolejności: capsid-membrane-envelope-NS1-NS2aNS2b-NS3-NS4a-NS4b-NS5, w końcu zaś następuje region niekodujący 3', liczący sobie około 600 reszt nukleotydowych[1].
Systematyka
[edytuj | edytuj kod]Już w pierwszej pracy na temat wirusa Zachodniego Nilu zauważono jego immunologiczne podobieństwo do wirusa japońskiego zapalenia mózgu[2]. Wkrótce znaleziono też pokrewieństwo łączące WNV z wirusem St. Louis (SLE), potwierdzono też pokrewieństwo z wirusem japońskiego zapalenia mózgu B. Dowodów ponownie dostarczyła immunologia[3].
Obecnie wirus Zachodniego Nilu klasyfikuje się w obrębie rodziny Flaviviridae, w rodzaju Flavivirus. Wirusy należące do tego rodzaju klasyfikuje się dalej w mniejsze grupy. WNV zalicza się do wirusów kompleksu antygenowego JE. Zaliczają się doń również wirusy japońskiego zapalenia mózgu (JE), zapalenia mózgu doliny Murray, wirus St. Louis (SLE) i Kunjin[1].
W 2008 przy okazji badań wirusa Zika Lanciotti i współpracownicy porównali region kodujący jedno z białek flawiwirusów (białko 5), w efekcie czego powstało następujące drzewo filogenetyczne[4]:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Co więcej, wirusa Zachodniego Nilu podzielić można dalej na 2 linie. Podczas gdy pierwsza z nich osiągnęła zasięg światowy, druga obejmuje 2 enzootyczne szczepy afrykańskie[1].
Rozmieszczenie geograficzne
[edytuj | edytuj kod]Wirus Zachodniego Nilu występuje w Afryce, Azji, Australii i Europie, a od niedawna również w Ameryce Północnej[1].
Wirus ten po raz pierwszy wyizolowany został w 1937[1], co opisali w pracy wydanej w 1940 w „American Journal of Tropical Medicine” Smithburn i współpracownicy po pracach badawczych prowadzonych w regionie Zachodniego Nilu (północno-zachodnia Uganda). Pobrano wtedy krew od gorączkującego chorego. Surowicę podano domózgowo myszy. Z wyjątkiem pierwszego pasażowania poddane inokulacji zwierzęta laboratoryjne umierały, również po podaniu donosowym i dootrzewnowym, jednak nie podskórnym. Przeprowadzono wtedy też badania na naczelnych i innych zwierzętach laboratoryjnych. U dwóch członków zespołu badawczego znaleziono przeciwciała przeciwko wirusowi, nie rozwinęli oni jednak objawów klinicznych[2].
Niedługo później (1942) przeprowadzono badania serologiczne ludności Afryki. Kontakt z wirusem wykryto u mieszkańców Sudanu, Kenii, Ugandy oraz Konga Belgijskiego[5]. W latach pięćdziesiątych pojawiły też już doniesienia z Egiptu[6].
W 1974 doniesiono o epidemii WNL i wirusa Sindbis w Południowej Afryce, w Kraju Przylądkowym na obszarze 2500 km². Choroba pojawiła się po obfitych deszczach na obszarze zazwyczaj suchym. 55% ludności zajętego obszaru miała kontakt z wirusem, choć izolowano zaledwie kilka osób. Wektorem był prawdopodobnie Culex univittatus[7]. Obecność wirusa potwierdzono także w Izraelu[1].
Wreszcie wirus Zachodniego Nilu dotarł również do Europy[1]. Następnie epidemie wybuchały w Afryce Północnej, Europie, Ameryce Północnej i Bliskim Wschodzie, rozpoczynając się niekiedy od epizoocji[1].
W 1999 wirus wywołał epidemię zapalenia opon mózgowych w Nowym Jorku. Wstępnie podejrzewano wirus zapalenia mózgu z Saint Louis bądź wirus Kunjin. 59 osób było hospitalizowanych, 7 zmarło[1]. W latach 1999–2001 wirus rozprzestrzeniał się dalej po kontynencie północnoamerykańskim. Zajął ponad połowę wschodu Stanów Zjednoczonych. W Kanadzie objął południe Ontario[1].
W czasie epidemii nowojorskiej wirus powodował zachorowania w Rosji. W kolejnych latach epidemie pojawiły się w Rumunii w 1996 (z perspektywy czasu określana raczej jako pojedynczy incydent) oraz w Izraelu w 2000. Ta ostatnia skutkowała zgonem 35 osób, zachorowań było powyżej 400[1].
Epidemia z 1999 wskazuje na niebezpieczeństwo rozprzestrzeniania się takich wirusów w miastach[1].
Cykl rozwojowy
[edytuj | edytuj kod]WNV jest arbowirusem. Przenoszony jest przez komarowate[1]. Występuje u człowieka, koni i ptaków. W Ameryce Północnej przeniósł się na ptaki, powodując dużą umieralność[1].
Wirusa do końca lat pięćdziesiątych znaleziono u takich gatunków ptaków jak gołąb skalny, synogarlica senegalska[8], czarnowron[6], wróbel domowy, czapla złotawa, pustułka zwyczajna[8]. W latach sześćdziesiątych Schmidt i El Mansoury donieśli o znalezieniu wirusa u koniowatych z Egiptu. Przeciwciała neutralizujące WNV znaleźli u 67% koni, 47% osłów i 44% mułów[9].
Wirus namnaża się w cytoplazmie[1], co jest typowe dla przedstawicieli Flavivirus z nielicznymi wyjątkami[10], w bliskim sąsiedztwie siateczki śródplazmatycznej szorstkiej. Następnie cząstki wirusa dostają się do pęcherzyków tejże siateczki i opuszczają komórkę w mechanizmie wydzielnicznym[1].
W warunkach laboratoryjnych powoduje śmierć myszy (podany do mózgu, nosa i otrzewnej, jednak nie podskórnie). U makaków królewskich (rezusów) wywołuje śmiertelne zapalenie opon mózgowych. Odporne są nań zaś koczkodany, kotawiec zielonosiwy, świnki morskie (kawie domowe), króliki, jeże[2].
Pierwsze badania wyjaśniające tę kwestię przeprowadzili Philip i Smadel, opisując je w 1943. Pozwolili komarom Aedes albopictus żerować na zarażonych chomikach. Komary nie tylko same zaraziły się wirusem, ale były też zdolne do zarażenia młodych chomików od 10 do 26 dni później[11]. Do 1956 znaleziono WNV u Culex antennatus, Culex univittatus (częściej niż u innych komarów, gatunek ten wybiera krew ptaków), Culex pipiens, Anopheles pharocnsis[6].
Gorączka Zachodniego Nilu
[edytuj | edytuj kod]WNV jest neuropatogenem[1].
Wczesne prace podawały, że WNV zagraża głównie dzieciom, a szczyt infekcji przypada na lato. Chorobę opisywano jako przebiegającą z gorączką, ale samoograniczającą się, bez skutków śmiertelnych, choć rzadko mogącą przejść w zapalenie opon mózgowych[6].
Pierwszy opisany przypadek choroby u konia pochodzi z 1959 (publikacja w 1963). Przebiegała z kolką, hematurią, zastojem moczu i paraliżem tylnej części ciała. Zakończyła się zejściem śmiertelnym po 60 godzinach. Sekcja wykazała zmiany zastoinowe i krwotoczne w OUN (kresomózgowiu i móżdżku). Pod mikroskopem zaobserwowano rozplem mikrogleju, status cribrosus, zburzenia komórek Purkinjego. Zmiany znaleziono też w pęcherzu moczowym, płucach, przewodzie pokarmowym[9].
Przypisy
[edytuj | edytuj kod]- ↑ a b c d e f g h i j k l m n o p q r s t Grant L Campbell, Anthony A Marfin, Robert S Lanciotti & Duane J Gubler. West nile virus. „The Lancet infectious diseases”. 2, s. 519–529, 2002. Elsevier. (ang.).
- ↑ a b c Smithburn, K. C.; Hughes, T. P.; Burke, A. W. & Paul, J. H. A Neurotropic Virus Isolated from the Blood of a Native of Uganda. „American Journal of Tropical Medicine”. 20, s. 471–472, 1940. (ang.).
- ↑ KC Smithburn. Differentiation of the West Nile Virus from the Viruses of St. Louis and Japanese B Encephalitis. „Journal of Immunology”. 43, s. 25–31, 1942. (ang.).
- ↑ Robert S. Lanciotti, Olga L. Kosoy, Janeen J. Laven, Jason O. Velez, Amy J. Lambert, Alison J. Johnson, Stephanie M. Stanfield & Mark R. Duffy. Genetic and Serologic Properties of Zika Virus Associated with an Epidemic, Yap State, Micronesia, 2007. „Emerging Infectious Diseases”. 14, s. 1232–1239, 2008. DOI: 10.3201/eid1408.080287. (ang.).
- ↑ Kenneth C. Smithburn & Henry R. Jacobs. Neutralization-Tests against Neurotropic Viruses with Sera Collected in Central Africa. „The Journal of Immunology”. 44, s. 9–23, 1942. (ang.).
- ↑ a b c d Taylor, R.M.; Work, T. H.; Hurlbut, H. S & F Rizk. A Study of the Ecology of West Nile Virus in Egypt.. „American Journal of Tropical Medicine and Hygiene”. 5, s. 579–620, 1956. ISSN 0002-9637. (ang.).
- ↑ McIntosh, B. M.; Jupp, P. G.; Dos Santos, I. & Meenehan, G. M. Epidemics of West Nile and Sindbis viruses in South Africa with Culex (Culex) univittatus Theobald as vector. „South African Journal of Science”. 72, s. 295–300, 1976. ISSN 0038-2353. (ang.).
- ↑ a b Work, T. H.; Hurlbüt, H. H. & R.M. Taylor. Indigenous Wild Birds of the Nile Delta as potential West Nile Virus circulating Reservoirs. „American Journal of Tropical Medicine and Hygiene”. 4, s. 872–888, 1955. ISSN 0002-9637. (ang.).
- ↑ a b Schmidt, J.R. & El Mansoury, H. K. Natural and Experimental Infection of Egyptian Equines with West Nile Virus. „Ann. Trop. Med. Parasit”. 57, s. 415–427, 1863. (ang.).
- ↑ Buckley A & Gould EA. Detection of virus-specific antigen in the nuclei or nucleoli of cells infected with Zika or Langat virus. „Tje Journal of General Virology”. 69, s. 1913–1920, 1988. (ang.).
- ↑ Philip, C. B. & Smadel, J. E. Transmission of West Nile Virus by Infected Aédes albopictus. „Proceedings of the Society for Experimental Biology and Medicine”. 53, s. 49–50, 1943. DOI: 10.3181/00379727-53-14180. ISSN 0037-9727. (ang.).


 French
French Deutsch
Deutsch