Ácido butanoico – Wikipédia, a enciclopédia livre
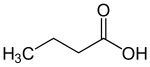
O ácido butanoico (ou ácido butírico) é um ácido monocarboxílico, saturado, de cadeia aberta, com fórmula molecular C4H8O2, massa molecular 88 u, e de fórmula estrutural CH3-CH2-CH2-COOH.
O nome usual ácido butírico é de origem grega: βουτυρος que significa "manteiga".
É o componente orgânico encontrado na manteiga rançosa, sendo um dos responsáveis pelo seu odor e sabor peculiares. É formado após a ação de micro-organismos sobre moléculas de gordura (triglicerídeos) presentes na manteiga.
Está presente tanto em alguns queijos, quanto no vômito, o que caracteriza o odor azedo dos dois.
Obtenção
[editar | editar código-fonte]Comercialmente é obtido a partir da oxidação do n-butiraldeído, derivado do acetileno, em presença de catalisadores:
- Acetileno → aldeído acético → crotonaldeído + H2 → n-butiraldeído + Ar (catalisador) → Ácido butírico
Equações:
- 2 C2H2 → 2 CH3-COH → CH3-CH=CH-COH + H2 → CH3-CH2-CH2-COH + ar → CH3-CH2-CH2-COOH
Aplicações e usos
[editar | editar código-fonte]- Ésteres do ácido butírico são produzidos para serem usados como sabores artificiais.
- Ésteres obtidos a partir da reação do ácido butírico com glicol ou glicerina são usados como agentes plastificantes.
- Os seus sais de cálcio são usados no tratamento do couro.
Referências
- ↑ a b c d Registo de CAS RN 107-92-6 na Base de Dados de Substâncias GESTIS do IFA, accessado em 06.01.2008.
- ↑ a b Thieme Chemistry, ed. (2009). RÖMPP Online - Version 3.5. Stuttgart: Georg Thieme Verlag KG
- ↑ «Solubility of butyric acid in methanol» [ligação inativa]
- ↑ Peter W. Atkins, Julio de Paula: Physikalische Chemie, 4. Auflage, Wiley-VCH, Weinheim 2006, S. 1118, ISBN 978-3-527-31546-8.
Bibliografia
[editar | editar código-fonte]- Voet & Voet; John Wiley & Sons, 1995


 French
French Deutsch
Deutsch