Psilocibina – Wikipédia, a enciclopédia livre
Psilocibina | |
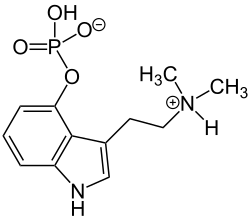 | |
 | |
Nome IUPAC (sistemática) | |
| 3-[2-(Dimethylamino)ethyl]-1H-indol-4-ol dihydrogen phosphate ester | |
Identificadores | |
| 520-52-5 | |
| Nenhum | |
| DB11664 | |
Informação química | |
| C₁₂H₁₇N₂O₄P | |
| 284.25 g/mol | |
| Psilocybine; Psilocibin; Psylocybin; Psilotsibin; fosfato de psilocina; éster fosfato de psilocina; O-fosforil-4‑hidroxi-N,N-dimetiltriptamina; 4‑fosforiloxi-N,N-dimetiltriptamina; 4‑fosforil-N,N-dimetiltriptamina; 4-PO-DMT; COMP360; COMP-360 | |
| Dados físicos | |
| 220–228 °C (Cristais a partir de água fervente)[1] °C | |
Farmacocinética | |
| Oral: 52,7 ± 20,4% (como psilocina) (n=3)[2][3][4] | |
| 66%[5] | |
| Hepático[3][2][6] | |
| Oral: 163 ± 64 min; Intravenoso: 74.1 ± 19.6 min[2][7] | |
| Urina (principalmente como psilocina‑O‑glucuronídeo, 2–4% como psilocina inalterada)[2][6][8] | |
Considerações terapêuticas | |
| Oral, Intravenosa | |
Psilocibina, também conhecida como 4‑fosforiloxi‑N,N‑dimetiltriptamina (4‑PO‑DMT),[a] é um produto natural droga psicodélica composto químico produzido por mais de 200 espécies de cogumelo.[10] Seus efeitos incluem euforia, alucinaçãos, alterações na percepção, uma sensação de percepção do tempo distorcida e experiências espirituais percebidas. Também pode causar reação adversas, como náusea e ataque de pânico. Seus efeitos dependem da disposição e ambiente e das expectativas do indivíduo.[11] e experiências espirituais.[3][12]
A psilocibina é uma pró-droga da psilocina.[10] Ou seja, o composto em si é biologicamente inativo, mas é rapidamente convertido pelo organismo em psilocina.[10] A psilocibina é transformada em psilocina por meio da desfosforilação mediada por posfatase enzima.[13][10] A psilocina é quimicamente relacionada à serotonina e atua como um agonista não seletivo dos receptor de serotonina.[10] A ativação de um receptor de serotonina, o receptor 5‑HT2A, é especificamente responsável pelos efeitos alucinógenos da psilocina e de outros psicodélicos serotoninérgicos.[10] A psilocibina é geralmente administrada por Via oral.[10] Por esta via, o início dos efeitos ocorre cerca de 20 a 50 minutos, o pico dos efeitos se dá por volta de 60 a 90 minutos, e a duração é de aproximadamente 4 a 6 horas.[3][14][10][15]
Imagens em Pintura rupestres e Arte rupestre da atual Argélia e Espanha sugerem que o uso humano de cogumelo psilocibinos precede a história registrada.[16] Na Mesoamérica, os cogumelos eram consumidos há muito tempo em cerimônias espirituais e divinatórios antes que cronistas espanhóis documentassem seu uso no século XVI. Em 1958, o químico suíço Albert Hofmann isolou a psilocibina e a psilocina do cogumelo Psilocybe mexicana. Seu empregador, Sandoz, comercializou e vendeu psilocibina pura a médicos e clínicos em todo o mundo para uso em Terapia psicodélica. Leis de drogas cada vez mais restritivas, a partir da década de 1960 e da década de 1970, restringiram as pesquisas científicas sobre os efeitos da psilocibina e de outros alucinógenos, mas sua popularidade como Enteógeno (agente que potencializa a espiritualidade) cresceu na década seguinte, em grande parte devido à maior disponibilidade de informações sobre como cultivar cogumelos psilocibinos.
A posse de cogumelos contendo psilocibina é ilegal na maioria dos países, e a psilocibina foi classificada como uma substância controlada de Tabela I sob a Convenção sobre Substâncias Psicotrópicas de 1971. A psilocibina vem sendo estudada como possível medicamento no tratamento de Transtorno psiquiátricos, como a Depressão e o Transtorno obsessivo-compulsivo, além de outras condições como as Cefaleia em salvas.[17] Encontra-se em ensaios clínicos de última fase para o tratamento da Depressão resistente ao tratamento.[18][19][20]
Usos
[editar | editar código-fonte]Ver também
A psilocibina é utilizada de forma recreativa, espiritualmente (como enteógeno) e medicamente. Geralmente é administrada por Via oral, embora outras Vias de administração também sejam empregadas.
Formas disponíveis
[editar | editar código-fonte]A psilocibina pode ser preparada sinteticamente, mas, fora do ambiente de pesquisa, normalmente não é utilizada nessa forma. A psilocibina presente em certas espécies de cogumelos pode ser ingerida de diversas maneiras: consumindo-se os corpos de frutificação frescos ou secos, preparando-se um Chá de ervas ou combinando-a com outros alimentos para mascarar o sabor amargo.[21] Em casos raros, pessoas injetaram extratos de cogumelos por via administração intravenosa.[22]
Efeitos
[editar | editar código-fonte]
Os efeitos da psilocibina são altamente variáveis e dependem da mentalidade e do ambiente em que o usuário vivencia a experiência: fatores comumente referidos como disposição e ambiente. No início dos anos 1960, Timothy Leary e colegas da Universidade de Harvard investigaram o papel da disposição e do ambiente nos efeitos da psilocibina. Administraram a droga a 175 voluntários (de diversas origens) em um ambiente concebido para ser semelhante a uma sala de estar confortável. Noventa e oito dos participantes receberam questionários para avaliar suas experiências e a contribuição de fatores de fundo e situacionais. Indivíduos que já tinham experiência com psilocibina antes do estudo relataram experiências mais agradáveis do que aqueles para quem a droga era nova. O tamanho do grupo, a dosagem, a preparação e as expectativas foram determinantes importantes na resposta à droga. Em geral, aqueles em grupos com mais de oito integrantes sentiram que o grupo era menos acolhedor e que suas experiências eram menos agradáveis. Por outro lado, grupos menores (menos de seis integrantes) foram considerados mais acolhedores e relataram reações mais positivas à droga nesses contextos. Leary e seus colegas propuseram que a psilocibina aumenta a sugestionabilidade, tornando o indivíduo mais receptivo a interações interpessoais e estímulos ambientais.[23] Esses achados foram confirmados em uma revisão posterior por Jos ten Berge (1999), que concluiu que a dosagem, a disposição e o ambiente eram fatores fundamentais na determinação dos resultados dos experimentos que testaram os efeitos das drogas psicodélicas na criatividade dos artistas.[24]
Após a ingestão de psilocibina, o usuário pode experimentar uma ampla gama de efeitos emocionais, que podem incluir: sentimentos de desorientação, letargia, tontura, Euforia, alegria e Depressão. Em um estudo, 31% dos voluntários que receberam uma alta dosagem relataram sentimentos de medo significativo e 17% experimentaram Paranoia transitória.[22] Em estudos na Johns Hopkins, entre os que receberam uma dosagem moderada (ainda suficiente para "proporcionar uma alta probabilidade de uma experiência profunda e benéfica"), experiências negativas foram raras, enquanto um terço dos que receberam uma alta dosagem experimentou ansiedade ou paranoia.[25][26] Doses baixas podem induzir efeitos alucinógenos. Podem ocorrer alucinações com os olhos fechados, nas quais o indivíduo vê formas geométricas multicoloridas e sequências imaginativas vívidas.[27] Alguns indivíduos relatam Sineestesia, como sensações táteis ao ver cores.[28]:175 Em doses mais elevadas, a psilocibina pode levar à "intensificação das respostas afetivas, aumento da capacidade de introspecção, regressão a um pensamento primitivo e infantil, e ativação de traços de memória vívidos com marcadas nuances emocionais".[29] Alucinações visuais com os olhos abertos são comuns e podem ser muito detalhadas, embora raramente confundidas com a realidade.[27]
Efeitos físicos
[editar | editar código-fonte]Respostas comuns incluem dilatação das pupilas (93%); alterações na Frequência cardíaca (100%), incluindo aumentos (56%), diminuições (13%) e respostas variáveis (31%); alterações na pressão arterial (84%), incluindo hipotensão (34%), hipertensão (28%) e instabilidade geral (22%); alterações no reflexo de estiramento (86%), incluindo aumentos (80%) e diminuições (6%); náusea (44%); Tremor (25%); e Dismetria (16%) (incapacidade de direcionar ou limitar movimentos adequadamente).[7][b] Os efeitos simpaticomiméticos ou cardiovascular da psilocibina, incluindo o aumento da Frequência cardíaca e da Pressão arterial, são geralmente leves.[12][7] Em média, a frequência cardíaca máxima aumenta em 5 bpm, a Pressão arterial sistólica máxima aumenta de 10 a 15 mmHg, e a Pressão arterial diastólica máxima aumenta de 5 a 10 mmHg.[12][7] Contudo, aumentos temporários na pressão arterial podem representar um fator de risco para usuários com hipertensão preexistente.[27] Os efeitos somáticos da psilocibina foram corroborados por diversos estudos clínicos iniciais.[31] Uma pesquisa publicada em 2005 com frequentadores de clubes no Reino Unido constatou que mais de um quarto dos usuários de cogumelos psilocibinos no ano anterior experienciaram náusea ou vômito, embora isso tenha sido causado pelo cogumelo e não pela psilocibina em si.[22] Em um estudo, a administração diária de dosagens crescentes de psilocibina por 21 dias não apresentou efeito mensurável nos níveis de eletrólito, glicose no sangue ou em testes de toxicidade hepática.[7]
Efeitos psiquiátricos e distúrbios perceptivos
[editar | editar código-fonte]
Sabe-se que a psilocibina influencia fortemente a experiência subjetiva da passagem do tempo.[32][11] Os usuários frequentemente sentem que o tempo desacelera, de modo que "minutos parecem horas" ou "o tempo está parado".[33] Estudos demonstraram que a psilocibina prejudica significativamente a capacidade dos sujeitos de estimar intervalos de tempo superiores a 2,5 segundos, compromete sua habilidade de sincronizar com intervalos interlatidos superiores a 2 segundos e reduz sua taxa preferida de taxa de toque.[33][34] Esses resultados são consistentes com o papel da droga em afetar a atividade do Córtex pré-frontal,[35] e com o papel conhecido do córtex pré-frontal na percepção do tempo.[36] Contudo, a base neuroquímica dos efeitos da psilocibina na percepção do tempo ainda não é conhecida com certeza.[37]
Usuários que têm uma experiência agradável podem sentir um senso de conexão com os outros, com a natureza e com o universo; outras percepções e emoções também costumam ser intensificadas. Já aqueles que têm uma experiência desagradável (uma "Viagem ruim") descrevem uma reação acompanhada por medo, outros sentimentos desagradáveis e, ocasionalmente, comportamentos perigosos. Em geral, a expressão "viagem ruim" é empregada para descrever uma reação caracterizada principalmente por medo ou outros sentimentos desagradáveis, e não apenas por uma experiência transitória desses sentimentos. Diversos fatores podem contribuir para que um usuário de psilocibina vivencie uma viagem ruim, incluindo o uso da droga durante um estado emocional ou físico negativo ou em um ambiente não acolhedor (ver: Disposição e ambiente). A ingestão de psilocibina em combinação com outras drogas, inclusive Álcool, também pode aumentar a probabilidade de uma viagem ruim.[22][38] Além da duração da experiência, os efeitos da psilocibina são semelhantes aos de dosagens comparáveis de acido lisérgico dietilamida (LSD) ou mescalina. Contudo, na Enciclopédia dos Psicodélicos, o autor Peter Stafford observou: "A experiência com psilocibina parece ser mais calorosa, menos forçada e menos isolante. Tende a construir conexões entre as pessoas, que geralmente se comunicam muito mais do que quando usam LSD."[39]:273
Rede da teoria da mente e rede de modo padrão
[editar | editar código-fonte]Estudos demonstraram que os psicodélicos, incluindo a psilocibina, afetam diferentes agrupamentos de regiões cerebrais conhecidos como a "rede da teoria da mente" (ToMN) e a rede de Modo Padrão (DMN).[40] A ToMN envolve a realização de inferências e a compreensão de situações sociais com base em padrões,[41] enquanto a DMN relaciona-se mais com a introspecção e o senso de si mesmo.[40] A DMN, em particular, está associada ao aumento da ruminação e ao agravamento da autoimagem em pacientes com Transtorno depressivo maior.[42] Em estudos realizados com o uso único de psilocibina, áreas da DMN apresentaram diminuição da conectividade funcional (comunicação entre áreas do cérebro). Isso fornece uma perspectiva funcional sobre o papel da psilocibina em aumentar o senso de conexão com o ambiente, uma vez que as áreas cerebrais envolvidas na introspecção diminuem sua funcionalidade sob os efeitos da droga.[43] Por outro lado, áreas do cérebro envolvidas na ToMN demonstraram aumento na atividade e na ativação funcional em resposta aos psicodélicos. Esses resultados não foram exclusivos da psilocibina, não havendo diferença significativa na ativação cerebral em ensaios semelhantes com mescalina e LSD. As informações e os estudos sobre a DMN e a ToMN ainda são relativamente escassos, e suas conexões com outras doenças psiquiátricas e o uso de psicodélicos permanecem amplamente desconhecidos.[40]
Percepções em grupo
[editar | editar código-fonte]Através de estudos mais aprofundados antropológicos sobre "insights pessoais"[44] e dos efeitos psicossociais da psilocibina, pode-se observar em muitas sociedades tradicionais que substâncias poderosas que atuam na mente, como a psilocibina, são regularmente consumidas ritualmente para fins terapêuticos ou para transcender a realidade cotidiana.[45] Efeitos positivos que a psilocibina exerce sobre os indivíduos podem ser observados ao adotar uma abordagem antropológica, afastando-se da visão biomédica ocidental; isso é corroborado pelos estudos realizados por Leary.[46] Em determinadas sociedades tradicionais, onde o uso de psilocibina é frequente em rituais de cura xamânica, os coletivos elogiam seu guia, curandeiro e xamã por ajudar a aliviar dores, desconfortos e sofrimentos, por meio de uma prática ritual em grupo na qual o coletivo, ou apenas o guia, ingere psilocibina para extrair eventuais "resíduos psíquicos tóxicos ou implantes feéricos" presentes no corpo.[45]
Terapias em grupo utilizando psicodélicos "clássicos" têm se tornado mais comuns no mundo ocidental na prática clínica.[47] Especula-se que essa prática se expandirá, desde que as evidências permaneçam indicativas de sua segurança e eficácia.[48] No sentido social, o grupo é moldado pelas experiências com a psilocibina e pela maneira como coletivamente percebem a planta. Como mencionado no artigo de antropologia, o grupo participa de uma "jornada" em conjunto, acrescentando assim ao corpo espiritual e social, onde papéis, hierarquias e gênero são entendidos de forma subjetiva.[45]
Significado cultural e experiências "místicas"
[editar | editar código-fonte]
Os cogumelos psilocibinos têm sido e continuam a ser utilizados em culturas indígenas das Américas em contextos religiosos, divinatórios ou espirituais. Refletindo o significado da palavra "Enteógeno" ("o deus interior"), os cogumelos são venerados como poderosos sacramentos espirituais que proporcionam acesso a mundos sagrados. Tipicamente utilizados em contextos comunitários de pequenos grupos, eles fortalecem a coesão de grupo e reafirmam os valores tradicionais.[49] Terence McKenna documentou as práticas mundiais de uso de cogumelos psilocibinos como parte de um Ethos cultural relacionado à Terra e aos mistérios da natureza, sugerindo que os cogumelos aprimoram a Autoconsciência e o senso de contato com um "Outro Transcendente" — refletindo uma compreensão mais profunda da nossa conexão com a natureza.[50]
Drogas psicodélicas podem induzir estados de Consciência que possuem significado pessoal duradouro e relevância espiritual em pessoas com inclinação religiosa ou espiritual; esses estados são chamados de Experiência mística.[51][52] Na década de 1960, Walter Pahnke e colegas avaliaram sistematicamente as experiências místicas (às quais chamaram de "consciência mística") categorizando suas características comuns. De acordo com Pahnke, essas categorias "descrevem o cerne de uma experiência psicológica universal, livre de interpretações filosóficas ou teológicas determinadas culturalmente", permitindo aos pesquisadores avaliar as experiências místicas em uma escala qualitativa e numérica.[53]
No Experimento da Capela Marsh de 1962, conduzido por Pahnke na Escola de Divindade de Harvard sob a supervisão de Leary,[54] quase todos os voluntários estudantes de seminário que receberam psilocibina relataram experiências religiosas profundas.[55] Um dos participantes foi o estudioso religioso Huston Smith, autor de diversos manuais sobre Religião comparada; ele chamou sua experiência de "o retorno cósmico mais poderoso que já experimentei".[56] Em um acompanhamento 25 anos após o experimento, todos os sujeitos que receberam psilocibina afirmaram que sua experiência continha elementos de "uma genuína natureza mística" e a caracterizaram como um dos pontos altos de sua vida espiritual.[57]:13 O pesquisador de psicodélicos Rick Doblin considerou o estudo parcialmente falho devido à implementação incorreta do procedimento de Duplo-cego e a diversas perguntas imprecisas no questionário de experiência mística. Mesmo assim, afirmou que o estudo lançou "considerável dúvida sobre a afirmação de que as experiências místicas catalisadas por drogas são, de alguma forma, inferiores às experiências místicas não induzidas por drogas, tanto em seu conteúdo imediato quanto em seus efeitos a longo prazo".[57]:24 O psiquiatra William A. Richards ecoou esse sentimento, escrevendo em uma revisão de 2007: "[o uso de cogumelos psicodélicos] pode constituir uma tecnologia para evocar experiências reveladoras que são semelhantes, senão idênticas, às que ocorrem por meio de alterações espontâneas na química cerebral."[58]
Um grupo de pesquisadores da Escola de Medicina Johns Hopkins, liderado por Roland Griffiths, conduziu um estudo para avaliar os efeitos psicológicos imediatos e a longo prazo da experiência com psilocibina, utilizando uma versão modificada do questionário de experiência mística e um rigoroso procedimento de duplo-cego.[59] Questionado em entrevista sobre a semelhança de seu trabalho com o de Leary, Griffiths explicou: "Estamos conduzindo uma pesquisa rigorosa e sistemática com psilocibina sob condições cuidadosamente monitoradas, um caminho que o Dr. Leary abandonou no início dos anos 1960."[60] Especialistas elogiaram o estudo financiado pelo Instituto Nacional de Abuso de Drogas, publicado em 2006, pela solidez de seu desenho experimental.[c] No experimento, 36 voluntários sem experiência prévia com alucinógenos receberam psilocibina e Metilfenidato (Ritalina) em sessões separadas; as sessões com metilfenidato serviram como Controle científico e Placebo psicoativo. O grau da experiência mística foi medido utilizando um questionário desenvolvido por Ralph W. Hood;[61] 61% dos sujeitos relataram uma "experiência mística completa" após a sessão com psilocibina, enquanto apenas 13% relataram tal resultado após a experiência com metilfenidato. Dois meses após a ingestão de psilocibina, 79% dos participantes relataram um aumento moderado a significativo na Satisfação com a vida e no senso de bem-estar. Cerca de 36% dos participantes também tiveram uma intensa a extrema "experiência de medo" ou Disforia (ou seja, uma "viagem ruim") em algum momento durante a sessão com psilocibina (o que não foi relatado por nenhum sujeito durante a sessão com metilfenidato); aproximadamente um terço desses (13% do total) relatou que essa disforia dominou toda a sessão. Esses efeitos negativos foram considerados facilmente manejáveis pelos pesquisadores e não tiveram impacto negativo duradouro no senso de bem-estar dos sujeitos.[62]
Um estudo de acompanhamento 14 meses depois confirmou que os participantes continuaram a atribuir um profundo significado pessoal à experiência. Quase um terço dos sujeitos relatou que a experiência foi o evento mais significativo ou espiritualmente relevante de suas vidas, e mais de dois terços afirmaram que foi um dos cinco eventos espiritualmente mais importantes. Cerca de dois terços disseram que a experiência aumentou seu senso de bem-estar ou satisfação com a vida.[55] Mesmo após 14 meses, aqueles que relataram experiências místicas apresentaram, em média, 4 pontos percentuais a mais na característica de Abertura para a experiência (Openness/Intellect); traços de personalidade tendem a se manter estáveis ao longo da vida adulta. Da mesma forma, em um estudo via web realizado em 2010, destinado a investigar as percepções dos usuários sobre os benefícios e malefícios do uso de drogas alucinógenas, 60% dos 503 usuários de psilocibina relataram que o uso da substância teve um impacto positivo a longo prazo em seu senso de bem-estar.[22][63]
Embora muitos estudos recentes tenham concluído que a psilocibina pode induzir experiências do tipo místico, dotadas de um significado pessoal substancial e duradouro e de relevância espiritual, a comunidade médica não concorda de forma unânime. O ex-diretor do Departamento de Psiquiatria e Ciências do Comportamento da Johns Hopkins—Paul R. McHugh—escreveu em uma resenha de livro: "O fato não mencionado em The Harvard Psychedelic Club é que LSD, psilocibina, mescalina e similares não produzem uma 'consciência superior', mas sim um tipo particular de 'consciência inferior', bem conhecido por psiquiatras e neurologistas—a saber, 'Tóxico Delírio'."[64]
Contraindicações
[editar | editar código-fonte]As Contraindicaçãos da psilocibina são, em sua maioria, condição psiquiátricas que aumentam o risco de angústia psicológica, incluindo o raro Efeito adverso de Psicose durante ou após a experiência psicodélica.[3][65] Essas condições podem incluir histórico de psicose, Esquizofrenia, Transtorno bipolar ou Transtorno de personalidade borderline.[3][66] Pesquisas adicionais podem fornecer mais informações sobre segurança no uso da psilocibina em pessoas com tais condições.[3] É notável, nesse sentido, que a psilocibina e outros psicodélicos estão sendo estudados para o potencial tratamento de todas as condições mencionadas.[67][68][69][70][71][72]
A psilocibina também é considerada contraindicada em mulheres grávidas ou em período de amamentação, devido à insuficiência de pesquisas nessa população.[3] Há aumentos transitórios na frequência cardíaca e na pressão arterial com a psilocibina, e, portanto, condições cardiovasculares não controladas são uma contraindicação relativa para a psilocibina.[3] Antagonistas do receptor 5-HT2A da serotonina – como os antipsicóticos atípicos e certos antidepressivos – podem bloquear os efeitos alucinógenos da psilocibina e, assim, serem considerados contraindicados nesse sentido.[73][74] Os inibidor de monoamina oxidase (IMAO) podem potencializar os efeitos da psilocibina e aumentar seus riscos.[73]
Efeitos adversos
[editar | editar código-fonte]A maioria dos poucos incidentes fatais associados ao uso de cogumelos psicodélicos envolve o uso simultâneo de outras drogas, especialmente o álcool. Um Efeito adverso comum decorrente do uso de cogumelos contendo psilocibina envolve "bad trips" ou reações de ataque de pânico, nas quais as pessoas ficam ansiosas, confusas, agitadas ou desorientadas.[75] Acidentes, Autolesão ou tentativas de Suicídio podem resultar de casos graves de episódios psicóticos agudos.[22] Nenhum estudo associou a psilocibina a defeitos congênitos,[76] mas recomenda-se que mulheres grávidas evitem seu uso.[77]
Psiquiátricos
[editar | editar código-fonte]Reações de pânico podem ocorrer após o consumo de cogumelos contendo psilocibina, especialmente se a ingestão for acidental ou de outra forma inesperada. Reações caracterizadas por comportamentos violentos, pensamentos suicidas,[78] psicose semelhante à esquizofrenia,[79][80] e Convulsãos[81] foram relatadas na literatura. Uma pesquisa de 2005 realizada no Reino Unido constatou que quase um quarto daqueles que haviam utilizado cogumelos com psilocibina no ano anterior havia experimentado um ataque de pânico.[22] [não consta na fonte citada] Efeitos adversos menos frequentemente relatados incluem paranoia, Confusão, prolongada Derealização (desconexão da realidade) e Mania.[63] O uso de psilocibina pode induzir temporariamente um estado de transtorno de despersonalização.[82] O uso por indivíduos com Esquizofrenia pode induzir estados psicóticos agudos que requerem hospitalização.[83]
A semelhança dos sintomas induzidos pela psilocibina com os da esquizofrenia tornou a droga uma ferramenta de pesquisa útil em estudos comportamentais e de Neuroimagem sobre a esquizofrenia.[84][85][86] Em ambos os casos, acredita-se que os sintomas psicóticos surjam de uma "falta de filtragem de informações sensoriais e cognitivas" no cérebro que leva à "fragmentação cognitiva e psicose".[85] Os flashbacks (recorrências espontâneas de uma experiência prévia com psilocibina) podem ocorrer muito tempo após o uso da substância. O Transtorno de percepção persistente por alucinógenos (TPPA) é caracterizado pela presença contínua de distúrbios visuais semelhantes aos gerados por substâncias psicodélicas. Nem os flashbacks nem o TPPA estão comumente associados ao uso de psilocibina,[22] e as correlações entre TPPA e psicodélicos são ainda mais obscurecidas pelo Uso de múltiplas drogas e outras variáveis.[87]
Tolerância e dependência
[editar | editar código-fonte]
A tolerância à psilocibina se desenvolve e se dissipa rapidamente; sua ingestão mais de aproximadamente uma vez por semana pode levar a efeitos diminuídos.[89] A tolerância desaparece após alguns dias, de modo que as doses podem ser espaçadas por vários dias para evitar esse efeito.[89] Pode-se desenvolver uma Tolerância cruzada entre a psilocibina e o LSD,[90] e entre a psilocibina e Fenetilaminas como a Mescalina e o DOM.[91] O uso repetido de psilocibina não leva à Dependência física.[7] Um estudo de 2008 concluiu que, com base em dados dos EUA de 2000 a 2002, o uso de drogas alucinógenas (incluindo a psilocibina) iniciado na adolescência (definido aqui como entre 11 e 17 anos) não aumentou o risco de Dependência de drogas na idade adulta; isso contrastou com o uso na adolescência de Cannabis, Cocaína, Inalantes, medicamentos Ansiolíticos e Estimulantes, os quais foram associados a "um risco excessivo de desenvolver características clínicas associadas à dependência de drogas".[92] Da mesma forma, um estudo holandês de 2010 classificou o dano relativo dos cogumelos contendo psilocibina em comparação com uma seleção de 19 Drogas recreativas, incluindo Álcool, Cannabis, Cocaína, êxtase, Heroína e Tabaco. Os cogumelos contendo psilocibina foram classificados como a droga ilícita com o menor dano,[93] corroborando conclusões alcançadas anteriormente por grupos de especialistas no Reino Unido.[94]
Efeitos a longo prazo
[editar | editar código-fonte]Um risco potencial do uso repetido frequente de psilocibina e outros psicodélicos é a Fibrose cardíaca e a Valvulopatia causada pela ativação do [[receptor 5-HT2B]] da Serotonina.[95][96] Mas doses únicas elevadas ou doses espaçadas (por exemplo, com meses de intervalo) são consideradas seguras, e as preocupações sobre toxicidade cardíaca aplicam-se mais à Microdosagem psicodélica crônica ou ao uso intermitente muito frequente (por exemplo, semanalmente).[95][96]
Sobredose
[editar | editar código-fonte]A psilocibina possui baixa Toxicidade, o que significa que há baixo risco de induzir eventos com risco de vida, como problemas respiratórios ou cardíacos.[75] Pesquisas mostram que riscos à saúde podem se desenvolver com o uso de psilocibina. No entanto, as Hospitalizações decorrentes são raras, e as Sobredoses são geralmente leves e autolimitadas.[75] Uma revisão sobre o manejo de sobredosagens por psicodélicos sugeriu que o manejo de sobredosagens relacionadas à psilocibina deve priorizar o controle dos efeitos adversos imediatos, como ansiedade e paranoia, em vez de intervenções farmacológicas específicas, uma vez que a toxicidade fisiológica da psilocibina tende a ser bastante limitada.[97] Uma análise de pessoas hospitalizadas por intoxicação com psilocibina encontrou altas concentrações urinárias de Fenetilamina (PEA), indicando que a PEA pode contribuir para os efeitos da intoxicação por psilocibina.[97]
Em ratos, a Dose letal mediana (DL50) quando administrada por via oral é de 280 mg/kg, aproximadamente uma vez e meia maior do que a da Cafeína. A dose letal de psilocibina quando administrada Intravenosamente em camundongos é de 285 mg/kg e em ratos é de 280 mg/kg.[1] Quando administrada Intravenosamente em coelhos, a DL50 da psilocibina é de aproximadamente 12,5 mg/kg.[98] A psilocibina compõe aproximadamente 1% do peso dos cogumelos Psilocybe cubensis, de modo que seriam necessários cerca de 1,7 kg de cogumelos secos, ou 17 kg de cogumelos frescos, para que uma pessoa de 60 kg atingisse o valor de 280 mg/kg (DL50) observado em ratos.[22] Com base nos resultados de estudos em animais, a Dose letal de psilocibina foi extrapolada para ser de 6 gramas, 1.000 vezes maior do que a dose efetiva de 6 miligramas.[99] O Registro de Efeitos Tóxicos de Substâncias Químicas atribui à psilocibina um Índice terapêutico relativamente alto de 641 (valores mais altos correspondem a um perfil de segurança melhor); para comparação, os índices terapêuticos da Aspirina e da Nicotina são 199 e 21, respectivamente.[100] A dose letal decorrente exclusivamente da toxicidade da psilocibina é desconhecida e raramente foi documentada—Desde 2011[update], apenas dois casos atribuídos a uma sobredosagem de cogumelos alucinógenos (sem o uso concomitante de outras drogas) foram relatados na literatura científica, e esses podem envolver fatores além da psilocibina.[22][d]
Interações
[editar | editar código-fonte]Antagonistas do receptor 5-HT2A da Serotonina podem bloquear os efeitos alucinógenos de psicodélicos serotoninérgicos como a psilocibina.[73][103] Numerosos medicamentos atuam como antagonistas do receptor 5-HT2A da serotonina, incluindo Antidepressivos como Trazodona e Mirtazapina, Antipsicóticos como Quetiapina, Olanzapina e Risperidona, e outros agentes como Ketanserina, Pimavanserina, Ciproheptadina e Pizotifeno.[73][74] Tais medicamentos são às vezes chamados de "Estraga-trip" porque podem prevenir ou abortar os efeitos alucinógenos dos psicodélicos.[104][74][105] Antagonistas do receptor 5-HT2A da serotonina que foram especificamente demonstrados em estudos clínicos para diminuir ou abolir os efeitos da psilocibina incluem a ketanserina, a risperidona e a Clorpromazina.[73][103]
O receptor 5-HT1A da Serotonina, agonista parcial, Buspirona, foi encontrado para reduzir de maneira marcante os efeitos alucinógenos da psilocibina em humanos.[73][103][106][107] Por outro lado, o antagonista do receptor 5-HT1A da serotonina, Pindolol, foi encontrado para potencializar os efeitos alucinógenos do psicodélico relacionado Dimetiltriptamina (DMT) em duas a três vezes em humanos.[107][108] Os Inibidor seletivo da recaptação de serotonina (ISRS) podem modificar os efeitos da psilocibina.[73][103][109] Um ensaio clínico constatou que os efeitos alucinógenos e os efeitos "positivos" da psilocibina não foram modificados pelo ISRS Escitalopram, mas que seus "efeitos negativos", como a Ansiedade, bem como a Dissolução do ego, foram reduzidos, entre outras mudanças.[103][73][109]
Benzodiazepínicos como Diazepam, Alprazolam, Clonazepam e Lorazepam, assim como o Álcool, que atuam como [[Modulador alostérico positivo do receptor GABAA]], têm sido estudados de forma limitada em combinação com a psilocibina e outros psicodélicos, e não se sabe que interajam diretamente com eles.[103][73] Mas esses medicamentos GABAérgicos produzem efeitos como anxiolise, Sedação e Amnésia, e, portanto, podem diminuir ou de outra forma contrariar os efeitos dos psicodélicos.[73][104][74][105][110] Por causa disso, usuários recreativos frequentemente utilizam benzodiazepínicos e Álcool como "Estraga-trip" para gerenciar experiências alucinógenas difíceis com psicodélicos, como experiências marcadas por ansiedade proeminente.[104][74][105] A segurança dessa estratégia não é totalmente clara e pode apresentar riscos,[104][103][74][105] mas os benzodiazepínicos têm sido utilizados para gerenciar os efeitos psicológicos adversos dos psicodélicos em estudos clínicos e em Departamento de emergência.[103][111][112][113][114] Um ensaio clínico de coadministração de psilocibina e Midazolam constatou que o midazolam obscureceu os efeitos da psilocibina e prejudicou a memória da experiência.[115][116] Os benzodiazepínicos podem interferir com os efeitos terapêuticos de psicodélicos como a psilocibina, tais como os efeitos antidepressivos sustentados.[117][118]
Psilocina, a forma ativa da psilocibina, é um substrato da Monoamina oxidase (MAO) Enzima MAO-A.[119][120][8] A extensão exata em que a psilocina (e, por extensão, a psilocibina) é metabolizada pela MAO-A não é totalmente clara, mas variou de 4% a 33% em diferentes estudos baseados na Excreção de Metabólito.[119][120][8] Os níveis circulantes do Metabólito de psilocina Deaminado são muito mais elevados do que os da psilocina livre não metabolizada com a administração de psilocibina.[2][4] A combinação de psicodélicos que são substratos da MAO com Inibidor de monoamina oxidases (IMAO) pode resultar em Sobredose e Toxicidade.[73] Exemplos de IMAOs que podem potencializar psicodélicos que se comportam como substratos da MAO-A, como a psilocina, incluem Fenelzina, Trancilcipromina, Isocarboxazida e Moclobemida, bem como Alcaloide harmalas como a Harmina e a Harmalina e o Tabagismo crônico.[73][121]
A psilocina pode ser metabolizada, em menor extensão, pelas Enzimas do citocromo P450 (CYP450) Enzimas CYP2D6 e/ou CYP3A4 e parece improvável que seja metabolizada por outras enzimas do CYP450.[119][12] O papel das enzimas do CYP450 no metabolismo da psilocina parece ser pequeno, e, portanto, interações medicamentosas consideráveis com inibidores de enzimas do CYP450 e/ou indutores de enzimas podem não ser esperadas.[119][12] A principal Via metabólica da psilocina é a Glucuronidação por enzimas UDP-glicuronosiltransferase, incluindo a UGT1A10 e a UGT1A9.[103] Diclofenaco e Probenecida são inibidores dessas enzimas que, teoricamente, poderiam inibir o metabolismo e, assim, potencializar os efeitos da psilocibina,[103] mas não existem pesquisas clínicas ou evidências sobre essa possível interação.[103]
Farmacologia
[editar | editar código-fonte]Farmacodinâmica
[editar | editar código-fonte]| Alvo | Afinidade (Ki, nM) |
|---|---|
| 5-HT1A | 49–567 (Ki) 853–>3.160 (EC50) ND (Emax) |
| 5-HT1B | 31–305 |
| 5-HT1D | 19–36 |
| 5-HT1E | 44–52 |
| 5-HT1F | ND |
| 5-HT2A | 6,0–340 (Ki) 2,4–3.836 (EC50) 16–98% (Emax) |
| 5-HT2B | 4,6–410 (Ki) 2,4–>20.000 (EC50) 38–84% (Emax) |
| 5-HT2C | 10–141 (Ki) 30,3 (EC50) 95,1% (Emax) |
| 5-HT3 | >10.000 |
| 5-HT4 | ND |
| 5-HT5A | 70–84 |
| 5-HT6 | 57–72 |
| 5-HT7 | 3,5–72 |
| α1A–α1B | >10.000 |
| α2A | 1.379–2.044 |
| α2B | 1.271–1.894 |
| α2C | 4.404 |
| β1–β2 | >10.000 |
| D1 | 20–>14.000 |
| D2 | 3.700–>10.000 |
| D3 | 101–8.900 |
| D4 | >10.000 |
| D5 | >10.000 |
| H1 | 1.600–>10.000 |
| H2–H4 | >10.000 |
| M1–M5 | >10.000 |
| σ1 | >10.000 |
| σ2 | >10.000 |
| I2 | 792 |
| TAAR1 | 1.400 (Ki) (rato) 17.000 (Ki) (camundongo) 920–2.700 (EC50) (roedor) >30.000 (EC50) (humano) |
| SERT | 3.800–>10.000 (Ki) 662–3.900 (IC50) 561 (EC50) 54% (Emax) |
| NET | 13.000 (Ki) 14.000 (IC50) >10.000 (EC50) |
| DAT | 6.000–>30.000 (Ki) >100.000 (IC50) >10.000 (EC50) |
| Notas: Quanto menor o valor, mais avidamente a psilocina interage com o sítio. Fontes:[122][123][124][125][15][2][8][126][127] | |
A psilocibina é um Psicodélico serotoninérgico que atua como pró-droga da psilocina, a forma ativa da droga.[15][2] A psilocina é um análogo estrutural próximo do neurotransmissor de monoaminas Serotonina e, assim como a serotonina, atua como um não seletivo agonista dos Receptores de serotonina, inclusive comportando-se como um agonista parcial.[15][2][8] Apresenta alta afinidade para a maioria dos receptores de serotonina, com a notável exceção do receptor de serotonina 5-HT3.[15][2][8] A afinidade da psilocina pelo receptor de serotonina 5-HT2A é 15 vezes maior em humanos do que em ratos, devido a diferenças entre espécies.[8][137] Além de interagir com os receptores de serotonina, a psilocina é um agente liberador parcial de serotonina com menor potência.[131][132] Ao contrário de certos outros psicodélicos, como o LSD, parece apresentar pouca afinidade para muitos outros alvos, tais como receptores de dopamina.[10][15][12][127][122][124] A psilocina é um agonista do Receptor associado a traços de amina 1 em camundongos e ratos, mas não em humanos.[136][127][138]
Os efeitos psicodélicos da psilocibina e da psilocina são mediados especificamente pelo agonismo do receptor de serotonina 5-HT2A.[15][2] Antagonistas seletivos do receptor de serotonina 5-HT2A, como a volinanserin, bloqueiam a resposta de tremor de cabeça (HTR), um parâmetro comportamental dos efeitos psicodélicos induzido pela psilocibina em roedores, e a HTR está igualmente ausente em camundongos knockout para o receptor de serotonina 5-HT2A.[2][8][139][138] Existe uma relação significativa entre os efeitos alucinógenos da psilocibina e a ocupação do receptor de serotonina 5-HT2A em humanos.[15][91][140] Os efeitos psicodélicos da psilocibina podem ser bloqueados por antagonistas do receptor de serotonina 5-HT2A, como a ketanserina e a risperidona, em humanos.[141][15][2][91][79] A ativação dos receptores de serotonina 5-HT2A na camada V do córtex pré-frontal medial (mPFC) e a consequente liberação de glutamato nessa área têm sido especialmente implicadas nos efeitos alucinógenos da psilocibina e de outros psicodélicos serotoninérgicos.[142][143][144][145][146] Além disso, alterações regionais nos níveis de glutamato no cérebro podem estar relacionadas à experiência de dissolução do ego.[147] A ativação do receptor 5-HT1A parece inibir os efeitos alucinógenos da psilocibina e de outros psicodélicos.[73][106][107][108]
Embora a agonismo do receptor de serotonina 5-HT2A medie os efeitos Alucinógenos da psilocibina e da psilocina, a ativação de outros receptores de serotonina também parece contribuir para os efeitos psicoativos e comportamentais desses compostos.[91][2][8][148][149][150]
Alguns dos efeitos comportamentais não alucinógenos da psilocibina em animais podem ser revertidos por antagonistas dos receptores de serotonina 5-HT1A, 5-HT2B e 5-HT2C receptor.[2][8] A psilocibina produz uma profunda diminuição locomotora e comportamento investigativo em roedores, e isso parece depender da ativação do receptor de serotonina 5-HT1A, mas não da ativação dos receptores de serotonina 5-HT2A ou 5-HT2C.[144][145][151] Além disso, o receptor de serotonina 5-HT1B receptor foi identificado como necessário para os efeitos persistentes semelhantes a Antidepressivos e Ansiolíticos da psilocibina, bem como para a hipolocomotor acuta em animais.[152] Em humanos, a quetanserina bloqueou os efeitos alucinógenos da psilocibina, mas não todos os seus efeitos cognitivos e comportamentais.[91] A ativação do receptor de serotonina 5-HT2C e a subsequente inibição da via dopaminérgica mesolímbica podem estar envolvidas no limitado Potencial de dependência dos psicodélicos serotoninérgicos, como a psilocibina.[153]
Além de seus efeitos psicodélicos, verificou-se que a psilocina produz efeitos Psicoplastogênicos em animais, incluindo Dendritogênese, Spinogênese e Sinaptogênese.[154][2][155] Observou-se que a psilocina promove Neuroplasticidade no cérebro de forma rápida, robusta e sustentada com uma única dose.[154][2] Esses efeitos parecem ser mediados pela ativação intracelular do receptor de serotonina 5-HT2A.[154][2][156][155] Os efeitos psicoplastogênicos da psilocibina e de outros psicodélicos serotoninérgicos podem estar envolvidos em seus potenciais benefícios terapêuticos no tratamento de Transtorno psiquiátricos, como a depressão.[157][158][159] Eles também podem estar envolvidos nos efeitos da microdosagem.[160] A psilocina também foi relatada como um modulador alostérico positivo potente do receptor tropomiosina quinase B (TrkB), um dos Receptors do Fator neurotrófico derivado do cérebro (BDNF).[154][12][161] Porém, verificou-se que a psilocibina inibe a Neurogênese no Hipocampo de roedores.[154]
A psilocibina produz profundos efeitos Anti-inflamatórios mediados pela ativação do receptor de serotonina 5-HT2A em estudos pré-clinicos.[162][163][164] Esses efeitos possuem uma potência semelhante à do (R)-DOI, e seus efeitos anti-inflamatórios ocorrem em doses muito inferiores às necessárias para produzir efeitos alucinógenos em animais.[165][162][163][166] Os efeitos anti-inflamatórios da psilocibina podem estar envolvidos em seus potenciais benefícios antidepressivos e também ter outras aplicações terapêuticas, como o tratamento de Asma e Neuroinflamação.[162][163][167] Eles também podem estar envolvidos nos efeitos da microdosagem.[168][164] Entretanto, os psicodélicos demonstraram efeitos anti-inflamatórios apenas no contexto de uma Inflamação pré-existente, podendo ser Pró-inflamatórios fora desse cenário.[169] Verificou-se que a psilocibina tem um impacto grande e duradouro sobre o Microbioma intestinal e influencia o Eixo intestino-cérebro em animais.[170][171][172][149][173][174] Esses efeitos são parcialmente, mas não totalmente, dependentes da ativação dos receptores de serotonina 5-HT2A e/ou 5-HT2C.[149] Alguns dos efeitos comportamentais e potenciais efeitos terapêuticos da psilocibina podem ser mediados por alterações no microbioma intestinal.[149][172][174] A transferência de conteúdos intestinais de roedores tratados com psilocibina para roedores não tratados resultou em alterações comportamentais consistentes com os observados após a administração de psilocibina.[149]
A psilocibina e outros psicodélicos produzem efeitos Simpaticomiméticos, tais como aumento da Frequência cardíaca e da Pressão arterial, ao ativar o receptor de serotonina 5-HT2A.[133][175][176] O uso repetido a longo prazo da psilocibina pode resultar em risco de Valvulopatia cardíaca e outras complicações ao ativar receptores de serotonina 5-HT2B.[10][95][96][133][175]
Há pouca ou nenhuma Tolerância a drogas aguda com a psilocibina, de forma que sua Duração de ação é determinada pela Farmacocinética e não pela Farmacodinâmica.[15][120] Por outro lado, a tolerância e a Taquifilaxia desenvolvem-se rapidamente aos efeitos psicodélicos da psilocibina com administração repetida em humanos.[10][177][144][91] Além disso, ocorre Tolerância cruzada com os efeitos alucinógenos de outros psicodélicos, como o LSD.[10][177][144][91] A psilocibina produz Downregulação do receptor de serotonina 5-HT2A no cérebro de animais, efeito considerado responsável pelo desenvolvimento da tolerância aos seus efeitos psicodélicos.[10][177][144][91] Os receptores de serotonina 5-HT2A parecem retornar gradualmente ao longo de dias a semanas após a administração de psilocibina.[10]
Farmacocinética
[editar | editar código-fonte]Absorção
[editar | editar código-fonte]Há poucas pesquisas sobre a Biodisponibilidade da psilocibina.[178] Sua biodisponibilidade via oral, na forma ativa psilocina, foi de aproximadamente 55,0% (± ~20%) em comparação com a Administração intravenosa em um pequeno estudo antigo (n = 3).[178][2][3][4] Após a administração oral, a psilocibina é detectável na circulação sanguínea entre 20 a 40 minutos, e a psilocina passa a ser detectável após 30 minutos.[3][8] O tempo médio para atingir os níveis de pico da psilocina varia de 1,05 a 3,71 horas em diferentes estudos, sendo a maioria em torno de 2 horas – o valor de 3,71 horas configura um valor atípico.[178][179][8]
A psilocibina, em termos de psilocina, apresenta uma farmacocinética claramente linear ou dependente da dose.[178][15][2][3][120][180] As concentrações máximas de psilocina atingiram 11 ng/mL, 17 ng/mL e 21 ng/mL com doses orais de 15, 25 e 30 mg de psilocibina, respectivamente.[120] Os níveis máximos de psilocina variaram de 8,2 ng/mL a 37,6 ng/mL em uma faixa de doses de 14 a 42 mg.[179] A concentração de pico normalizada pela dose da psilocina é de aproximadamente 0,8 ng/mL/mg.[178] A Variabilidade interindividual na farmacocinética da psilocibina é relativamente pequena.[120] Verificou-se uma forte correlação positiva entre a dose e os níveis de pico de psilocina (R2 = 0,95).[179] Os efeitos da alimentação sobre a farmacocinética da psilocibina não foram relatados e permanecem desconhecidos, embora análises preliminares não tenham evidenciado influência significativa; há, contudo, sugestões de que a presença de alimentos possa retardar a absorção, reduzir os níveis de pico e diminuir a biodisponibilidade.[178][12]
Distribuição
[editar | editar código-fonte]A psilocina, forma ativa da psilocibina, é amplamente distribuída para todos os Tecidos através da corrente sanguínea.[3] Seu Volume de distribuição situa-se entre 505 e 1.267 L.[178] A própria psilocibina é Hidrofílica devido ao seu Grupo fosfato, o que dificulta sua passagem pela Barreira hematoencefálica, enquanto a psilocina é Lipofílica e atravessa essa barreira com facilidade para exercer seus efeitos no sistema nervoso central.[3] A ligação da psilocibina às proteínas plasmáticas é de 66%, indicando um grau moderado de ligação.[5]

A psilocina (4-HO-DMT) é um Isômero posicional próximo da Bufotenina (5-HO-DMT), que apresenta seletividade periférica e, portanto, espera-se que possua lipofilicidade e permeabilidade pela barreira hematoencefálica igualmente restritas.[181][182] Porém, a psilocibina parece não apenas depender do formato linear da psilocina, mas também formar um pseudo-sistema cíclico, no qual seu Grupo hidroxila e Amina interagem por meio de Ligação de hidrogênio, tornando-a muito menos polar, mais lipofílica e, consequentemente, mais apta a atravessar a barreira hematoencefálica para exercer ações centrais; além disso, esse mecanismo pode protegê-la do metabolismo pela Monoamina oxidase.[181][182][129][183] Esse fenômeno torna a psilocina muito menos polar e mais lipofílica, facilitando sua passagem pela barreira hematoencefálica e aumentando sua capacidade de exercer efeitos centrais. Em contrapartida, a bufotenina não forma esse pseudo-sistema cíclico, o que a torna menos lipofílica em termos de Coeficiente de partição.[181][182] Entretanto, a bufotenina ainda apresenta permeabilidade central significativa e, assim como a psilocibina, pode produzir efeitos alucinógenos robustos em humanos.[182][129][184][185]
Metabolismo
[editar | editar código-fonte]
A psilocibina é desfosforilada em sua forma ativa, a psilocina, no organismo.[3][2][6] A psilocibina é metabolizada nos Intestinos, Fígado, Rins, Sangue e outros tecidos e Fluidos corporais.[178][186][119] Há um metabolismo de primeira passagem significativo da psilocibina e da psilocina com administração oral.[178][119] Nenhuma psilocibina foi detectada no sangue em humanos após administração oral, sugerindo uma desfosforilação praticamente completa em psilocibina na primeira passagem.[178][2][6][119] Diz-se ainda que é convertida de 90% a 97% em psilocina.[187] O inibidor competitivo de fosfatase, β-glicerofosfato, que inibe a desfosforilação da psilocibina, atenua consideravelmente os efeitos comportamentais da psilocibina em roedores.[8][119][188] A psilocibina sofre desfosforilação em psilocina por meio do ambiente Ácido do Estômago ou das ações da Fosfatase alcalina (ALP) e de esterasas inespecíficas em tecidos e fluidos.[189][186][8]
A psilocina é desmetilada e desaminada oxidativamente pela Monoamina oxidase (MAO), especificamente pela Monoamina oxidase A (MAO-A), em 4‑hidroxiindol‑3‑acetaldeído (4‑HIAL ou 4‑HIA).[2][6][190] O 4‑HIAL é então oxidado adicionalmente em 4‑hidroxiindol‑3‑acético (4‑HIAA) pela Aldeído desidrogenase (ALDH) ou em 4‑hidroxitiptol (4‑HTOL ou 4‑HTP) pela Álcool desidrogenase.[2][6] A desaminação da psilocina pela MAO‑A parece ser responsável por cerca de 4% ou 33% de seu metabolismo em diferentes estudos.[119][120][8] Em contraste com a psilocina, seus metabólitos 4‑HIAA e 4‑HTP não apresentaram afinidade nem ativação de múltiplos receptores de serotonina e são considerados inativos.[2][12][119] Com base em estudos in vitro, estimou‑se que a MAO‑A é responsável por cerca de 81% do metabolismo hepático de fase I da psilocina.[190] A psilocina e seus metabólitos também são glucuronidados por UDP-glucuroniltransferases (UGTs).[178][2][6][119] Parece que o UGT1A10 e o UGT1A9 são os mais envolvidos.[178][2][8] Os metabólitos glucuronidados da psilocibina incluem a psilocina‑O‑glucuronídeo e o 4‑HIAA‑O‑glucuronídeo.[2][6][119] Aproximadamente 80% da psilocina no Plasma sanguíneo encontra‑se em forma conjugada, e os níveis de psilocina conjugada são cerca de quatro vezes superiores aos níveis de psilocina livre.[119][8] Os níveis plasmáticos de 4‑HIAA também são muito superiores aos da psilocina livre.[2]
A norpsilocina (4‑HO‑NMT), formada a partir da psilocina por meio da desmetilação mediada pela enzima do citocromo P450, CYP2D6, é conhecida por ocorrer em camundongos in vivo e com CYP2D6 recombinante humano in vitro, mas não foi detectada em humanos in vivo.[119] Um metabólito oxidado da psilocina de estrutura química desconhecida também é formado pela atividade da hidroxiindol oxidase do CYP2D6.[119][8] A psilocina oxidada é possivelmente uma estrutura do tipo quinona, como a psilocina iminoquinona (4‑hidroxi‑5‑oxo‑N,N‑DMT) ou a psilocina hidroquinona (4,5‑dihidroxi‑N,N‑DMT).[119][8] Metabólitos adicionais formados pelo CYP2D6 também podem estar presentes.[119] Além do CYP2D6, o CYP3A4 apresentou atividade menor na metabolização da psilocina, embora o metabólito produzido seja desconhecido.[119] Outras enzimas do citocromo P450, além do CYP2D6 e do CYP3A4, parecem improváveis de estar envolvidas no metabolismo da psilocina.[119] Os fenótipos de metabolizador do CYP2D6 não modificam a exposição à psilocina em humanos, sugerindo que o CYP2D6 não está criticamente envolvido no metabolismo da psilocina e é improvável que resulte em diferenças interindividuais na cinética ou nos efeitos da psilocina.[12][119] A psilocibina e a psilocina podem inibir, em certa medida, o CYP3A4 e o CYP2A6, respectivamente.[179]
Eliminação
[editar | editar código-fonte]A psilocibina é eliminada 80% a 85% na Urina e 15 a 20% na Bile.[12] Ela é excretada principalmente na urina como psilocina‑O‑glucuronídeo.[12][186] O fármaco foi eliminado aproximadamente 20% e 80% como psilocina O‑glucuronídeo em diferentes estudos.[178][186][8][120] A quantidade excretada como psilocina inalterada na urina é de 1,5 a 3,4%.[178][186][2][120] Os estudos divergem quanto aos metabólitos desaminados da psilocina, com um estudo indicando que apenas 4% da psilocibina é metabolizada em 4‑HIAA, 4‑HIAL e 4‑HTOL e outro que a psilocibina é excretada em 33% na urina como 4‑HIAA.[8] e outro que a psilocibina é excretada em 33% na urina como 4‑HIAA.[119][120] Os resultados também divergem quanto à detecção de psilocibina na urina, havendo relatos de que não há psilocibina excretada ou de que 3% a 10% são excretados como psilocibina inalterada.[187][7][178][6][8] A maior parte da psilocibina e de seus metabólitos é excretada dentro de três horas após administração oral, e a eliminação é quase completa em 24 horas.[8][6][120]
A meia‑vida de eliminação da psilocibina, na forma de psilocina, é de 2,1 a 4,7 horas em média (variação de 1,2–18,6 horas) por via Administração oral e de 1,2 horas (variação de 1,8–4,5 horas) por via Injeção intravenosa.[178][179][2][8] A meia‑vida de eliminação da psilocina em camundongos é de 0,9 horas, muito mais rápida do que em humanos.[119] A meia‑vida da psilocina‑O‑glucuronídeo é de cerca de 4 horas em humanos e aproximadamente 1 hora em camundongos.[119]
Não se prevê a necessidade de ajuste de dose da psilocina, uma vez que ela é inativada principalmente por meio do metabolismo, e não pela eliminação renal.[178][12][120] Consequentemente, a Taxa de filtração glomerular (TFG) não afetou a farmacocinética da psilocibina.[178][12][120]
Diversos
[editar | editar código-fonte]O Início da ação da psilocibina administrada por via oral é de aproximadamente 20 a 50 minutos, e os efeitos subjetivos de pico ocorrem em cerca de 1,0 a 2,2 horas (60–130 minutos).[3][15] O tempo para o término dos efeitos da psilocibina administrada por via oral é de cerca de 6 a 7 horas, em média.[120] A Duração de ação da psilocibina é de cerca de 4 a 6 horas (variação de 3–12 horas) por via oral.[3][15][14] Uma pequena dose de 1 mg por Injeção intravenosa teve uma duração de 15 a 30 minutos.[7][4] Os efeitos psicoativos e a duração da psilocibina estão fortemente correlacionados com os níveis de psilocina.[15][120][2]
Doses únicas de psilocibina de 3 a 30 mg demonstraram ocupar, de forma dependente da dose, o receptor de serotonina 5‑HT2A em humanos, conforme avaliado por estudos de imagem.[2] A concentração EC50|concentração eficaz meia‑máxima para a ocupação do receptor de serotonina 5‑HT2A pela psilocina, em termos de níveis circulantes, foi determinada em 1,97 ng/mL.[2]
O Peso corporal e o Índice de massa corporal não parecem afetar a farmacocinética da psilocibina.[15][12][120] Isso sugere que a dosagem ajustada ao peso corporal para a psilocibina é desnecessária e pode, na verdade, ser contraproducente, de modo que a dosagem fixa deve ser preferida.[12][120] De forma semelhante, a Idade não afeta a farmacocinética da psilocibina.[178] O Sexo não foi testado.[178]
Química
[editar | editar código-fonte]Propriedades físicas
[editar | editar código-fonte]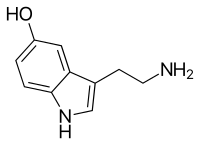
A psilocibina é uma triptamina substituída que ocorre naturalmente, caracterizada por um anel indol ligado a um substituinte aminoetílico. Está estruturalmente relacionada à Serotonina, um neurotransmissor monoaminérgico que é derivado do aminoácido Triptofano. A psilocibina integra a classe geral de compostos à base de triptofano que, originalmente, atuavam como Antioxidantes em formas de vida primitivas, antes de assumirem funções mais complexas em organismos multicelulares, inclusive em humanos.[191] Outros compostos psicodélicos relacionados que contêm indol incluem a Dimetiltriptamina, encontrada em muitas espécies de plantas e em traços em alguns mamíferos, e a Bufotenina, encontrada na pele de certos anfíbios, especialmente no Sapo do Rio Colorado.[192]:10–13
A psilocibina é um sólido cristalino branco, solúvel em água, Metanol e Etanol, mas insolúvel em Solventes orgânicos não polares, como o Clorofórmio e o Éter de petróleo.[192]:15 Apresenta um Ponto de fusão entre Predefinição:Convert/Dual/LoffAoffDbSoffT,[98] e um sabor semelhante ao da Amônia.[193] Seus valores de pKa são estimados em 1,3 e 6,5 para os dois grupos hidroxila de Fosfato sucessivos e 10,4 para o nitrogênio da dimetilamina, de modo que, tipicamente, apresenta uma estrutura Zwitterionica.[193] Existem dois polimorfos cristalinos conhecidos da psilocibina, além de fases hidratadas.[194] A psilocibina oxida‑se rapidamente quando exposta à luz — uma consideração importante ao utilizá‑la como padrão analítico.[195]
Análogos estruturais
[editar | editar código-fonte]Os análogos estruturais da psilocibina (4‑PO‑DMT; O‑fosforilpsilocina) e da psilocina (4‑HO‑DMT) incluem a Dimetiltriptamina (DMT), o 5‑hidroxitriptamina (5‑HT), a Bufotenina (5‑HO‑DMT), o 4‑AcO‑DMT (psilacetina; O‑acetilpsilocina), o 4‑PrO‑DMT (O‑propionilpsilocina), o Psilomethoxin (4‑HO‑5‑MeO‑DMT; 5‑metoxipsilocina), o Ethocybin (4‑PO‑DET), a Baeocystin (4‑PO‑NMT), a Aeruginascin (4‑PO‑TMT) e a Norbaeocystin (4‑PO‑T), entre outros.
Síntese em laboratório
[editar | editar código-fonte]Albert Hofmann et al. foram os primeiros a sintetizar a psilocibina, em 1958. Desde então, diversos químicos aprimoraram os métodos de síntese e purificação da psilocibina em laboratório. Em particular, Shirota et al. relataram, em 2003, um método inovador para a síntese de psilocibina em escala de gramas a partir de 4‑hidroxiindol, que não requer purificação cromatográfica. Fricke et al. descreveram uma via enzimática para a síntese de psilocibina e psilocina, publicando seus resultados em 2017. Sherwood et al. melhoraram significativamente o método de Shirota (produzindo em escala de quilogramas enquanto empregavam reagentes menos onerosos), publicando seus resultados em 2020.[196]
Métodos analíticos
[editar | editar código-fonte]Vários testes químicos relativamente simples — disponíveis comercialmente como kits de teste de reagentes — podem ser utilizados para avaliar a presença de psilocibina em extratos preparados a partir de cogumelos.[197] O fármaco produz uma coloração amarela no teste de Marquis e uma coloração verde no reagente Mandelin.[198] O reagente de Ehrlich e o reagente DMACA são utilizados como pulverizadores químicos para detectar o fármaco após Cromatografia em camada fina.[199] Diversas técnicas modernas de Química analítica têm sido empregadas para quantificar os níveis de psilocibina em amostras de cogumelos. Embora os métodos mais antigos usassem comumente a Cromatografia gasosa, a alta temperatura necessária para vaporizar a amostra de psilocibina antes da análise faz com que ela perca espontaneamente seu grupo fosforil e se converta em psilocina, dificultando a diferenciação química entre os dois fármacos. Em Toxicologia forense, as técnicas envolvendo Cromatografia gasosa acoplada à espectrometria de massas (GC–MS) são as mais amplamente utilizadas devido à sua alta sensibilidade e capacidade de separar compostos em misturas biológicas complexas.[200] Essas técnicas incluem a Espectrometria de mobilidade iônica,[201] a Eletroforese em zona capilar,[202] a Espectroscopia ultravioleta,[203] e a Espectroscopia no infravermelho.[204] A Cromatografia líquida de alta eficiência (HPLC) é utilizada com métodos de detecção por ultravioletas,[195] fluorescência,[205] eletroquímicos,[206] e com detecção por Ionização por electrospray em espectrometria de massas.[207]
Diversos métodos cromatográficos foram desenvolvidos para detectar psilocina em Fluidos corporais: o sistema rápido de identificação de drogas em emergência (REMEDi HS), um método de Triagem de drogas baseado em HPLC;[208] HPLC com detecção eletroquímica;[206][209] GC–MS;[210][208] e cromatografia líquida acoplada à espectrometria de massas.[211] Embora a determinação dos níveis de psilocina na urina possa ser realizada sem a limpeza da amostra (isto é, sem remoção de contaminantes que dificultem a avaliação precisa da concentração), a análise no Plasma sanguíneo ou no Soro sanguíneo requer extração preliminar seguida de derivatização dos extratos no caso de GC–MS. Um Imunoensaio específico também foi desenvolvido para detectar psilocina em amostras de sangue total.[212] Uma publicação de 2009 relatou o uso de HPLC para separar rapidamente drogas ilícitas de importância forense, incluindo psilocibina e psilocina, que foram identificáveis em aproximadamente 30 segundos de tempo de análise.[213] Contudo, essas técnicas analíticas para determinar as concentrações de psilocibina em fluidos corporais não estão rotineiramente disponíveis e não são tipicamente empregadas em ambientes Química clínica.[38]
Ocorrência natural
[editar | editar código-fonte]| Espécies | % de psilocibina |
|---|---|
| P. azurescens | 1,78 |
| P. serbica | 1,34 |
| P. semilanceata | 0,98 |
| P. baeocystis | 0,85 |
| P. cyanescens | 0,85 |
| P. tampanensis | 0,68 |
| P. cubensis | 0,63 |
| P. weilii | 0,61 |
| P. hoogshagenii | 0,60 |
| P. stuntzii | 0,36 |
| P. cyanofibrillosa | 0,21 |
| P. liniformans | 0,16 |
Psilocibina está presente em concentrações variadas em mais de 200 espécies de cogumelos Basidiomicetos. Em uma revisão de 2000 sobre a distribuição mundial de cogumelos alucinógenos, Gastón Guzmán e colaboradores consideraram que estes se distribuíam entre os seguintes Gêneros: Psilocybe (116 espécies), Gymnopilus (14), Panaeolus (13), Copelandia (12), Hypholoma (6), Pluteus (6), Inocybe (6), Conocybe (4), Panaeolina (4), Gerronema (2) e Galerina (1 espécie).[215] Guzmán elevou sua estimativa do número de espécies de Psilocybe contendo psilocibina para 144 em uma revisão de 2005. A maioria delas é encontrada no México (53 espécies), com o restante distribuído nos Estados Unidos e Canadá (22), Europa (16), Ásia (15), África (4) e Austrália e ilhas associadas (19).[216] A diversidade dos cogumelos contendo psilocibina teria sido aumentada pela transferência horizontal do cluster metabólico de psilocibina entre espécies de cogumelos não relacionadas.[217][218] Em geral, as espécies contendo psilocibina são cogumelos de esporos escuros, de lâminas, que crescem em prados e bosques dos subtrópicos e trópicos, geralmente em solos ricos em húmus e detritos vegetais.[192]:5 Os cogumelos contendo psilocibina ocorrem em todos os continentes, mas a maioria das espécies é encontrada em florestas úmidas subtropicais.[215] Espécies de Psilocybe comumente encontradas nos trópicos incluem P. cubensis e P. subcubensis. P. semilanceata — considerada por Guzmán como o cogumelo contendo psilocibina mais amplamente distribuído no mundo[219] — é encontrada na Europa, América do Norte, Ásia, América do Sul, Austrália e Nova Zelândia, mas está completamente ausente do México.[216] Embora a presença ou ausência de psilocibina não seja de grande utilidade como marcador Quimiotaxonomia em nível familial ou superior, ela é empregada na classificação de taxa de grupos taxonômicos inferiores.[220]

Tanto o chapéu quanto o caule contêm compostos psicoativos, embora os chapéus apresentem consistentemente maiores concentrações. Os Esporos desses cogumelos não contêm psilocibina ou psilocina.[201][222][223] A potência total varia significativamente entre espécies e até mesmo entre espécimes de uma mesma espécie coletados ou cultivados a partir da mesma cepa.[224] Como a maior parte da biossíntese da psilocibina ocorre precocemente na formação dos corpos de frutificação ou escleródios, cogumelos mais jovens e menores tendem a apresentar uma concentração superior da substância em comparação com cogumelos maiores e maduros.[225] Em geral, o conteúdo de psilocibina dos cogumelos é bastante variável (variando de quase nulo a 2,5% da massa seca)[226][39]:248 e depende da espécie, da cepa, das condições de cultivo e secagem, bem como do tamanho do cogumelo.[214]:36–41, 52 Cogumelos cultivados apresentam menor variabilidade no conteúdo de psilocibina em comparação aos silvestres.[227] A substância é mais estável em cogumelos secos do que em frescos; estes, quando secos, mantêm sua potência por meses ou até anos,[214]:51–5 enquanto cogumelos armazenados frescos por quatro semanas retêm apenas vestígios da psilocibina original.[22]
Em um estudo, os teores de psilocibina em espécimes secos de herbário de Psilocybe semilanceata demonstraram diminuir conforme a idade da amostra aumentava: coleções com 11, 33 ou 118 anos apresentaram 0,84%, 0,67% e 0,014% (todos em massa seca), respectivamente.[228] Micélios maduros contêm certa quantidade de psilocibina, enquanto micélios jovens (recém-germinados a partir de esporos) não apresentam quantidades apreciáveis.[229] Muitas espécies de cogumelos contendo psilocibina também possuem menores quantidades dos compostos análogos baeocystin e norbaeocystin,[214]:38 substâncias consideradas precursores biogênicos.[28]:170 Embora a maioria das espécies de cogumelos contendo psilocibina mancham de azul ao serem manuseadas ou danificadas – devido à oxidação dos compostos fenólicos – essa reação não constitui um método definitivo para a identificação ou para determinar a potência de um cogumelo.[224][214]:56–58
Biossíntese
[editar | editar código-fonte]Experimentos de Rotulagem isotópica dos anos 1960 sugeriram que a Biossíntese da psilocibina ocorria por meio de um processo de quatro etapas:[230]
- Descarboxilação do Triptofano para Triptamina
- N,N-Dimetilação da triptamina na posição N9 para Dimetiltriptamina
- 4-Hidroxilação da dimetiltriptamina para Psilocina
- O-Fosforilação da psilocina para psilocibina
Este processo pode ser visualizado no diagrama a seguir:[231]

Pesquisas mais recentes demonstraram que – pelo menos em P. cubensis – a O-fosforilação é, de fato, a terceira etapa, e que nem a dimetiltriptamina nem a psilocina são intermediárias.[231] A sequência das etapas intermediárias foi elucidada com a participação de quatro enzimas (PsiD, PsiH, PsiK e PsiM) em P. cubensis e P. cyanescens, embora seja possível que a via biossintética varie entre as espécies.[192]:12–13 Essas enzimas estão codificadas em Cluster metabólicos em Psilocybe, Panaeolus e Gymnopilus.[218]
Escherichia coli foi geneticamente modificada para produzir grandes quantidades de psilocibina.[232] Psilocibina pode ser produzida de novo em levedura geneticamente modificada.[233][234]
História
[editar | editar código-fonte]Primeiros Registros
[editar | editar código-fonte]
Há evidências que sugerem que cogumelos psicoativos vêm sendo utilizados por seres humanos em cerimônias religiosas há milhares de anos. A Figura do Cogumelo de Tassili foi descoberta em Tassili (na Argélia) e acredita-se que represente cogumelos alucinógenos, bem como a transformação do usuário sob sua influência. As pinturas seriam datadas de 9000–7000 a.C.[235]
Pictografias com cerca de 6.000 anos, descobertas nas proximidades da cidade espanhola de Villar del Humo, ilustram diversos cogumelos que foram tentativamente identificados como Psilocybe hispanica, uma espécie alucinógena nativa da região.[236]
Alguns estudiosos também interpretaram artefatos arqueológicos do México e as chamadas "pedras de cogumelo" maia de Guatemala como evidência do uso ritual e cerimonial de cogumelos psicoativos nas culturas maia e asteca da Mesoamérica.[214]:11 Em Nahuatl, a língua dos astecas, os cogumelos eram denominados teonanácatl — literalmente "cogumelo divino": a forma aglutinada de teō(tl) ("deus", "sagrado") e nanācatl ("cogumelo").[237] Após a chegada dos exploradores espanhóis ao Novo Mundo no século XVI, cronistas relataram o uso dos cogumelos pelos nativos para fins cerimoniais e religiosos. De acordo com o frade Diego Durán da Ordem Dominicana em História das Índias da Nova Espanha (publicado c. 1581), os cogumelos eram consumidos em festividades realizadas na ocasião da ascensão ao trono do imperador asteca Moctezuma II em 1502. O frade Franciscanos Bernardino de Sahagún descreveu ter testemunhado o uso de cogumelos no Códice Florentino (publicado entre 1545 e 1590),[238]:164 e relatou como alguns comerciantes celebravam o retorno de bem-sucedidas viagens de negócios consumindo cogumelos para provocar visões reveladoras.[239]:118 Após a conquista espanhola do Império Asteca, os espanhóis proibiram práticas e rituais religiosos tradicionais, que consideravam "idolatria pagã", incluindo o uso cerimonial de cogumelos. Durante os quatro séculos seguintes, os indígenas da Mesoamérica ocultaram seu uso de Entheógenos das autoridades espanholas.[238]:165
Dezenas de espécies de cogumelos psicodélicos são encontradas na Europa, mas há poucos registros documentados de seu uso na história do Velho Mundo, com exceção do uso de Amanita muscaria entre povos siberianos.[240][241] As poucas contas existentes que mencionam cogumelos psilocibinos geralmente carecem de informações suficientes para permitir a identificação das espécies, concentrando-se em seus efeitos. Por exemplo, o botânico flamengo Carolus Clusius (1526–1609) descreveu o bolond gomba ("cogumelo louco"), utilizado na zona rural da Hungria para a preparação de poções amorosas. O botânico inglês John Parkinson (botanist) relatou detalhes sobre um "cogumelo tolo" em seu herbário Theatricum Botanicum (1640).[242]:10–12 O primeiro relato documentado de intoxicação com Psilocybe semilanceata — o cogumelo psicodélico mais comum e difundido na Europa — envolveu uma família britânica em 1799, que preparou uma refeição com cogumelos colhidos no Green Park de Londres.[242]:16
Moderno
[editar | editar código-fonte]

O banqueiro americano e etnomicólogo R. Gordon Wasson e sua esposa, Valentina P. Wasson, médica, estudaram o uso ritual de cogumelos psicoativos pela população nativa na aldeia Mazatecos de Huautla de Jiménez, México. Em 1957, Wasson descreveu as visões psicodélicas que experimentou durante esses rituais no artigo "Seeking the Magic Mushroom", publicado na revista semanal americana Life.[243] No mesmo ano, eles participaram de uma expedição conduzida pelo micologista francês Roger Heim, que identificou várias espécies de cogumelos pertencentes ao gênero Psilocybe.[244]
Heim cultivou os cogumelos na França e enviou amostras para análise a Albert Hofmann, químico empregado pela farmacêutica suíça Sandoz (atualmente Novartis). Hofmann – que sintetizou a Ácido lisérgico dietilamida (LSD) em 1938 – liderou um grupo de pesquisa que isolou e identificou os alcaloides psicoativos psilocibina e psilocina de Psilocybe mexicana, publicando os resultados em 1958.[239]:128 O grupo contou com a colaboração de Hofmann, que chegou a ingerir extratos dos cogumelos para confirmar a presença dos compostos ativos.[239]:126–127
Posteriormente, a equipe de Hofmann sintetizou diversos Análogo estruturals desses compostos para investigar como as alterações estruturais influenciavam a psicoatividade. Essa pesquisa culminou no desenvolvimento de ethocybin e CZ-74. Como os efeitos fisiológicos desses compostos duram apenas cerca de três horas e meia (aproximadamente metade da duração da psilocibina), eles se mostraram mais manejáveis para uso na terapia psicolítica.[39]:237 A Sandoz também comercializou e vendeu psilocibina pura sob o nome Indocybin para clínicos e pesquisadores em todo o mundo.[238]:166 Não houve relatos de complicações graves com o uso da psilocibina dessa maneira.[7]
No início dos anos 1960, a Harvard University tornou-se um campo de testes para a psilocibina por meio dos esforços de Timothy Leary e seus colaboradores Ralph Metzner e Richard Alpert (que posteriormente adotou o nome Ram Dass). Leary obteve psilocibina sintetizada por Hofmann, através da Sandoz Pharmaceuticals. Estudos como o Concord Prison Experiment sugeriram resultados promissores quanto ao uso da psilocibina na Psiquiatria clínica.[23][245] Contudo, conforme apontado em uma revisão de 2008 sobre diretrizes de segurança em pesquisas com alucinógenos, a ampla divulgação da saída de Leary e Alpert de Harvard e sua posterior defesa do uso de alucinógenos "minaram ainda mais uma abordagem científica objetiva para o estudo desses compostos".[246] Em resposta às preocupações com o aumento do uso não autorizado de drogas psicodélicas pelo público em geral, a psilocibina e outros alucinógenos passaram a ser retratados de forma desfavorável na mídia e enfrentaram leis cada vez mais restritivas. Nos Estados Unidos, leis aprovadas em 1966 proibiram a produção, o comércio e o consumo de drogas alucinógenas; nesse mesmo ano, a Sandoz interrompeu a produção de LSD e psilocibina.[247] Em 1970, o Congresso aprovou a "Lei Federal Abrangente de Prevenção e Controle do Abuso de Drogas", que tornou ilegais o uso de LSD, peiote, psilocibina e outros alucinógenos para qualquer finalidade, inclusive para pesquisas científicas.[248] A agenda de políticos norte-americanos contra o uso de LSD acabou englobando a psilocibina, que passou a integrar a Classe I de substâncias controladas de drogas ilícitas. Essas restrições dificultaram a obtenção de recursos para pesquisas com essas substâncias, e os cientistas que trabalhavam com psicodélicos corriam o risco de serem "marginalizados" profissionalmente.[249] Embora Hofmann tenha realizado testes em si mesmo com esses compostos, ele jamais defendeu sua legalização ou uso médico. Em seu livro de 1979, LSD—mein Sorgenkind (LSD—Meu Filho Problemático), descreveu o uso problemático desses alucinógenos como se fossem simples embriagantes.[239]:79–116
Apesar das restrições legais ao uso da psilocibina, a década de 1970 marcou o surgimento da psilocibina como o "entheógeno de eleição".[250]:276 Isso deveu-se, em grande parte, à ampla divulgação de informações sobre o tema, que incluía obras de Carlos Castaneda e diversos livros que ensinavam técnicas de cultivo de cogumelos psilocibinos. Um dos títulos mais populares desse grupo, Guia do Cultivador de Cogumelos Mágicos, foi publicado em 1976 sob os pseudônimos O. T. Oss e O. N. Oeric por Jeremy Bigwood, Dennis J. McKenna, K. Harrison McKenna e Terence McKenna, tendo sido vendidas mais de 100.000 cópias até 1981.[251] Conforme explica o etnobiólogo Jonathan Ott, "Esses autores adaptaram a técnica de San Antonio (para produzir cogumelos comestíveis cultivando culturas miceliais sobre um substrato de grão de centeio; San Antonio 1971) para a produção de Psilocybe [Stropharia] cubensis. A nova técnica envolvia o uso de utensílios comuns de cozinha, permitindo pela primeira vez que o leigo produzisse, em sua própria residência e sem acesso a tecnologia sofisticada, equipamentos ou suprimentos químicos, um potente entheógeno."[250]:290 A técnica de San Antonio descreve um método para o cultivo do cogumelo comestível comum Agaricus bisporus.[252]
Devido à incerteza acerca das leis relativas aos cogumelos psilocibinos, especialmente na forma de escleródios (também conhecidos como "trufas"), no final dos anos 1990 e início dos anos 2000, varejistas europeus passaram a comercializá-los e promovê-los em smartshops na Holanda, no Reino Unido e na internet. Vários sites[e] surgiram, contribuindo para a disseminação de informações sobre a descrição, o uso e os efeitos dos cogumelos, enquanto os usuários trocavam experiências. Desde 2001, seis países da União Europeia endureceram a legislação relativa aos cogumelos psilocibinos, em resposta às preocupações acerca de sua prevalência e do aumento no consumo.[21] Nos anos 1990, os alucinógenos e seus efeitos sobre a consciência humana voltaram a ser objeto de estudo científico, sobretudo na Europa. Avanços em Neurofarmacologia e Neuropsicologia e a disponibilidade de técnicas de imagem cerebral impulsionaram o uso de drogas como a psilocibina para investigar as "bases neurais da formação de sintomas psicóticos, incluindo distúrbios do ego e alucinações".[29] Estudos recentes nos Estados Unidos atraíram a atenção da mídia popular, trazendo a psilocibina de volta ao centro das discussões.
Sociedade e cultura
[editar | editar código-fonte]Situação legal
[editar | editar código-fonte]Defesa da Tolerância
[editar | editar código-fonte]Apesar de ser ilegal a posse não autorizada em muitos países ocidentais – como o Reino Unido, a Austrália e alguns estados dos Estados Unidos – governos menos conservadores incentivam a posse legal e o fornecimento de psilocibina e outras drogas psicodélicas. Em Amsterdã, as autoridades promovem a educação e o uso seguro de drogas psicodélicas, como a psilocibina, com o intuito de reduzir danos à população.[253] De maneira similar, grupos religiosos como a União do Vegetal (UDV) utilizam psicodélicos em cerimônias tradicionais.[254][255] Um relatório do U.S. Government Accountability Office (GAO) aponta que cidadãos podem solicitar isenções à DEA para o uso de psilocibina com finalidade religiosa.[256]
A partir de 1º de julho de 2023, o órgão regulador de medicamentos da Austrália passou a permitir que psiquiatras prescrevam psilocibina para o tratamento terapêutico de depressão resistente ao tratamento.[257]
Defensores da legalização argumentam que não há evidências de danos,[258][259] além de seu potencial no tratamento de determinadas condições de saúde mental. A condução de pesquisas nessa área é dificultada pela situação legal das substâncias psicoativas.[260] Defensores da legalização também destacam a utilidade da "ego dissolution"[254] e afirmam que as proibições constituem uma forma de discriminação cultural contra os usuários tradicionais.
Em 2024, após apelos por mudanças regulatórias e legais que ampliem o acesso de populações terminais a substâncias controladas, dois casos judiciais relacionados ao acesso ampliado começaram a tramitar nos tribunais federais sob a Lei do direito de tentar. O Instituto Advanced Integrative Medicine Science (AIMS), em conjunto com a NPA, ajuizou uma série de ações visando tanto a reclassificação quanto a ampliação do direito de tentar o acesso à psilocibina.[261]
Uso
[editar | editar código-fonte]
Uma pesquisa nacional de 2009 sobre o consumo de drogas, realizada pelo Departamento de Saúde e Serviços Humanos dos EUA, concluiu que o número de usuários de cogumelos psilocibinos pela primeira vez nos Estados Unidos era aproximadamente equivalente ao número de iniciantes no uso de cannabis.[262] Um relatório de junho de 2024 da RAND Corporation sugere que o total de dias de uso de psicodélicos é duas ordens de magnitude inferior ao observado para a cannabis e que, diferentemente do que ocorre com os usuários de cannabis e de muitas outras drogas, os consumidores esporádicos de psicodélicos respondem pela maior parte dos dias totais de uso.[263] O relatório de 2024 da RAND Corporation indica que os cogumelos psilocibinos podem ser a droga psicodélica mais prevalente entre adultos nos Estados Unidos.[263]
Em países europeus, as estimativas de prevalência vitalícia do uso de cogumelos psicodélicos entre jovens adultos (15–34 anos) variam de 0,3% a 14,1%.[264]
No México moderno, o uso cerimonial tradicional persiste entre diversos grupos indígenas, incluindo os Nahuas, os Matlatzinca, os Totonacs, os Mazatecos, os Mixes, os Zapotecas e os Chatinos. Embora espécies alucinógenas do gênero Psilocybe sejam abundantes em áreas de baixa altitude, a maior parte do uso cerimonial ocorre em regiões montanhosas com elevações superiores a 1 500 metros (4 900 pé). Guzmán sugere que isso é um vestígio da influência colonial espanhola de séculos atrás, quando o uso de cogumelos era perseguido pela Igreja Católica.[265]
Pesquisas
[editar | editar código-fonte]Transtornos psiquiátricos e outros
[editar | editar código-fonte]Ver também
A psilocibina tem sido objeto de pesquisas clínicas desde o início dos anos 1960, quando o Harvard Psilocybin Project avaliou o potencial terapêutico da psilocibina como tratamento para determinados Transtorno de personalidade.[266] A partir dos anos 2000, a psilocibina vem sendo investigada por seu possível papel no tratamento da Dependência de nicotina, Dependência de álcool, Transtorno obsessivo-compulsivo (TOC), Cefaleia em salvas, angústia existencial relacionada ao câncer,[196][267] Transtorno de ansiedade e certos Transtorno do humor.[238]:179–81[268][269] Também está sendo estudada em indivíduos com Doença de Parkinson.[270][271] Em 2018, a Food and Drug Administration dos Estados Unidos concedeu à terapia assistida por psilocibina designação de Terapia inovadora para o tratamento da Depressão resistente ao tratamento.[272][273] Uma revisão sistemática publicada em 2021 constatou que o uso da psilocibina como substância farmacêutica estava associado à redução da intensidade dos sintomas depressivos.[274] O papel da psilocibina como possível psychoplastogen também está sendo investigado.[157][158][159] A substância está em desenvolvimento pela Compass Pathways, Cybin e por outras empresas.[275][276]
Depressão
[editar | editar código-fonte]Ensaios clínicos – tanto estudos abertos quanto ensaios clínicos randomizados duplo-cegos – demonstraram que doses únicas de psilocibina produzem efeitos antidepressivos rápidos e duradouros, superando o placebo em indivíduos com Transtorno depressivo maior e Depressão resistente ao tratamento.[277] Quando combinada com suporte psicológico breve em um ensaio clínico de fase 2, observou-se que a psilocibina promove melhorias dose-dependentes nos sintomas depressivos, sendo 25 mg (dose moderada) mais eficaz do que 10 mg (dose baixa) e 10 mg mais eficaz que 1 mg (não psicoativo e equivalente ao placebo).[277][278] Os efeitos antidepressivos da psilocibina, quando administrados com suporte psicológico, foram observados por pelo menos 6 semanas após uma única dose.[277][278][279]
Entretanto, alguns ensaios não demonstraram que a psilocibina superasse significativamente o placebo no tratamento da depressão.[277] Além disso, um ensaio de fase 2 comparando duas doses de 25 mg de psilocibina com 3 semanas de intervalo com o tratamento diário por 6 semanas com o inibidor seletivo da recaptação de serotonina (ISRS) escitalopram (Lexapro) – acrescido de duas doses supostamente não psicoativas de 1 mg de psilocibina com 3 semanas de intervalo – não revelou diferença estatisticamente significativa na redução dos sintomas depressivos entre os grupos.[277][280] Contudo, as reduções nos sintomas depressivos foram numericamente maiores com a psilocibina, algumas medidas secundárias a favoreceram e a taxa de remissão foi estatisticamente superior com a psilocibina (57% com psilocibina versus 28% com escitalopram).[277][280] De qualquer forma, o tamanho do efeito antidepressivo da psilocibina em comparação com o escitalopram parece ser pequeno.[281]
O desmascaramento funcional decorrente dos efeitos psicoativos e dos efeitos de expectativa psicológica positiva (ou seja, o efeito placebo) constitui uma limitação significativa e uma importante fonte de viés em ensaios clínicos com psilocibina e outros psicodélicos no tratamento da depressão.[282][283][284][285] Ademais, boa parte do benefício terapêutico dos antidepressivos convencionais, como os ISRS, para o tratamento da depressão parece ser atribuída à resposta placebo.[286][287] Propôs-se que psicodélicos, como a psilocibina, podem atuar de fato como Placebo ativo – ou seja, "super-placebos" ativos – quando empregados para fins terapêuticos.[288][289] A partir de setembro de 2024, a psilocibina e outros psicodélicos (com exceção do MDMA) foram avaliados apenas até ensaios clínicos de fase 2 para transtornos psiquiátricos e ainda não completaram ensaios clínicos de fase 3 mais amplos e rigorosos, tampouco receberam aprovação regulatória para uso médico.[20][277][67]
Ver também
[editar | editar código-fonte]
- Cogumelo psicadélico
- Psilocybe cubensis
- Psicodislépticos
- Psicoterapia psicodélica
- Medicina indígena
- Astecas
- Peiote
- Jurema (árvore)
- Dimetiltriptamina
- Enteógeno
- Psilocybe hispanica
Notas
- ↑ Sinônimos e grafias alternativas de psilocibina incluem 4‑PO‑DMT (PO: Fosfato; DMT: Dimetiltriptamina), psilocibina, psilocibina, psilocybinum, psilotsibin e éster fosfato de psilocina, entre outros.[9]
- ↑ As porcentagens são derivadas de um estudo clínico não-cego com 30 indivíduos aos quais foi administrada uma dosagem de 8–12 miligramas de psilocibina; de Passie (2002),[7] citando Quentin (1960).[30]
- ↑ A aprovação das comunidades acadêmicas à metodologia empregada é exemplificada pelo quarteto de comentários publicados na revista Psychopharmacology intitulado "Commentary on: Psilocybin can occasion mystical-type experiences having substantial and sustained personal meaning and spiritual experience by Griffiths et al.", por HD Kleber (pp. 291–292), DE Nichols (pp. 284–286), CR Schuster (pp. 289–290) e SH Snyder (pp. 287–288).
- ↑ Uma das fatalidades relatadas, a de um francês de 22 anos que morreu em 1993,[101] foi posteriormente contestada na literatura por Jochen Gartz e colegas, que concluíram "os poucos dados relatados sobre a vítima são insuficientes para excluir outras possíveis causas da fatalidade".[102]
- ↑ O EMCDDA lista os sites de uso geral Erowid, Lycaeum, Mycotopia, The Shroomery, MushroomJohn e The Entheogen Review. Sites regionais dedicados aos cogumelos alucinógenos incluíam Copenhagen Mushroom Link (Dinamarca), Champis (França), Daath (Hungria), Delysid (Espanha), Enteogeneos (Portugal), Kouzelné houbičky (República Tcheca), Norshroom (Noruega), Planetahongo (Espanha), Svampinfo (Suécia) e Taikasieniforum (Finlândia). Também foi listado Magic-Mushrooms.net. O relatório detalhava diversos sites adicionais que, em 2006, comercializavam Impressão de esporos, mas observava que muitos deles haviam encerrado suas atividades.
Referências
- ↑ a b Merck Index, 11th Edition, 7942
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag Dodd S, Norman TR, Eyre HA, Stahl SM, Phillips A, Carvalho AF, Berk M (agosto 2023). «Psilocybin in neuropsychiatry: a review of its pharmacology, safety, and efficacy» (PDF). CNS Spectr. 28 (4): 416–426. PMID 35811423. doi:10.1017/S1092852922000888
- ↑ a b c d e f g h i j k l m n o p q MacCallum CA, Lo LA, Pistawka CA, Deol JK (2022). «Therapeutic use of psilocybin: Practical considerations for dosing and administration». Frontiers in Psychiatry. 13. 1040217 páginas. PMC 9751063
 . PMID 36532184. doi:10.3389/fpsyt.2022.1040217
. PMID 36532184. doi:10.3389/fpsyt.2022.1040217
- ↑ a b c d Hasler F, Bourquin D, Brenneisen R, Bär T, Vollenweider FX (junho de 1997). «Determination of psilocin and 4-hydroxyindole-3-acetic acid in plasma by HPLC-ECD and pharmacokinetic profiles of oral and intravenous psilocybin in man». Pharm Acta Helv. 72 (3): 175–184. PMID 9204776. doi:10.1016/s0031-6865(97)00014-9
- ↑ a b Čampara A, Kovačić D (2024). «Exploring Psilocybin as a Tool for Studying Parkinsonism-Related Psychosis: A Narrative Review Supplemented with a Computational Approach». MEDICON'23 and CMBEBIH'23. Col: IFMBE Proceedings. 94. Cham: Springer Nature Switzerland. pp. 530–547. ISBN 978-3-031-49067-5. doi:10.1007/978-3-031-49068-2_54.
With a logS value of −3.009 and a plasma protein binding of 0.66, respectively, psilocybin has poor water solubility and is moderately bound to plasma proteins.
- ↑ a b c d e f g h i j Lowe H, Toyang N, Steele B, Valentine H, Grant J, Ali A, Ngwa W, Gordon L (maio 2021). «The Therapeutic Potential of Psilocybin». Molecules. 26 (10): 2948. PMC 8156539
 . PMID 34063505. doi:10.3390/molecules26102948
. PMID 34063505. doi:10.3390/molecules26102948
- ↑ a b c d e f g h i j Passie T, Seifert J, Schneider U, Emrich HM (outubro 2002). «The pharmacology of psilocybin». Addiction Biology. 7 (4): 357–364. PMID 14578010. doi:10.1080/1355621021000005937.
An interesting fact may be the much shorter half-life (mean 74.1 ± 19.6 minutes i.v. compared to 163 ± 64 minutes p.o.) and duration of action (subjective effects lasting only 15–30 minutes) when psilocybin is given intravenously, as performed in a recent double-blind placebo controlled trial.29
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x Tylš F, Páleníček T, Horáček J (março 2014). «Psilocybin - summary of knowledge and new perspectives». Eur Neuropsychopharmacol. 24 (3): 342–356. PMID 24444771. doi:10.1016/j.euroneuro.2013.12.006
- ↑ «Psilocybine – Compound Summary». PubChem. National Library of Medicine. Consultado em 4 de dezembro de 2011. Cópia arquivada em 25 de setembro de 2012
- ↑ a b c d e f g h i j k l m n Geiger HA, Wurst MG, Daniels RN (outubro 2018). «DARK Classics in Chemical Neuroscience: Psilocybin» (PDF). ACS Chem Neurosci. 9 (10): 2438–2447. PMID 29956917. doi:10.1021/acschemneuro.8b00186
- ↑ a b Siegel JS, Subramanian S, Perry D, Kay BP, Gordon EM, Laumann TO, Reneau TR, Metcalf NV, Chacko RV, Gratton C, Horan C, Krimmel SR, Shimony JS, Schweiger JA, Wong DF, Bender DA, Scheidter KM, Whiting FI, Padawer-Curry JA, Shinohara RT, Chen Y, Moser J, Yacoub E, Nelson SM, Vizioli L, Fair DA, Lenze EJ, Carhart-Harris R, Raison CL, Raichle ME, Snyder AZ, Nicol GE, Dosenbach NU (agosto 2024). «Psilocybin desynchronizes the human brain». Nature. 632 (8023): 131–138. Bibcode:2024Natur.632..131S. PMC 11291293
 Verifique
Verifique |pmc=(ajuda). PMID 39020167 Verifique|pmid=(ajuda). doi:10.1038/s41586-024-07624-5
- ↑ a b c d e f g h i j k l m n o p q Fradet M, Kelly CM, Donnelly AJ, Suppes T (janeiro 2025). «Psilocybin and hallucinogenic mushrooms». CNS Spectr. 29 (6): 611–632. PMID 39789676 Verifique
|pmid=(ajuda). doi:10.1017/S1092852924002487.Upon their activation by psilocin, 5-HT2A receptors initiate complex cascades of downstream signaling. The activation of both canonical Gq/11 and β-arrestin-2 seems necessary to produce psychedelic effects,133 and so is the coactivation of Gi/o and Src tyrosine kinase.134 These specific pathways are thought to differentiate 5-HT2A receptor agonists with psychedelic properties from other agonists of the same receptor such as ergoline and lisuride that do not have hallucinogenic effects. [...] Although strong evidence supports that 5-HT2A activity mediates most of psilocin’s psychedelic properties, this substituted tryptamine also binds to many other receptors135–137. In fact, psilocin’s binding affinity is even higher for some other serotonin receptors such as 5-HT2C, 5-HT1A, and 5-HT2BReference Ray137. It is currently difficult to determine the clinical significance of psilocin’s interaction with these receptors. Although they do not seem to contribute to the hallucinogenic properties of psilocin, these other serotonin receptors could potentially play a role in mediating its therapeutic effect.136, 138–140 [...] Psilocin has a very low affinity for the serotonin transporter (SERT), and it does not interact directly with the norepinephrine transporter (NET) or the dopamine transporter (DAT).137 Although it has the potential to bind with D1 and D3 receptors, it has no direct activity on the widespread D2 receptors.137 It does not interact with adrenergic, opioid, muscarinic, histamine, or cannabinoid receptors.137
- ↑ Nichols DE (outubro 2020). «Psilocybin: from ancient magic to modern medicine». J Antibiot (Tokyo). 73 (10): 679–686. PMID 32398764. doi:10.1038/s41429-020-0311-8
- ↑ a b Yerubandi A, Thomas JE, Bhuiya NM, Harrington C, Villa Zapata L, Caballero J (abril 2024). «Acute Adverse Effects of Therapeutic Doses of Psilocybin: A Systematic Review and Meta-Analysis». JAMA Network Open. 7 (4): e245960. PMC 11007582
 Verifique
Verifique |pmc=(ajuda). PMID 38598236 Verifique|pmid=(ajuda). doi:10.1001/jamanetworkopen.2024.5960.When selecting adverse event profile rates, the shortest time period available was selected and analyzed (eg, day 1 instead of day 30) since the half-life of psilocin is 3 ± 1.1 hours when taken orally and the duration of action can range between 3 to 12 hours.12,13
- ↑ a b c d e f g h i j k l m n o Holze F, Singh N, Liechti ME, D'Souza DC (maio 2024). «Serotonergic Psychedelics: A Comparative Review of Efficacy, Safety, Pharmacokinetics, and Binding Profile». Biol Psychiatry Cogn Neurosci Neuroimaging. 9 (5): 472–489. PMID 38301886 Verifique
|pmid=(ajuda). doi:10.1016/j.bpsc.2024.01.007
- ↑ «Plants of Mind and Spirit - Fungi». 19 de julho de 2022. Consultado em 24 de abril de 2024. Arquivado do original em 19 de julho de 2022
- ↑ Madden K, Flood B, Young Shing D, Ade-Conde M, Kashir I, Mark M, MacKillop J, Bhandari M, Adili A (outubro 2024). «Psilocybin for clinical indications: A scoping review». J Psychopharmacol. 38 (10): 839–845. PMC 11481402
 Verifique
Verifique |pmc=(ajuda). PMID 39135496 Verifique|pmid=(ajuda). doi:10.1177/02698811241269751 - ↑ Melani A, Bonaso M, Biso L, Zucchini B, Conversano C, Scarselli M (janeiro 2025). «Uncovering Psychedelics: From Neural Circuits to Therapeutic Applications». Pharmaceuticals (Basel). 18 (1): 130. PMC 11769142
 Verifique
Verifique |pmc=(ajuda). PMID 39861191 Verifique|pmid=(ajuda). doi:10.3390/ph18010130
- ↑ Najib J (outubro 2024). «The role of psilocybin in depressive disorders». Curr Med Res Opin. 40 (10): 1793–1808. PMID 39177339 Verifique
|pmid=(ajuda). doi:10.1080/03007995.2024.2396536 - ↑ a b «Psilocybin - COMPASS Pathways». AdisInsight. 15 de maio de 2024. Consultado em 5 de setembro de 2024
- ↑ a b Hillebrand J, Olszewski D, Sedefov R (2006). Hallucinogenic Mushrooms: An Emerging Trend Case Study (PDF) (Relatório). Lisbon, Portugal: European Monitoring Centre for Drugs and Drug Addiction (EMCDDA). ISBN 92-9168-249-7. Consultado em 8 de setembro de 2011. Cópia arquivada (PDF) em 29 de março de 2012
- ↑ a b c d e f g h i j k van Amsterdam J, Opperhuizen A, van den Brink W (abril 2011). «Harm potential of magic mushroom use: a review» (PDF). Regulatory Toxicology and Pharmacology. 59 (3): 423–429. PMID 21256914. doi:10.1016/j.yrtph.2011.01.006. Arquivado do original em 9 de janeiro de 2015
- ↑ a b Leary T, Litwin GH, Metzner R (dezembro 1963). «Reactions to Psilocybjn Administered in a Supportive Environment». The Journal of Nervous and Mental Disease. 137 (6): 561–573. PMID 14087676. doi:10.1097/00005053-196312000-00007
- ↑ Berge JT (1999). «Breakdown or breakthrough? A history of European research into drugs and creativity». Journal of Creative Behavior. 33 (4): 257–276. ISSN 0022-0175. doi:10.1002/j.2162-6057.1999.tb01406.x
- ↑ «Hallucinogenic Drug Psilocybin Eases Existential Anxiety in People With Life-Threatening Cancer». Johns Hopkins. 1 de dezembro de 2016. Consultado em 9 de abril de 2019. Cópia arquivada em 7 de abril de 2021
- ↑ Griffiths RR, Johnson MW, Richards WA, Richards BD, McCann U, Jesse R (dezembro 2011). «Psilocybin occasioned mystical-type experiences: immediate and persisting dose-related effects». Psychopharmacology. 218 (4): 649–665. PMC 3308357
 . PMID 21674151. doi:10.1007/s00213-011-2358-5
. PMID 21674151. doi:10.1007/s00213-011-2358-5 - ↑ a b c Hasler F, Grimberg U, Benz MA, Huber T, Vollenweider FX (março 2004). «Acute psychological and physiological effects of psilocybin in healthy humans: a double-blind, placebo-controlled dose-effect study» (PDF). Psychopharmacology. 172 (2): 145–156. PMID 14615876. doi:10.1007/s00213-003-1640-6. Consultado em 10 de abril de 2019. Cópia arquivada (PDF) em 18 de abril de 2020
- ↑ a b Ballesteros S, Ramón MF, Iturralde MJ, Martínez-Arrieta R (2006). «Natural sources of drugs of abuse: magic mushrooms». In: Cole SM. New Research on Street Drugs. New York, New York: Nova Science Publishers. pp. 167–186. ISBN 978-1-59454-961-8. Consultado em 27 de fevereiro de 2016. Cópia arquivada em 4 de abril de 2017
- ↑ a b Studerus E, Kometer M, Hasler F, Vollenweider FX (novembro 2011). «Acute, subacute and long-term subjective effects of psilocybin in healthy humans: a pooled analysis of experimental studies». Journal of Psychopharmacology. 25 (11): 1434–1452. PMID 20855349. doi:10.1177/0269881110382466
- ↑ Quentin AM (1960). La Psilocybine en Psychiatrie Clinique et Experimentale [Psilocybin in Clinical and Experimental Psychiatry] (Tese de PhD) (em francês). Paris, France: Paris University Medical Dissertation
- ↑ See for example:
- Isbell H (1959). «Comparison of the reactions induced by psilocybin and LSD-25 in man». Psychopharmacologia. 1 (1): 29–38. PMID 14405870. doi:10.1007/BF00408109
- Hollister LE, Prusmack JJ, Paulsen A, Rosenquist N (novembro 1960). «Comparison of three psychotropic drugs (psilocybin, JB-329, and IT-290) in volunteer subjects». The Journal of Nervous and Mental Disease. 131 (5): 428–434. PMID 13715375. doi:10.1097/00005053-196011000-00007
- Malitz S, Esecover H, Wilkens B, Hoch PH (fevereiro de 1960). «Some observations on psilocybin, a new hallucinogen, in volunteer subjects». Comprehensive Psychiatry. 1: 8–17. PMID 14420328. doi:10.1016/S0010-440X(60)80045-4[ligação inativa]
- Rinkel M, Atwell CR, Dimascio A, Brown J (fevereiro de 1960). «Experimental psychiatry. V. Psilocybine, a new psychotogenic drug». The New England Journal of Medicine. 262 (6): 295–297. PMID 14437505. doi:10.1056/NEJM196002112620606
- Parashos AJ (1976). «The psilocybin-induced "state of drunkenness" in normal volunteers and schizophrenics». Behavioral Neuropsychiatry. 8 (1–12): 83–86. PMID 1052267
- ↑ Heimann H (1994). «Experience of time and space in model psychoses». In: Pletscher A, Ladewig D. 50 Years of LSD. Current Status and Perspectives of Hallucinogens. New York, New York: The Parthenon Publishing Group. pp. 59–66. ISBN 978-1-85070-569-7
- ↑ a b Wittmann M, Carter O, Hasler F, Cahn BR, Grimberg U, Spring P, Hell D, Flohr H, Vollenweider FX (janeiro 2007). «Effects of psilocybin on time perception and temporal control of behaviour in humans». Journal of Psychopharmacology. 21 (1): 50–64. PMID 16714323. doi:10.1177/0269881106065859
- ↑ Wackermann J, Wittmann M, Hasler F, Vollenweider FX (abril 2008). «Effects of varied doses of psilocybin on time interval reproduction in human subjects». Neuroscience Letters. 435 (1): 51–55. PMID 18325673. doi:10.1016/j.neulet.2008.02.006
- ↑ Carter OL, Burr DC, Pettigrew JD, Wallis GM, Hasler F, Vollenweider FX (outubro 2005). «Using psilocybin to investigate the relationship between attention, working memory, and the serotonin 1A and 2A receptors» (PDF). Journal of Cognitive Neuroscience. 17 (10): 1497–1508. PMID 16269092. doi:10.1162/089892905774597191. Consultado em 16 de agosto de 2019. Cópia arquivada (PDF) em 16 de agosto de 2019
- ↑ Harrington DL, Haaland KY (1999). «Neural underpinnings of temporal processing: a review of focal lesion, pharmacological, and functional imaging research». Reviews in the Neurosciences. 10 (2): 91–116. PMID 10658954. doi:10.1515/REVNEURO.1999.10.2.91
- ↑ Coull JT, Cheng RK, Meck WH (janeiro 2011). «Neuroanatomical and neurochemical substrates of timing». Neuropsychopharmacology. 36 (1): 3–25. PMC 3055517
 . PMID 20668434. doi:10.1038/npp.2010.113
. PMID 20668434. doi:10.1038/npp.2010.113 - ↑ a b Attema-de Jonge ME, Portier CB, Franssen EJ (dezembro 2007). «[Automutilation after consumption of hallucinogenic mushrooms]» [Automutilation after consumption of hallucinogenic mushrooms]. Nederlands Tijdschrift voor Geneeskunde (em neerlandês). 151 (52): 2869–2872. PMID 18257429
- ↑ a b c Stafford PJ (1992). Psychedelics Encyclopedia 3rd ed. Berkeley, California: Ronin Publishing. ISBN 978-0-914171-51-5
- ↑ a b c Soares C, Gonzalo G, Castelhano J, Castelo-Branco M (setembro 2023). «The relationship between the default mode network and the theory of mind network as revealed by psychedelics - A meta-analysis». Neuroscience and Biobehavioral Reviews. 152. 105325 páginas. PMID 37467907 Verifique
|pmid=(ajuda). doi:10.1016/j.neubiorev.2023.105325
- ↑ Theriault J, Waytz A, Heiphetz L, Young L (junho de 2020). «Theory of mind network activity is associated with metaethical judgment: An item analysis». Neuropsychologia. 143. 107475 páginas. PMID 32360298. doi:10.1016/j.neuropsychologia.2020.107475
- ↑ Chou T, Deckersbach T, Dougherty DD, Hooley JM (junho de 2023). «The default mode network and rumination in individuals at risk for depression». Social Cognitive and Affective Neuroscience. 18 (1): nsad032. PMC 10634292
 Verifique
Verifique |pmc=(ajuda). PMID 37261927 Verifique|pmid=(ajuda). doi:10.1093/scan/nsad032 - ↑ Gattuso JJ, Perkins D, Ruffell S, Lawrence AJ, Hoyer D, Jacobson LH, Timmermann C, Castle D, Rossell SL, Downey LA, Pagni BA, Galvão-Coelho NL, Nutt D, Sarris J (março 2023). «Default Mode Network Modulation by Psychedelics: A Systematic Review». The International Journal of Neuropsychopharmacology. 26 (3): 155–188. PMC 10032309
 . PMID 36272145. doi:10.1093/ijnp/pyac074
. PMID 36272145. doi:10.1093/ijnp/pyac074 - ↑ «Drug Addictions, Hallucinogens and Shamanism: the View from Anthropology - Document - Gale Academic OneFile». Consultado em 23 de agosto de 2021. Cópia arquivada em 23 de agosto de 2021
- ↑ a b c Batchelder T (2001). «Drug Addictions, Hallucinogens and Shamanism: the View from Anthropology». Drug Addictions, Hallucinogens and Shamanism. Townsend Letter for Doctors and Patients. 217: 74–77. Consultado em 23 de agosto de 2021. Cópia arquivada em 19 de outubro de 2021 – via Gale Academic OneFile
- ↑ Leary T (2007). The psychedelic experience : a manual based on the Tibetan book of the dead. Ralph Metzner, Ram Dass, activeth century Karma-gliṅ-pa. New York: Citadel Press. ISBN 978-0-8065-1652-3. OCLC 318713242. Consultado em 23 de agosto de 2021. Cópia arquivada em 19 de outubro de 2021
- ↑ Dos Santos RG, Bouso JC, Rocha JM, Rossi GN, Hallak JE (24 de abril de 2024). «The Use of Classic Hallucinogens/Psychedelics in a Therapeutic Context: Healthcare Policy Opportunities and Challenges». Risk Management and Healthcare Policy. 14: 901–910. PMC 7943545
 . PMID 33707976. doi:10.2147/RMHP.S300656
. PMID 33707976. doi:10.2147/RMHP.S300656
- ↑ Hendricks PS (outubro 2020). «Psilocybin-assisted group therapy: A new hope for demoralization». eClinicalMedicine. 27. 100557 páginas. PMC 7549063
 . PMID 33073220. doi:10.1016/j.eclinm.2020.100557
. PMID 33073220. doi:10.1016/j.eclinm.2020.100557 - ↑ Winkelman MJ (2007). «Therapeutic bases of psychedelic medicines: psychointegrative effects». In: Winkelman MJ, Roberts TB. Psychedelic Medicine: New Evidence for Hallucinogenic Substances as Treatments. 1. Westport, Connecticut: Praeger. pp. 1–19. ISBN 978-0-275-99024-4
- ↑ McKenna T (1993). Food of the Gods: The Search for the Original Tree of Knowledge. A Radical History of Plants, Drugs, and Human Evolution. New York, New York: Bantam Books. ISBN 978-0-553-37130-7
- ↑ James W (1902). The Varieties of Religious Experience. New York, New York: Simon & Schuster. ISBN 978-0-684-84297-4
- ↑ Metzner R (1998). «Hallucinogenic drugs and plants in psychotherapy and shamanism» (PDF). Journal of Psychoactive Drugs. 30 (4): 333–341. CiteSeerX 10.1.1.509.4769
 . PMID 9924839. doi:10.1080/02791072.1998.10399709. Consultado em 26 de outubro de 2017. Cópia arquivada (PDF) em 21 de setembro de 2017
. PMID 9924839. doi:10.1080/02791072.1998.10399709. Consultado em 26 de outubro de 2017. Cópia arquivada (PDF) em 21 de setembro de 2017 - ↑ Pahnke WN, Richards WA (julho 1966). «Implications of LSD and experimental mysticism». Journal of Religion and Health. 5 (3): 175–208. PMID 24424798. doi:10.1007/BF01532646
- ↑ Pahnke WN (1966). «Drugs and mysticism». International Journal of Parapsychology. 8 (2): 295–315
- ↑ a b Griffiths R, Richards W, Johnson M, McCann U, Jesse R (agosto 2008). «Mystical-type experiences occasioned by psilocybin mediate the attribution of personal meaning and spiritual significance 14 months later» (PDF). Journal of Psychopharmacology. 22 (6): 621–632. PMC 3050654
 . PMID 18593735. doi:10.1177/0269881108094300. Consultado em 3 de julho de 2008. Arquivado do original (PDF) em 22 de julho de 2008
. PMID 18593735. doi:10.1177/0269881108094300. Consultado em 3 de julho de 2008. Arquivado do original (PDF) em 22 de julho de 2008 - ↑ Smith H (2000). Cleansing the Doors of Perception: The Religious Significance of Entheogenic Plants and Chemicals. New York, New York: Jeremy P. Tarcher/Putnam. p. 101. ISBN 978-1-58542-034-6
- ↑ a b Doblin R (1991). «Pahnke's "Good Friday Experiment": a long-term follow-up and methodological critique». Journal of Transpersonal Psychology. 23 (1): 1–25
- ↑ Richards WA (2008). «The phenomenology and potential religious import of states of consciousness facilitated by psilocybin». Archive for the Psychology of Religion. 30 (1): 189–199. doi:10.1163/157361208X317196
- ↑ Griffiths RR, Richards WA, McCann U, Jesse R (agosto 2006). «Psilocybin can occasion mystical-type experiences having substantial and sustained personal meaning and spiritual significance» (PDF). Psychopharmacology. 187 (3): 268–283. PMID 16826400. doi:10.1007/s00213-006-0457-5. Arquivado do original (PDF) em 9 de novembro de 2011
- ↑ Simpkins B (11 de julho de 2006). «Press release: Griffiths psilocybin». Johns Hopkins Medicine. Consultado em 12 de julho de 2006. Cópia arquivada em 16 de julho de 2011
- ↑ Arici M, Altun B, Araz M, Atmaca A, Demir T, Ecder T, Guz G, Gogas Yavuz D, Yildiz A, Yilmaz T (1975). «The significance of finerenone as a novel therapeutic option in diabetic kidney disease: a scoping review with emphasis on cardiorenal outcomes of the finerenone phase 3 trials». Frontiers in Medicine. 11 (1). 1384454 páginas. JSTOR 1384454. PMC 11214281
 Verifique
Verifique |pmc=(ajuda). PMID 38947237 Verifique|pmid=(ajuda). doi:10.2307/1384454 - ↑ Smith M (12 de julho de 2006). «Medical News: Psilocybin Viewed as Therapy or Research Tool». Medpagetoday.com. Consultado em 12 de fevereiro de 2011. Cópia arquivada em 5 de outubro de 2008
- ↑ a b Carhart-Harris RL, Nutt DJ (2010). «User perceptions of the benefits and harms of hallucinogenic drug use: a web-based questionnaire study». Journal of Substance Abuse. 15 (4): 283–300. doi:10.3109/14659890903271624
- ↑ «Paul McHugh reviews Don Lattin's "The Harvard Psychedelic Club."». commentarymagazine.com. 1 de abril de 2010. Consultado em 10 de abril de 2019. Cópia arquivada em 10 de abril de 2019
- ↑ Sabé M, Sulstarova A, Glangetas A, De Pieri M, Mallet L, Curtis L, Richard-Lepouriel H, Penzenstadler L, Seragnoli F, Thorens G, Zullino D, Preller K, Böge K, Leucht S, Correll CU, Solmi M, Kaiser S, Kirschner M (março 2025). «Reconsidering evidence for psychedelic-induced psychosis: an overview of reviews, a systematic review, and meta-analysis of human studies». Mol Psychiatry. 30 (3): 1223–1255. PMC 11835720
 Verifique
Verifique |pmc=(ajuda). PMID 39592825 Verifique|pmid=(ajuda). doi:10.1038/s41380-024-02800-5 - ↑ Downey AE, Bradley ER, Lerche AS, O'Donovan A, Krystal AD, Woolley J (junho de 2024). «A Plea for Nuance: Should People with a Family History of Bipolar Disorder Be Excluded from Clinical Trials of Psilocybin Therapy?» (PDF). Psychedelic Med (New Rochelle). 2 (2): 61–73. PMC 11658676
 Verifique
Verifique |pmc=(ajuda). PMID 40051581 Verifique|pmid=(ajuda). doi:10.1089/psymed.2023.0051 Parâmetro desconhecido|pmc-embargo-date=ignorado (ajuda) - ↑ a b Yao Y, Guo D, Lu TS, Liu FL, Huang SH, Diao MQ, Li SX, Zhang XJ, Kosten TR, Shi J, Bao YP, Lu L, Han Y (maio 2024). «Efficacy and safety of psychedelics for the treatment of mental disorders: A systematic review and meta-analysis». Psychiatry Res. 335. 115886 páginas. PMID 38574699 Verifique
|pmid=(ajuda). doi:10.1016/j.psychres.2024.115886 - ↑ Wolf G, Singh S, Blakolmer K, Lerer L, Lifschytz T, Heresco-Levy U, Lotan A, Lerer B (janeiro 2023). «Could psychedelic drugs have a role in the treatment of schizophrenia? Rationale and strategy for safe implementation». Mol Psychiatry. 28 (1): 44–58. PMID 36280752. doi:10.1038/s41380-022-01832-z
- ↑ Sapienza J, Martini F, Comai S, Cavallaro R, Spangaro M, De Gregorio D, Bosia M (fevereiro de 2025). «Psychedelics and schizophrenia: a double-edged sword». Mol Psychiatry. 30 (2): 679–692. PMID 39294303 Verifique
|pmid=(ajuda). doi:10.1038/s41380-024-02743-x - ↑ Maćkowiak M (dezembro 2023). «Psychedelics action and schizophrenia». Pharmacol Rep. 75 (6): 1350–1361. PMC 10661800
 Verifique
Verifique |pmc=(ajuda). PMID 37899392 Verifique|pmid=(ajuda). doi:10.1007/s43440-023-00546-5 - ↑ Bosch OG, Halm S, Seifritz E (julho 2022). «Psychedelics in the treatment of unipolar and bipolar depression». Int J Bipolar Disord. 10 (1). 18 páginas. PMC 9256889
 . PMID 35788817. doi:10.1186/s40345-022-00265-5
. PMID 35788817. doi:10.1186/s40345-022-00265-5
- ↑ Carrithers BM, Roberts DE, Weiss BM, King JD, Carhart-Harris RL, Gordon AR, Pagni BA, Moreau M, Ross S, Zeifman RJ (março 2025). «Exploring Serotonergic Psychedelics as a Treatment for Personality Disorders». Neuropharmacology. 110413 páginas. PMID 40081794 Verifique
|pmid=(ajuda). doi:10.1016/j.neuropharm.2025.110413 - ↑ a b c d e f g h i j k l m Halman A, Kong G, Sarris J, Perkins D (janeiro de 2024). «Drug-drug interactions involving classic psychedelics: A systematic review». J Psychopharmacol. 38 (1): 3–18. PMC 10851641
 Verifique
Verifique |pmc=(ajuda). PMID 37982394 Verifique|pmid=(ajuda). doi:10.1177/02698811231211219 - ↑ a b c d e f Yates G, Melon E (janeiro de 2024). «Trip-killers: a concerning practice associated with psychedelic drug use». Emerg Med J. 41 (2): 112–113. PMID 38123961 Verifique
|pmid=(ajuda). doi:10.1136/emermed-2023-213377 - ↑ a b c «Psilocybin (Magic Mushrooms)». National Institute on Drug Abuse, US National Institutes of Health. 24 de janeiro de 2024. Consultado em 24 de abril de 2024
- ↑ Pagliaro LA, Pagliaro AM (2012). Handbook of Child and Adolescent Drug and Substance Abuse: Pharmacological, Developmental, and Clinical Considerations 2nd ed. Hoboken, New Jersey: John Wiley & Sons. p. 199. ISBN 978-0-470-63906-1. Consultado em 27 de fevereiro de 2016. Cópia arquivada em 3 de abril de 2017
- ↑ Schaefer C (2001). Drugs During Pregnancy and Lactation: Handbook of Prescription Drugs and Comparative Risk Assessment. Amsterdam, the Netherlands: Elsevier. p. 222. ISBN 978-0-444-50763-1. Consultado em 27 de fevereiro de 2016. Cópia arquivada em 3 de abril de 2017
- ↑ Peden NR, Pringle SD, Crooks J (outubro 1982). «The problem of psilocybin mushroom abuse». Human Toxicology. 1 (4): 417–424. PMID 7173927. doi:10.1177/096032718200100408
- ↑ a b Vollenweider FX, Vollenweider-Scherpenhuyzen MF, Bäbler A, Vogel H, Hell D (dezembro 1998). «Psilocybin induces schizophrenia-like psychosis in humans via a serotonin-2 agonist action» (PDF). NeuroReport. 9 (17): 3897–3902. PMID 9875725. doi:10.1097/00001756-199812010-00024. Arquivado do original (PDF) em 3 de março de 2019
- ↑ Hyde C, Glancy G, Omerod P, Hall D, Taylor GS (junho de 1978). «Abuse of indigenous psilocybin mushrooms: a new fashion and some psychiatric complications». The British Journal of Psychiatry. 132 (6): 602–604. PMID 566144. doi:10.1192/bjp.132.6.602
- ↑ Mack RB (outubro 1983). «Phenomenally phunny phungi--psilocybin toxicity». North Carolina Medical Journal. 44 (10): 639–640. PMID 6580536
- ↑ Simeon D (2004). «Depersonalisation disorder: a contemporary overview». CNS Drugs. 18 (6): 343–354. PMID 15089102. doi:10.2165/00023210-200418060-00002
- ↑ Nielen RJ, van der Heijden FM, Tuinier S, Verhoeven WM (janeiro 2004). «Khat and mushrooms associated with psychosis». The World Journal of Biological Psychiatry. 5 (1): 49–53. PMID 15048636. doi:10.1080/15622970410029908
- ↑ Geyer MA (julho 1998). «Behavioral studies of hallucinogenic drugs in animals: implications for schizophrenia research». Pharmacopsychiatry. 31 (S2): 73–79. PMID 9754837. doi:10.1055/s-2007-979350
- ↑ a b Vollenweider FX, Geyer MA (novembro 2001). «A systems model of altered consciousness: integrating natural and drug-induced psychoses». Brain Research Bulletin. 56 (5): 495–507. PMID 11750795. doi:10.1016/S0361-9230(01)00646-3
- ↑ Geyer MA, Vollenweider FX (setembro 2008). «Serotonin research: contributions to understanding psychoses». Trends in Pharmacological Sciences. 29 (9): 445–453. PMID 19086254. doi:10.1016/j.tips.2008.06.006
- ↑ Myers LS, Watkins SS, Carter TJ (1998). «Flashbacks in theory and practice» (PDF). The Heffter Review of Psychedelic Research. 1: 51–57. Consultado em 14 de agosto de 2011. Cópia arquivada (PDF) em 27 de setembro de 2011
- ↑ Gable RS (2006). «Acute toxicity of drugs versus regulatory status». In: Fish JM. Drugs and Society: U.S. Public Policy. Lanham, Maryland: Rowman & Littlefield. pp. 149–162; Table 7.1 "Safety Ratio and Dependence Potential of Psychoactive Drugs". ISBN 978-0-7425-4245-7. Cópia arquivada em 7 de janeiro de 2012
- ↑ a b Nicholas LG, Ogame K (2006). Psilocybin Mushroom Handbook: Easy Indoor and Outdoor Cultivation. Oakland, California: Quick American Archives. p. 164. ISBN 978-0-932551-71-9. Consultado em 27 de fevereiro de 2016. Cópia arquivada em 4 de abril de 2017
- ↑ Passie T, Halpern JH, Stichtenoth DO, Emrich HM, Hintzen A (2008). «The pharmacology of lysergic acid diethylamide: a review». CNS Neuroscience & Therapeutics. 14 (4): 295–314. PMC 6494066
 . PMID 19040555. doi:10.1111/j.1755-5949.2008.00059.x
. PMID 19040555. doi:10.1111/j.1755-5949.2008.00059.x - ↑ a b c d e f g h


 French
French Deutsch
Deutsch
