Reação de Baylis-Hillman – Wikipédia, a enciclopédia livre
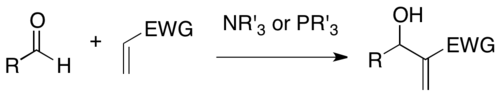
A reação de Baylis-Hillman é uma reação de formação de ligação carbono-carbono entre a posição α de um alqueno ativado e um aldeído, ou geralmente um eletrófilo de carbono. Empregando um catalisador nucleófilo, tal como amina terciária e fosfina, esta reação fornece um produto densamente funcionalizado (e.g. álcool alílico funcionalizado no caso de aldeído como eletrófilo).[1][2] Esta reação é também conhecida como reação de Morita–Baylis–Hillman ou reação MBH.[3] Ela é nomeada devido a seu desenvolvimento pelo químico japonês Ken-ichi Morita, o químico britânico Anthony B. Baylis, e o químico alemão Melville E. D. Hillman.
DABCO é um dos catalisadores aminas terciárias mais frequentemente usados para esta reação. Em adição, aminas nucleofílicas tais como DMAP e DBU assim como fosfinas tem sido encontradas para catalisar com sucesso esta reação.
A reação MBH tem diversas vantagens como um método sintético útil: 1) É um acoplamento econômico em termos de átomos de materiais de partida facilmente preparados. 2) Reação de um eletrófilo pro-quiral gera um centro quiral,portanto, é possível uma síntese assimétrica. 3) Produtos de reação geralmente contém múltiplas funcionalidades em uma proximidade, de modo que uma variedade de transformações adicionais são possíveis. 4) Pode empregar um sistema organocatalítico nucleofílico sem o uso de metal pesado sob condições suaves.
Várias revisões tem sido escritas.[4][5][6][7][8]
Mecanismo de reação
[editar | editar código-fonte]Hoffmann propôs primeiramente um mecanismo para a reação MBH.[9] A primeira etapa de reação envolve adição 1,4 da amina terciária catalítica ao alceno ativado para gerar o aza-enolato zwitteriônico. Na segunda etapa, este enolato adiciona-se a um aldeído via uma adição aldólica. A terceira etapa envolve mudança de próton intramolecular, que posteriormente gera o aduto MBH final e libera o catalisador via eliminação E2 ou E1cb na última etapa. Hill e Isaacs realizaram experimentos cinéticos para sondar os detalhes do mecanismo.[10] A taxa de reação entre acrilonitrila e acetaldeído era de primeira ordem em concentrações de acrilonitrila, acetaldeído, e DABCO. Hill e Isaacs propuseram que esta etapa de adição aldólica, que envolve todos os três reagentes, é o passo determinante da taxa. Eles não observaram efeito isotópico cinético usando acrilonitrila α-deuterada, o que também apoiou esta afirmação.

No entanto, essa proposta inicial de mecanismo foi criticada por vários pontos. A taxa da reação MBH foi acelerado pela acumulação de produtos (efeito autocatalítico), o que não poderia ser explicado pelo mecanismo. Também a formação de uma quantidade considerável de subproduto de dioxanona "incomum" na reação MBH de aril aldeídos com acrilatos não era esperada.
McQuade et al. e Aggarwal et al. reavaliaram o mecanismo MBH usando tanto cinética como estudos teóricos, focando na etapa de transferência de próton.[11][12] De acordo com McQuade, a reação MBH entre acrilato de metila e p-nitrobenzaldeído é de segunda tarde relativo ao aldeído e mostra um efeito isotópico cinético (KIE, abreviação na literatura em língua inglesa de kinetic isotope effect) significativo na posição α do acrilato (5,2 em DMSO). Curiosamente, independentemente dos solventes o KIE foi encontrado maiores do que 2, indicando a relevância da abstração de próton como deterrninante da taxa da etapa (RDS, rate-determining step). Baseado nestes novos dados, McQuade propôs um novo mecanismo, sugerindo que a etapa de transferência de próton é a RDS. A primeira e a segunda etapas não mudaram, mas após a primeira adição aldólica a segunda adição de aldeído ocorre formar um alcóxido hemiacetal. Então a etapa de transferência de próton determinante de taxa via estado de transição de seis membros liberando o aduto A, a qual reage ainda mais e produz o produto MBH B ou subproduto dioxanona C. Este mecanismo é responsável pela formação de subproduto dioxanona.
Referências
- ↑ Baylis, A. B.; Hillman, M. E. D. German Patent 2155113, 1972.
- ↑ Ciganek, E. Org. React. 1997, 51, 201. doi:10.1002/0471264180.or051.02
- ↑ K. Morita, Z. Suzuki and H. Hirose, Bull. Chem. Soc. Jpn.,1968, 41, 2815.
- ↑ Recent Advances in the Baylis−Hillman Reaction and Applications Deevi Basavaiah, Anumolu Jaganmohan Rao, and Tummanapalli Satyanarayana Chem. Rev., 2003, 103 (3), pp 811–892 2003 (Article) doi:10.1021/cr010043d
- ↑ Masson, G., Housseman, C. and Zhu, J. (2007), The Enantioselective Morita–Baylis–Hillman Reaction and Its Aza Counterpart. Angewandte Chemie International Edition, 46: 4614–4628. doi:10.1002/anie.200604366
- ↑ aza-Baylis−Hillman Reaction Valerie Declerck, Jean Martinez and Frederic Lamaty Chem. Rev., 2009, 109 (1), pp 1–48, 2009 (Review) doi:10.1021/cr068057c
- ↑ Recent Contributions from the Baylis−Hillman Reaction to Organic Chemistry Deevi Basavaiah, Bhavanam Sekhara Reddy and Satpal Singh Badsara Chemical Reviews 2010 110 (9), 5447-5674 doi:10.1021/cr900291g
- ↑ The Baylis–Hillman reaction: a novel concept for creativity in chemistry Deevi Basavaiah and Gorre Veeraraghavaiah Chem. Soc. Rev., 2012, Advance Article doi:10.1039/C1CS15174F
- ↑ Angew. Chem. Int. Ed. Engl. 1983, 22, 795.
- ↑ J. Phys. Org. Chem. 1990, 3, 285.
- ↑ Organic Letters, 2005, 7, 1, 147-150.
- ↑ Angew. Chem. Int. Ed. 2005, 44, 1706-1708.


 French
French Deutsch
Deutsch