Secvențierea ADN
Secvențierea ADN-ului este o metodă ce permite determinarea secvenței nucleotidice a unei molecule de ADN. Cunoașterea secvențelor de ADN a devenit esențială în biologia de bază, dar și în numeroase alte științe, cum ar fi diagnosticarea, biotehnologia, medicina legală, virologia sau biologia sistemică. Mulțumită secvențierii ADN au fost completate genomurile diferitor specii, cum ar fi homo sapiens, dar și multe animale, plante și microbi.
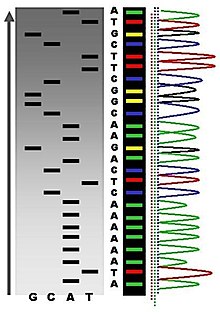
Metodele pentru determinarea secvenței nucleotidice a unor fragmente de ADN au fost descoperite independent de Allan Maxam și Walter Gilbert de la Universitatea Harvard în 1976–1977 (tehnica de degradare chimică) și Frederick Sanger de la Universitatea Cambridge în 1970 (tehnica de sinteză enzimatică).
Secvențierea ADN-ul permite stabilirea structurii genei precum și secvența de amino-acizi a proteinei codificată de genă (în cazul în care ea nu a fost identificată). De asemenea secvențierea ADN-ul poate determina tipul de mutație care a produs o boală genetică.
Folosirea secvențierii
[modificare | modificare sursă]Secvențierea ADN poate fi folosită pentru determinarea secvențelor ADN individuale ale genelor, ale regiunilor mari genetice (grupuri de gene sau operoni, cromozomi întregi sau chiar genomuri. Secvențierea determină ordinea nucleotidelor prezente în moleculele de ADN și ARN izolate de la animale, plate, bacterii, archaea sau, virtual, orice altă formă de viață.
Biologia moleculară
[modificare | modificare sursă]Secvențierea este folosită în biologia moleculară pentru a studia genomurile și proteinele codate de acestea. Informațiile obținute în urma secvențierii ajută cercetătorii să descopere schimbări în gene, asocieri cu boli sau fenotipuri și să identifice ținte pentru noi medicamente.
Biologie evolutivă
[modificare | modificare sursă]ADN-ul reprezintă o moleculă care oferă informații referitoare la moștenirea genetică. De aceea, secvențierea ADN este folosită în biologia evolutivă pentru a studia înrudirea diferitelor organisme și felul în care au evoluat acestea.
Metagenomică
[modificare | modificare sursă]Domeniul metagenomicii identifică organismele din ape, canele de scurgere, noroi sau mostre de salivă. Cunoașterea organismelor dintr-un anumit mediu este esențială în ecologie, epidemiologie, microbiologie și alte domenii. De exemplu, secvențierea permite cercetătorilor să determine tipurile de microbi prezente într-un microbiom.
Medicină
[modificare | modificare sursă]Tehnicienii pot secvenția gene ale pacienților pentru a determina riscul bolilor genetice. Acesta este un tip de testare genetică.
Medicina legală
[modificare | modificare sursă]Secvențiera ADN poate fi folosită, alături de amprentarea ADN, pentru identificarea cadavrelor sau pentru testele de paternitate.
Istoric
[modificare | modificare sursă]Acidul deoxiribonucleic (ADN) a fost descoperit și izolat de către Friedrich Miescher în 1869, dar a rămas în umbră mai multe zeci de ani deoarece s-a crezut că proteinele transmiteau informația genetică. Situația s-a schimbat după 1944, când Oswald Avery, Colin MacLeod și Maclyn McCarty au demostrat că ADN-ul purificat de la o bacterie poate schimba bacteriile dintr-un tip într-altul, în procesul numit transformare genetică.
În 1953 James Watson și Francis Crick au demonstrat că ADN-ul are forma unui dublu helix. [1]
Bazele secvențierii ADN au fost puse de Fred Sanger, care în 1955 a conpletat secvența amino-acizilor din insulină, o proteină de mici dimensiuni produsă de pancreas. Munca sa a demonstrat că proteinele sunt entități cu o structură bine definită, și nu un amalgam nedefinit. După 1954, Crick a dezvoltat teoria care susținea că aranjamentul nucleotidelor din ADN determină secvențele amino-acizilor din proteine. [2]
Secvențierea ARN
[modificare | modificare sursă]Secvențierea ARN este una dintre cele mai vechi tehnici de secvențiere a nucleotidelor. Studiul de bază al secvențierii ARN a fost secvențierea primei gene complete și secvențierea genomului bacteriofagului MS2, identificat și publicat de către Walter Fiers și colegii lui, de la Universitatea Gent (Gent, Belgia), in 1972[3] și 1976.[4].
Secvențierea genomurilor întregi
[modificare | modificare sursă]Primul genom întreg secvențiat vreodată a fost cel al bacteriofagului φX174 în anul 1977.[5] Cercetătorii de la MRC, Marea Britanie au descifrat ADN-ul complet al virusului Epstein-Barr în 1984.[6]
Secvențierea de nouă generație
[modificare | modificare sursă]Mai multe metode noi de secvențiere ADN au fost dezvoltate în anii 90 și au apărut pe piață în anul 2000.
În octombrie 1990 Roger Tsien, Pepi Ross, Margaret Fahnestock și Allan J Johnston au depus actele pentru un patent care descria secvențierea pas cu pas (bază cu bază).[7] În 1996, Pål Nyrén și studentul său Mostafa Ronaghi de la Institutul Regal de Tehnologie din Stockholm au publicat metoda lor de pirosecvențiere.[8]
În 1997, Pascal Mayer și Laurent Farinelli au depus actele pentru patente care descriau secvențierea ADN-ul din coloniile de microbi.[9] Principiile acestor patente, împreună cu secvențierea bază-cu-bază propusă de Roger Tsien et al. sunt implementate de compania Illumina, în mașinăriile Hi-Seq.
Secvențierea shotgun
[modificare | modificare sursă]Secevențierea shotgun este o metodă de secvențiere destinată analizei secvențelor ADN mai lungi de 1000 de baze, sau chiar de dimensiunile unui cromozom. Această metpdă presupe ca ADN-ul să fie rupt în fragmente de dimensiuni variabile. După secvențierea fragmentelor individuale, segmentele pot fi reasamblate pe baza regiunilor în care se suprapun.[10]
Secvențierea de nouă generație
[modificare | modificare sursă]
Secvențierea de nouă generație se referă la secvențierea genomurilor, re-secvențierea acestora, secvențierea transcriptomurilor (RNA-Seq), interacțiunea ADN-proteine (secvențierea ChIP), și caracterizarea epigenomurilor.[11] Re-secvențierea este necesară pentru că genomul unui singur individ nu este reprezentativ pentru întreaga specie.
Cererea pentru secvențiere ieftină a dus la dezvoltarea tehnologiei secvențierii la scară largă (sau secvențiere de nouă generație) care paralelizează procesul de secvențiere, producând milioane de secvențe ADN în același timp.[12][13]
| Metodă | Lungimea secvenței citite | Acuratețe (citire a unei baze fără consens) | Citiri pe tură | Timp pe tură | Costul unui milion de baze citite (in US$) | Avantaje | Dezavantaje |
|---|---|---|---|---|---|---|---|
| Secvențiere în timp real a unei singure molecule (Pacific Biosciences) | 10,000 bp - 15,000 bp medie (14,000 bp N50);mărimea maximă a unei singure citiri >40,000 de baze[16][17][18] | 87% [19] | 50,000 pe celulă SMRT sau 500–1000 Mb[20][21] | între 30 minute și 4 ore [22] | $0.13–$0.60 | Citiri extrem de lungi. Rapid.[23] | Număr de citiri relativ mic. Echipamentul e în general foarte scump. |
| Ion semiconductor (Secvențierea Ion Torrent) | până la 400 bp | 98% | până la 80 de milioane | 2 ore | $1 | Echipament mai ieftin. Rapid. | Erori. |
| Pirosecvențierea (454) | 700 bp | 99.9% | 1 milion | 24 ore | $10 | Citiri lungi. Rapid. | Scump. Erori. |
| Secvențierea prin sinteză (Illumina) | de la 50 la 300 bp | 99.9% (Phred30) | până la 5 miliarde (TruSeq, perechi) | între o zi și 11 zile, depinde de lungimea citirilor [24] | între $0.05 și $0.15 | Secvențe multe. | Echipament scump. Cere mari cantități de ADN. |
| Secvențierea prin ligație (secvențierea SOLiD) | 50+35 sau 50+50 bp | 99.9% | între 1.2 și 1.4 miliarde | 1 sau 2 săptămâni | $0.13 | ieftin. | Ia mai mult timp decât celelalte metode. Are probleme cu secvențele palindromice.[25] |
| Secvențierea Sanger | între 400 și 900 bp | 99.9% | N/A | între 20 de minute și 3 ore | $2400 | Citiri lungi. | Scump și nu foarte practic în proiectele ample. Presupune Reacția de polimerizare în lanț sau clonare plasmidelor. |
| Secvențierea nanopore | până la 50000 bp | 70% | N/A | 75 bp/s | Citiri lungi. Rezultate rapide. Mașinăria MinION este portabilă, de mărimea unui telefon. | Acurarețe foarte slabă. |
Vezi si
[modificare | modificare sursă]- Secvențierea Sanger
- Secvențierea nanopore
- Secvențierea Ion Torrent
- Secvențiere în timp real a unei singure molecule
Referințe
[modificare | modificare sursă]- ^ Watson JD, Crick FH (). „The structure of DNA”. Cold Spring Harb. Symp. Quant. Biol. 18: 123–31. doi:10.1101/SQB.1953.018.01.020. PMID 13168976.
- ^ Marks, L, The path to DNA sequencing: The life and work of Fred Sanger.
- ^ Min Jou W, Haegeman G, Ysebaert M, Fiers W (mai 1972). „Nucleotide sequence of the gene coding for the bacteriophage MS2 coat protein”. Nature. 237 (5350): 82–8. Bibcode:1972Natur.237...82J. doi:10.1038/237082a0. PMID 4555447.
- ^ Fiers W, Contreras R, Duerinck F, Haegeman G, Iserentant D, Merregaert J, Min Jou W, Molemans F, Raeymaekers A, Van den Berghe A, Volckaert G, Ysebaert M (aprilie 1976). „Complete nucleotide sequence of bacteriophage MS2 RNA: primary and secondary structure of the replicase gene”. Nature. 260 (5551): 500–7. Bibcode:1976Natur.260..500F. doi:10.1038/260500a0. PMID 1264203.
- ^ Sanger F, Air GM, Barrell BG, Brown NL, Coulson AR, Fiddes CA, Hutchison CA, Slocombe PM, Smith M (februarie 1977). „Nucleotide sequence of bacteriophage phi X174 DNA”. Nature. 265 (5596): 687–95. Bibcode:1977Natur.265..687S. doi:10.1038/265687a0. PMID 870828.
- ^ The path to DNA sequencing: The life and work of Fred Sanger.
- ^ „Tsien base-by-base sequencing patent”. Arhivat din original la . Accesat în .
- ^ Ronaghi M, Karamohamed S, Pettersson B, Uhlén M, Nyrén P (). „Real-time DNA sequencing using detection of pyrophosphate release”. Analytical Biochemistry. 242 (1): 84–9. doi:10.1006/abio.1996.0432. PMID 8923969.
- ^ Kawashima, Eric H.; Laurent Farinelli; Pascal Mayer (). „Patent: Method of nucleic acid amplification”. Arhivat din original la . Accesat în .
- ^ Staden R (). „A strategy of DNA sequencing employing computer programs”. Nucleic Acids Research. 6 (7): 2601–10. doi:10.1093/nar/6.7.2601. PMC 327874
 . PMID 461197.
. PMID 461197. - ^ de Magalhães JP, Finch CE, Janssens G (). „Next-generation sequencing in aging research: emerging applications, problems, pitfalls and possible solutions”. Ageing Research Reviews. 9 (3): 315–323. doi:10.1016/j.arr.2009.10.006. PMC 2878865
 . PMID 19900591.
. PMID 19900591. - ^ Hall N (mai 2007). „Advanced sequencing technologies and their wider impact in microbiology”. J. Exp. Biol. 209 (Pt 9): 1518–1525. doi:10.1242/jeb.001370. PMID 17449817.

- ^ Church GM (ianuarie 2006). „Genomes for all”. Sci. Am. 294 (1): 46–54. doi:10.1038/scientificamerican0106-46. PMID 16468433.(necesită abonare)
- ^ Quail MA, Smith M, Coupland P, Otto TD, Harris SR, Connor TR, Bertoni A, Swerdlow HP, Gu Y (). „A tale of three next generation sequencing platforms: comparison of Ion Torrent, Pacific Biosciences and illumina MiSeq sequencers”. BMC Genomics. 13 (1): 341. doi:10.1186/1471-2164-13-341. PMC 3431227
 . PMID 22827831.
. PMID 22827831.
- ^ Liu L, Li Y, Li S, Hu N, He Y, Pong R, Lin D, Lu L, Law M (). „Comparison of Next-Generation Sequencing Systems”. Journal of Biomedicine and Biotechnology. Hindawi Publishing Corporation. 2012: 1–11. doi:10.1155/2012/251364. PMID 22829749.

- ^ New Products: PacBio's RS II; Cufflinks | In Sequence | Sequencing | GenomeWeb
- ^ „After a Year of Testing, Two Early PacBio Customers Expect More Routine Use of RS Sequencer in 2012”. GenomeWeb. .(înregistrare solicitată)
- ^ Pacific Biosciences Introduces New Chemistry With Longer Read Lengths
- ^ Chin CS, Alexander DH, Marks P, Klammer AA, Drake J, Heiner C, Clum A, Copeland A, Huddleston J, Eichler EE, Turner SW, Korlach J (). „Nonhybrid, finished microbial genome assemblies from long-read SMRT sequencing data”. Nat. Methods. 10 (6): 563–9. doi:10.1038/nmeth.2474. PMID 23644548.
- ^ De novo bacterial genome assembly: a solved problem? | In between lines of code
- ^ Rasko DA, Webster DR, Sahl JW, Bashir A, Boisen N, Scheutz F, Paxinos EE, Sebra R, Chin CS, Iliopoulos D, Klammer A, Peluso P, Lee L, Kislyuk AO, Bullard J, Kasarskis A, Wang S, Eid J, Rank D, Redman JC, Steyert SR, Frimodt-Møller J, Struve C, Petersen AM, Krogfelt KA, Nataro JP, Schadt EE, Waldor MK (). „Origins of the Strain Causing an Outbreak of Hemolytic–Uremic Syndrome in Germany”. N Engl J Med. 365 (8): 709–717. doi:10.1056/NEJMoa1106920. PMID 21793740.

- ^ Tran B, Brown AM, Bedard PL, Winquist E, Goss GD, Hotte SJ, Welch SA, Hirte HW, Zhang T, Stein LD, Ferretti V, Watt S, Jiao W, Ng K, Ghai S, Shaw P, Petrocelli T, Hudson TJ, Neel BG, Onetto N, Siu LL, McPherson JD, Kamel-Reid S, Dancey JE (). „Feasibility of real time next generation sequencing of cancer genes linked to drug response: Results from a clinical trial”. Int. J. Cancer. 132 (7): 1547–1555. doi:10.1002/ijc.27817. PMID 22948899.(necesită abonare)
- ^ Murray IA, Clark TA, Morgan RD, Boitano M, Anton BP, Luong K, Fomenkov A, Turner SW, Korlach J, Roberts RJ (). „The methylomes of six bacteria”. Nucleic Acids Research. 40 (22): 11450–62. doi:10.1093/nar/gks891. PMC 3526280
 . PMID 23034806.
. PMID 23034806. - ^ van Vliet AH (). „Next generation sequencing of microbial transcriptomes: challenges and opportunities”. FEMS Microbiology Letters. 302 (1): 1–7. doi:10.1111/j.1574-6968.2009.01767.x. PMID 19735299.

- ^ Huang YF, Chen SC, Chiang YS, Chen TH, Chiu KP (). „Palindromic sequence impedes sequencing-by-ligation mechanism”. BMC Systems Biology. 6 Suppl 2: S10. doi:10.1186/1752-0509-6-S2-S10. PMID 23281822.


 French
French Deutsch
Deutsch