N,N-Диметилформамид — Википедия
| N,N-Диметилформамид | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | N,N-Диметилформамид | ||
| Сокращения | DMF, ДМФА | ||
| Традиционные названия | Диметилформамид | ||
| Хим. формула | C3H7NO | ||
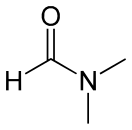
| Рац. формула | (CH3)2NC(O)H | ||
| Физические свойства | |||
| Состояние | прозрачная жидкость | ||
| Молярная масса | 73.09 г/моль | ||
| Плотность | 0,9445 г/см³ | ||
| Динамическая вязкость | 0,92 мПа·с (20 °C) | ||
| Энергия ионизации | 9,12 ± 0,01 эВ и 9,13 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -61 °C | ||
| • кипения | 153 °C | ||
| • вспышки | 59 °C | ||
| Пределы взрываемости | 2,2 ± 0,1 об.% | ||
| Мол. теплоёмк. | 148,37 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | 192 кДж/моль | ||
| Удельная теплота испарения | 42,3 Дж/кг | ||
| Давление пара | 3 ± 1 мм рт.ст. | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | ∞ | ||
| • в спирте | ∞ | ||
| Оптические свойства | |||
| Показатель преломления | 1,43 | ||
| Структура | |||
| Дипольный момент | 3,82 Д | ||
| Классификация | |||
| Рег. номер CAS | 68-12-2 | ||
| PubChem | 6228 | ||
| Рег. номер EINECS | 200-679-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | LQ2100000 | ||
| ChEBI | 17741 | ||
| Номер ООН | 2265 | ||
| ChemSpider | 5993 | ||
| Безопасность | |||
| ЛД50 | 4,2 мг/кг (мыши, перорально) | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
N,N-Диметилформамид (Диметилформамид, ДМФА, DMF) — органическое соединение с формулой (CH3)2NC(O)H. Бесцветная довольно вязкая жидкость со слабым специфическим «рыбным» запахом из-за наличия продукта разложения — диметиламина. В чистом виде запаха практически не имеет.
Структура и свойства
[править | править код]Благодаря наличию двух резонансных форм в диметилформамиде порядок связи С=O уменьшен, а С-N увеличен. Так в инфракрасном спектре наблюдается понижение частоты карбонильной группы (1675 см−1) по сравнению с таковой для свободной. Также благодаря частично двойному характеру связи азот-углерод, при комнатной температуре заторможено вращение вокруг неё в шкале времени ПМР. При этом наблюдается два сигнала (синглеты) метильной группы интенсивностью 3 протона δ 2.97 и 2.88, вместо одного синглета 6 протонов.

ДМФА смешивается с большинством органических растворителей за исключением углеводородов. Часто используемый растворитель для проведения химических реакций и очистки веществ перекристаллизацией благодаря высокой растворяющей способности как для органических соединений, так и для некоторых неорганических солей. ДМФА является полярным апротонным растворителем с высокой точкой кипения. Он способствует прохождению реакций с полярным механизмом, таких как SN2 реакций. Неустойчив к действию сильных кислот и оснований, что приводит к гидролизу, особенно при высоких температурах. Диэлектрическая проницаемость равна 36,71.
Получение
[править | править код]- по реакции между диметиламином и угарным газом в метаноле (100—150 °C, 2,5-20 МПа) в присутствии метилата натрия или карбонилов металлов:
- реакцией метилформиата с диметиламином (80-120 °C и 0,1-0,4 МПа):
- реакцией муравьиной кислоты с диметиламином:
Очистка
[править | править код]Диметилформамид-сырец, содержащий незначительные количества влаги, диметиламина, формиата диметиламмония и монометилформамида, очищают вакуумной ректификацией. Примеси воды и муравьиной кислоты удаляются также перемешиванием или встряхиванием с гидроксидом калия и последующей перегонкой над BaO или CaO.
Применение
[править | править код]- как растворитель при производстве полиакрилонитрильного волокна (нитрона), и других полимеров
- для растворения красителей при крашении кожи, бумаги, древесины, вискозы и др.
- для абсорбции HCl, SO2 и других кислотных газов
- наряду с ацетонитрилом, является часто употребляемым растворителем в спектроскопии ЭПР
- как растворитель при реставрации художественных произведений изобразительного искусства, как выполненных в технике темперной, так и масляной живописи.
- для получения альдегидов по Вильсмаеру:

и Буво:

- для проведения спектроскопических исследований в ближней инфракрасной области
- в кислотно-основном титровании слабых кислот в неводных средах (в качестве среды)
- в составе ИПП-8 для оказания первой помощи при поражении капельножидкими отравляющими веществами
Безопасность
[править | править код]Реакция с использованием гидрида натрия в ДМФА отчасти опасна. Сообщалось об экзотермическом разложении выше 26 °C. В лабораторных условиях данная проблема решается использованием бань со льдом. В опытных производствах сообщалось о нескольких инцидентах при использовании данных реагентов.
Токсичность
[править | править код]Обладает довольно сильным раздражающим действием на слизистые оболочки и кожные покровы. Проникая в организм, проявляет резорбтивное действие: повреждает печень и почки. Центральную нервную систему угнетает слабо. Отравления возможны в результате приёма вещества внутрь и его всасывания с поверхности кожи. Примерная смертельная доза 10 г. ДМФА раздражает кожу и слизистые оболочки, проникает через неповреждённую кожу, проявляет общетоксическое и эмбриотоксическое воздействие на организм.
При острой и хронической интоксикации повреждаются ЦНС, сердечно-сосудистая система, печень, почки, происходят изменения крови[2]
Предполагается, что ДМФА является канцерогеном, также ему приписывают появление врождённых патологий. Для проведения многих реакций он может быть заменён диметилсульфоксидом. Раздражает слизистые оболочки глаз. ПДК в воздухе рабочей зоны N,N-диметилформамида — 10 мг/м³.
Примечания
[править | править код]- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Одошашвили, Д. Г. К вопросу о гигиенической оценке загрязнения диметилформамидом атмосферного воздуха // Предельно допустимые концентрации атмосферных загрязнений : ежегодник / Ред.: Рязанов В. А. — М. : Государственное издательство медицинской литературы, 1963. — Вып. 7. — С. 52–65. — 127 с. — 2000 экз.
Литература
[править | править код]- Якушкин, М. И. Справочник нефтехимика / М. И. Якушкин, В. И. Котов. — Л., 1978. — Т. 2. — С. 295—297.
- Гордон, А. Спутник химика / А. Гордон, Р. Форд. — М. : Мир, 1976. — 544 с.
- Новый справочник химика и технолога : Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Гл. ред. А. В. Москвин. — СПб. : АНО НПО «Профессионал», 2004. — 1142 с.


 French
French Deutsch
Deutsch