Хлораль — Википедия
| Хлораль | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | 2,2,2-трихлорэтаналь |
| Традиционные названия | Хлораль |
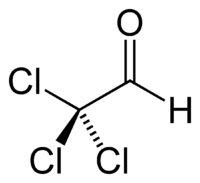
| Хим. формула | C2HCl3O |
| Рац. формула | CCl3CHO |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 147,388 г/моль |
| Плотность | 1,512 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | −57,5 °C |
| • кипения | 97,75 °C |
| Удельная теплота испарения | 240,6 Дж/кг |
| Давление пара | 0,13 (-30 °С), 4,25 (20 °С), 108 (100 °С) кПа |
| Оптические свойства | |
| Показатель преломления | 1,4557 |
| Классификация | |
| Рег. номер CAS | 75-87-6 |
| PubChem | 6407 |
| Рег. номер EINECS | 200-911-5 |
| SMILES | |
| InChI | |
| ChEBI | 48814 |
| ChemSpider | 13863645 |
| Безопасность | |
| ЛД50 | 480 мг/кг (крысы, перорально) |
| Токсичность | умеренно-токсичен |
| Пиктограммы ECB | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлораль (трихлорацетальдегид, трихлоруксусный альдегид) — органическое соединение, принадлежащее к классу альдегидов, соответствующее трихлоруксусной кислоте; бесцветная жидкость со специфическим резким запахом, растворим в органических растворителях и нерастворим в воде. Впервые получен в 1832 г. Юстусом Либихом при хлорировании этанола[1][2].
Реакционная способность
[править | править код]Альдегидная группа хлораля активирована за счёт отрицательного индуктивного эффекта трихлорметильной группы, поэтому карбонильный атом углерода является активным электрофильным центром. Хлораль вступает в реакции нуклеофильного присоединения образуя, в отличие от алифатических альдегидов, реагирующих с отщеплением воды, стабильные и хорошо кристаллизующиеся аддукты:
Так, хлораль реагирует с водой с образованием стабильного, в отличие от ацетальдегида, гидратного аддукта — хлоральгидрата:
и со спиртами с образованием полуацеталей — хлоральалкоголятов:
Так, этилполуацеталь хлоральгидрата образуется при взаимодействии хлораля, образующегося in situ при хлорировании этанола, с избытком этанола в промышленном производстве хлораля. С аммиаком хлораль образует стабильный хлоральаммиак:
Реакция с алифатическими аминами при нагревании идёт по типу галоформного расщепления, при этом образуются соответствующий формамид и хлороформ, реакция может использоваться как метод формилирования первичных и вторичных алифатических аминов[3]:
- CCl3CHO + HNR2 R2NCHO + CHCl3
Вследствие высокой электрофильности карбонильного углерода хлораль реагирует на только с аминами, но и с амидами:
Хлораль также образует аддукты c фосфорными нуклеофилами, так, он реагирует с трифенилфосфином с образованием фосфониевой соли:
- CCl3CHO + PPh3 Ph3P+-OCH=CCl2 • Cl-
Аналогично хлораль взаимодействует с триалкилфосфитами, образуя винилфосфаты (реакция Перкова):
- CCl3CHO + P(OR)3 (RO)2P(O)-OCH=CCl2 + RCl
С гидрофосфорильными соединениями хлораль образует аддукты нуклеофильного присоединения по карбонильной группы (реакция Абрамова) в реакцию вступают оксиды вторичных фосфинов:
- CCl3CHO + R2PH R2P(O)CH(OH)CCl3
диалкилфосфиты и т. п., взаимодействие диметилфосфита и хлораля является промышленным методом синтеза инсектицида хлорофоса:
При 100 °C хлораль гидролизуется водой с образованием глиоксиловой кислоты:
Под действием щелочей хлораль (подобно другим трихлорметилкарбонильным соединениям) претерпевает галоформное расщепление с образованием хлороформа и формиата:
Хлораль в жёстких условиях (температуры выше 100 °C или при облучении ультрафиолетом) хлорируется, образуя четырёххлористый углерод, окись углерода и хлороводород, окисляется концентрированной азотной кислотой до трихлоруксусной кислоты и восстанавливается (например, этилатом алюминия[4]) до трихлорэтанола:
Синтез
[править | править код]Исторически первым методом синтеза хлораля было хлорирование этанола:
этот метод, благодаря доступности и дешевизне реагентов, остаётся основным лабораторным и промышленным методом синтеза.
Хлораль также может быть синтезирован хлорированием этиленхлоргидрина, ацетальдегида или смеси диэтилового эфира с водой при 25-90 °С, а также каталитическим синтезом из четырёххлористого углерода и формальдегида при пропускании их паров над тонко раздробленными металлами (Сu) при 300 °С.
В промышленности хлораль синтезируют хлорированием этилового спирта. Технологически непрерывный процесс хлорирования проводится в каскаде из двух реакторов — барботажных колонн с противотоком газа и жидкости. В первую колонну, охлаждаемую до 55—65 °C, подаются этанол и смесь хлора с хлороводородом, поступающая из второй колонны. Реакционная смесь из первой колонны, содержащая смесь хлорацетальдегидов, их ацеталей и полуацеталей, подаётся во вторую колонну, работающую при 90 °C, куда также подают хлор и воду, необходимую для гидролиза промежуточных продуктов хлорирования — этилацеталей для увеличения степени конверсии этанола.
Продукт, получаемый во второй колонне и представляющий собой смесь хлоральгидрата, полуацеталей хлораля и дихлорацетальдегида с примесью HCl, обрабатывают концентрированной серной кислотой, разрушающей хлоральгидрат и ацетали с высвобождением свободного хлораля и дихлорацетальдегида, органический слой отделяют, перегоняют и ректифицируют, возвращая дихлорацетальдегид на хлорирование[5].
Применение
[править | править код]
Хлораль используют в производстве инсектицидов, в частности в производстве ДДТ конденсацией с хлорбензолом, хлорофоса конденсацией с диметилфосфитом и, далее, дихлофоса дегидрохлорированием хлорофоса.
Хлоральгидрат обладает снотворным и седативным действием и входит в список препаратов Всемирной организации здравоохранения, использующихся при анестезии[6].
См. также
[править | править код]Примечания
[править | править код]- ↑ Liebig, Justus. Ueber die Zersetzung des Alkohols durch Chlor (нем.) // Annalen der Pharmacie[англ.] : magazin. — 1832. — Bd. 1, Nr. 1. — S. 31—32. — ISSN 03655490. — doi:10.1002/jlac.18320010109. Архивировано 4 декабря 2015 года.
- ↑ Liebig, Justus. Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildendes Gas und Essiggeist entstehen (нем.) // Annalen der Pharmacie[англ.] : magazin. — 1832. — Bd. 1, Nr. 2. — S. 182—230. — ISSN 03655490. — doi:10.1002/jlac.18320010203. Архивировано 10 августа 2014 года.
- ↑ Blicke, F. F.; Lu, Chi-Jung. Formylation of Amines with Chloral and Reduction of the N-Formyl Derivatives with Lithium Aluminum Hydride (англ.) // Journal of the American Chemical Society[англ.] : journal. — 1952. — Vol. 74, no. 15. — P. 3933—3934. — ISSN 0002-7863. — doi:10.1021/ja01135a503.
- ↑ Organic Syntheses, Vol. 15, p. 80 (1935); Coll. Vol. 2, p.598 (1943). Дата обращения: 17 августа 2010. Архивировано 9 марта 2012 года.
- ↑ Дьячкова Т. П., Орехов В. С., Субочева М. Ю., Воякина Н. В. Химическая технология органических веществ: Учебное пособие. — Тамбов: Издательство ТГТУ, 2007
- ↑ Chloral hydrate // WHO Model Prescribing Information: Drugs Used in Anaesthesia. Дата обращения: 19 августа 2010. Архивировано 6 ноября 2011 года.


 French
French Deutsch
Deutsch











