Amorf struktur – Wikipedia
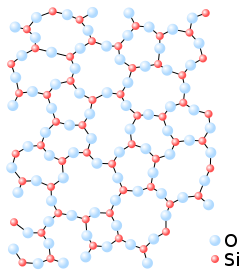
Amorf struktur beskriver ämnen som saknar en ordnad position hos ämnets atomer.[1] I naturvetenskapen används ordet om fasta ämnen (organiska eller oorganiska) som saknar fjärrordning, i motsats till kristallina material som har fjärrordning. Den lokala omgivningen kan däremot vara ordnad och liknar ofta den kristallina motsvarigheten, ett exempel på detta är kvartsglas där kiselatomen alltid omges av fyra syreatomer och syreatomen alltid av två kiselatomer precis som i kristallin kvarts.
Ett exempel på ett amorft ämne är förkolnat trä, träkol, vilket uppstår när man värmer upp cellulosa, till exempel träbitar, utan syre.[2]
Karakteristiskt för amorfa ämnen är att de saknar en bestämd smältpunkt. Vid uppvärmning blir ett ämne som glas mjukare inom ett smältintervall kring glastemperaturen för att övergå i flytande tillstånd.[3] Uppvärmning kan också orsaka en kristallisering av det amorfa materialet.
Amorfa läkemedel
[redigera | redigera wikitext]I läkemedel där det aktiva ämnet föreligger i fast form (t.ex. i tabletter) är det i allmänhet kristallint. Kristallin form har ofta flera fördelar framför ett amorf form. För det första är formen väldefinierat med avseende på smältpunkt, röntgenkristallografiskt mönster, IR-spektra med flera för fasta ämnen karakteristiska egenskaper. Kristallint material har vidare ofta goda egenskaper för att komprimeras till tabletter och till sist är stabiliten ofta god om man har valt en stabil kristallform.
Det finns dock vissa situationer där det kan vara en fördel att välja en amorf form. Om enläkemedelssubstans är mycket svårlöslig i kristallin form, så kan lösligheten vara bättre hos ett amorft material. Kristallisation ger en struktur med starkare bindningar mellan de ingående molekylerna jämför med strukturen i ett oordnat amorft material. Det betyder att det åtgår mindre energi att bryta det amorfa materialets bindningar när det ska gå i lösning, och därigenom ökar lösligheten. För vissa läkemedelssubstanser kan detta vara avgörande för att det ska kunna gå att göra ett läkemedel som kan tas oralt. Det som kan vara problem med ett läkemedel med en sådan amorf substans är att man måste hindra att den amorfa substansen helt eller delvis kristalliserar under läkemedlets hållbarhetstid eftersom det kan medföra att effekten uteblir för patienten. Ett sätt att undvika det kan vara att blanda läkemedelssubstansen med t.ex. en polymer när den amorfa formen framställs. Då minskar risken betydligt för kristallisation.
Inom diabetesbehandlingen har amorft zinkinsulin länge använts i blandning med kristallint zinkinsulin för att skräddarsy hur länge insulineffekten ska sitta i efter en injektion av en suspension av zinkinsulin. Det amorfa insulinet löses snabbare upp än det kristallina och genom att variera proportionerna kan man styra egenskaperna.
Amorf metall
[redigera | redigera wikitext]
Materialet hos amorf metall saknar en ordnad atomär struktur, vilket är i motsats till de flesta metaller som vanligtvis har kristallin struktur. Metaller med amorf struktur uppkommer när metall snabbt övergår från flytande till fast form, vanligtvis genom snabb nedkylning.
Länge ansågs det som nära på omöjligt att skapa amorf struktur i metaller, där gallium var den metall man kommit närmast att lyckas med.[4] Den huvudsakliga utvecklingen av dessa material började komma först på 60-talet,[5] och nu (2020) finns det många metallglas med applikationsområden som ferromagetiska kärnor och ytbeläggningar med goda mekaniska egenskaper.[6] År 2012 lyckades man ta fram amorf struktur i järnbaserat material i en studie på Mittuniversitetet.[7]
Andra benämningar på amorf metall är även metallglas eller glasmetall.[8] Amorfa metaller är metastabila.[9] Det är alltså inte det energetiskt mest fördelaktiga tillståndet, så vid värmebehandling kan metallglas övergå till en kristallin struktur.
Ordet amorf kommer från grekiskan amorphos som betyder 'oformlig' eller 'formlös', strukturlös.
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]- ^ ”amorf”. Rikstermbanken. Arkiverad från originalet den 10 september 2016. https://web.archive.org/web/20160910232120/http://www.rikstermbanken.se/rtb/visaTermpost.html?id=60480.
- ^ ”Kol”. Svensk Uppslagsbok. Arkiverad från originalet den 8 februari 2011. https://web.archive.org/web/20110208061058/http://svenskuppslagsbok.se/tag/trakol/.
- ^ ”The Science and Engineering of Materials Kap 15-16”. Linköpings Universitet. http://www.iei.liu.se/trateknik/utbildning/tcm005/internwebb-for-tcm005/kursmaterial/1.179156/TCM005_F_Malmstenplastxhandouts.pdf.[död länk]
- ^ ”Fasta tillståndets fysik”. University of Helsinki. 16 februari 2003. Arkiverad från originalet den 1 juli 2007. https://web.archive.org/web/20070701122748/http://beam.acclab.helsinki.fi/~knordlun/ftf/ftf1.pdf.
- ^ Michael Miller, Peter Liaw, red (2008). Bulk Metallic Glasses. doi:. http://dx.doi.org/10.1007/978-0-387-48921-6. Läst 20 oktober 2020.
- ^ ”Bulk Glassy Alloys: Historical Development and Current Research” (på engelska). Engineering 1 (2): sid. 185–191. 2015-06-01. doi:. ISSN 2095-8099. https://www.sciencedirect.com/science/article/pii/S2095809916300649. Läst 20 oktober 2020.
- ^ ”Tillverkning av amorf metall”. Mittuniversitetet Sverige. 16 februari 2012. Arkiverad från originalet den 29 oktober 2015. https://web.archive.org/web/20151029120704/http://wpress.miun.se/jubileum/genombrott-tillverkning-av-amorf-metall/.
- ^ ”Metallglas”. Nationalencyklopedin. 16 februari 2010. http://www.ne.se/metallglas.
- ^ Greer, A. L. (2014-01-01). David E. Laughlin, Kazuhiro Hono. red (på engelska). Physical Metallurgy (Fifth Edition). Elsevier. sid. 305–385. doi:. ISBN 978-0-444-53770-6. http://www.sciencedirect.com/science/article/pii/B9780444537706000046. Läst 20 oktober 2020


 French
French Deutsch
Deutsch