Svavelsyrlighet – Wikipedia
| Svavelsyrlighet | |
 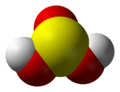 | |
| Systematiskt namn | Svavelsyrlighet |
|---|---|
| Kemisk formel | H2SO3 |
| Molmassa | 82,07 g/mol |
| Utseende | Färglös vattenlösning med lukt av svaveldioxid |
| CAS-nummer | 7782-99-2 |
| SMILES | OS(=O)O |
| Egenskaper | |
| Densitet | 1,03 g/cm³ |
| Löslighet (vatten) | Blandbar |
| Faror | |
| Huvudfara | |
| SI-enheter & STP används om ej annat angivits | |
Svavelsyrlighet är en kemisk förening med summaformeln H2SO3. Det finns inget bevis för att ämnet existerar i vattenlösning, men molekylen har påvisats i gasform.
Egenskaper
[redigera | redigera wikitext]Vid vanligt tryck och temperatur är svavelsyrlighet en färglös gas, som har den bekanta stickande lukten som bränt svavel utvecklar. Den har en obehaglig och mycket kvardröjande smak och inverkar kraftigt på andningsorganen. Ämnet kan orsaka andnöd vid inandning, och astmatiker bör undvika kontakt med det.
Genom avkylning till något under fryspunkten eller genom användning av ett tryck på 200 – 400 kPa vid vanlig temperatur kan svavelsyrligheten kondenseras till en lättflytande, färglös vätska, som vid vanligt tryck kokar vid – 10 °C, och som vid avdunstning i vakuum stelnar till en vit kristallinsk massa, som smälter vid – 75, 2 °C.
Svavelsyrlighet utmärker sig i kemiskt avseende genom att den har förmåga att ta upp syre från andra ämnen, varigenom den verkar som ett kraftigt reduktionsmedel.
Framställning
[redigera | redigera wikitext]Teknisk framställning av svavelsyrlighet kan ske genom förbränning av svavel med sulfider såsom svavelkis, kopparkis och zinkblände. [1]
Salter av svavelsyrlighet kallas för sulfiter.
Användning
[redigera | redigera wikitext]Svavelsyrlighet används bland annat som ett mildare blekmedel än klor, genom att den kan ta bort syre från färgämnena och omvandla dem till färglösa föreningar.
Förutom användning som blekmedel kan svavelsyrlighet även komma till användning som desinfektionsmedel.
Svavelsyra och svavelsyrlighet
[redigera | redigera wikitext]Skillnaden mellan svavelsyrlighet och svavelsyra, H2SO4, är att svavelatomen har ett lägre oxidationstal (+4) i svavelsyrlighet än i svavelsyra (+6). Svavelsyrlighet är en svagare syra än svavelsyra.
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Sulfurous acid, 27 augusti 2010.


 French
French Deutsch
Deutsch