Гліцерин — Вікіпедія
| Гліцерин | |
|---|---|
 | |
 | |
 | |
| Систематична назва | пропан-1,2,3-тріол |
| Інші назви | Гліцерол |
| Ідентифікатори | |
| Номер CAS | 56-81-5 |
| PubChem | 753 |
| Номер EINECS | 200-289-5 |
| DrugBank | DB04077 |
| KEGG | D00028 і C00116 |
| Назва MeSH | D02.033.800.875.500 і D09.853.875.500 |
| ChEBI | 17522 |
| RTECS | MA8050000 |
| Код ATC | A06AX01 і A06AG04 |
| SMILES | C(C(CO)O)O |
| InChI | InChI=1S/C3H8O3/c4-1-3(6)2-5/h3-6H,1-2H2 |
| Номер Бельштейна | 635685 |
| Номер Гмеліна | 26279 |
| Властивості | |
| Молекулярна формула | C3H8O3 |
| Молярна маса | 92,09 г/моль |
| Зовнішній вигляд | безбарвна рідина гігроскопічна |
| Густина | 1,261 г/см3 |
| Тпл | 17,8 °C |
| Ткип | 290 °C[1] |
| Кислотність (pKa) | ~14 [2] |
| Небезпеки | |
| MSDS | JT Baker |
| NFPA 704 | |
| Температура спалаху | 160 °C (в закритій посудині) 176 °C (у відкритій посудині) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
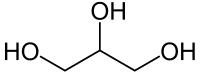
Гліцери́н (гліцеро́л) — триатомний спирт. Це означає, що в молекулі цього спирту три гідроксильні групи приєднані до трьох атомів вуглецю. Хімічна формула — C3H8O3, або C3H5(OH)3.
Гліцерин відкрив у 1783 році шведський хімік Карл Вільгельм Шеєле, який показав, що фрагменти цієї сполуки складають основу всіх природних жирів, і назвав його «солодкою речовиною із жиру», позаяк продукт має солодкий смак. Шеєлє кип'ятив оливкову олію з окисом свинцю (свинцевий гліт).[3] Визначити точний склад і будову цих фрагментів Вільгельм Шеєле не зміг — органічна хімія лише починала розвиватися.
У 1813 (1823) році французький хімік Мішель Ежен Шеврель встановив, що під дією води (каталізатори: кислота і луг) відбувається розщеплення жирів з утворенням гліцерину і вищих карбонових кислот. Він уперше дав назву «гліцерин» одному з продуктів, який утворюється в даному процесі («гліцерос» — солодкий). Французові Т. Петлузові в 1836 році вдалося встановити елементний склад цього тріолу.
Синтез гліцерину вперше провів у 1873 році французький хімік і мінеролог Ш. Фрідель.
Чистий гліцерин являє собою прозору, безбарвну, дуже густу, в'язку, сиропоподібну, без запаху, важчу за воду і неотруйну солодкувату на смак рідину.
Гліцерин має здатність поглинати вологу з повітря та утримувати її. На повітрі може увібрати до 40% води від своєї маси. Таку властивість речовини називають гігроскопічністю.[4] Через це гліцеринова крапля на руці дає враження легкого нагріву.
Питома вага хімічно чистого гліцерину при 15 °С становить 1,26469.
Молекулярна маса 92,09 г/моль.
При звичайному атмосферному тиску гліцерин кипить при 290 °C і частково розкладається; під розрідженим тиском його можна перегнати, не розклавши.[4] Змішується з водою в будь-якій пропорції. Як і при утворенні спирто-водних розчинів, при змішуванні гліцерину і води сумарний об'єм стає меншим, ніж об'єм вихідних компонентів.[3] Температура спалаху гліцерину становить 150 °C, температура самозаймання — 362 °C. Як і винний спирт він горить не яскравим синім полум'ям.[3] При нагріванні гліцерин швидко випаровується, а у звичайних умовах — гліцерин не леткий.
Гліцерин має здатність розчиняти різні мінеральні солі, через що чистий гліцерин добувається головним чином шляхом перегонки.[4]
Від сильного і тривалого охолодження гліцерин кристалізується; температура плавлення кристалів — 20 °C. Гліцерин може залишатись рідким і при температурі нижче 0 °C — подібним чином себе поводять його водні розчини, наприклад, розчин, в якому на дві вагові частини гліцерину припадає одна частина води, замерзає при температурі -46,5 °C.[3] Гліцерин вповільнює утворення кристалів льоду.
Густина 1,261 г/см³ при 20 °C. Показник заломлення nD=1,4735 при 20 °C. Діелектрична проникність ε=42,5 при 25 °C. Дипольний момент молекули в газовому стані μ=2,56 Дб. В'язкість 9450 мПз[5].
Синтетичним шляхом гліцерин отримують з пропену[3]:

Взаємодією жиру із лугом можна отримати гліцерол і сіль вищої карбонової кислоти — реакція омилення жирів.
Похідні гліцерину завжди є в організмах вищих тварин і людини. Ці жири — складні ефіри гліцерину і органічних кислот (пальмітинової, стеаринової і олеїнової) — найенергоємніші речовини організму. Енергетична цінність гліцеридів у два з гаком рази більша, ніж у вуглеводів.
Гліцерин високого ступеня чистоти (не менше 98%) отримують шляхом алкоголізу рослинних жирів, із застосуванням вакуум-ректифікації. При остаточному тиску 400 Па при температурі кипіння 130-140 °C вдається уникнути полімеризації і термічного розкладання гліцерину з отриманням дистильованого продукту.
До розробки синтетичних методів гліцерин отримували лужним омиленням жирів. При цьому утворюються мила з водним розчином гліцерину. Мило відокремлюють шляхом висолювання за допомогою хлориду натрію, а гліцерин отримують шляхом повторного згущення і кристалізації осадженого хлориду натрію. Отриманий 80% гліцерин темного кольору очищується перегонкою і обробкою активованим вугіллям.
Існує ферментативний метод отримання гліцерину. Гліцерин присутній в натуральних винах, але у долях відсотка.[3] Близько трьох відсотків цукру, який міститься у винограді, у кінцевому результаті перетворюються в гліцерин.[3] В процесі дозрівання вина гліцерин частково перетворюється в інші органічні продукти.
Інший метод оснований на гідролітичному розщепленні вуглеводів (крохмалю, деревного борошна і цукру, особливо тростинного), призводить до утворення суміші гліцерину з іншими гліколями.
Також гліцерин утворюється при виробництві біодизеля.
З водою гліцерин змішується в усіх пропорціях, причому об'єм такого розчину буде трохи менший від суми первинних об'ємів води й гліцерину. В усіх пропорціях змішується з етанолом. Не розчиняється в жирах, олії, бензині, хлороформі.[4]
Наявність гідроксильних груп зумовлює подібність гліцерину до одноатомних спиртів, він вступає в ті самі реакції, але за участю трьох гідроксильних груп.
Реакції повного окиснення (горіння) відбувається, як і в інших органічних речовин, з утворенням вуглекислого газу і води.
Гліцерин вступає в реакцію заміщення з металічним натрієм, яка супроводжується виділенням водню.
Реакція з гідроксидами металів. На відміну від одноатомних спиртів, багатоатомні взаємодіють із гідроксидами лужних і металічних елементів.
- Горіння:
- Взаємодія з металічним натрієм:
- З нерозчинними основами:
У промисловості його отримують головним чином при гідролітичному розщепленні жирів. Гліцерин випускають трьох видів — сирий, дистильований та технічно чистий. В косметиці дозволено застосування двох останніх. Гліцерин гігроскопічний. Завдяки властивості поглинати з повітря до 40—50 % води по відношенню до його початкової маси, він отримав широке розповсюдження в косметиці, як речовина, що швидко відбирає воду з тваринної та рослинної тканини. Він застосовується майже у всіх косметичних препаратах як пом'якшуючий засіб та є одним з основних видів сировини для виготовлення зубних паст. Він не засихає, не гіркне, замерзає при дуже низьких температурах і тому застосовується як речовина, що перешкоджає висиханню та замерзанню косметичних виробів.
Гліцерин використовується в парфумерії та фармації як пом'якшувальний засіб або основа мазей, добавка до масла, у харчовій промисловості — як добавка до напоїв (особливо, алкогольних). Наприклад, добавку гліцерину передбачає класична технологія приготування хорошого портвейну.[3] Спиртовий розчин тринітрогліцерину має судинорозширювальну дію й у вигляді ліків використовується при серцевих захворюваннях. Похідним гліцерину є гліцерофосфат (гліцерофосфат кальцію і гліцерофосфат натрію), який використовують в медичній практиці. Із гліцерину синтетичним шляхом отримують незамінну амінокислоту метіонін, котру в медичній практиці застосовують при захворюваннях печінки і атеросклерозі.[3]
Гліцерин, його олігомери і полімери запропоновані як засоби, які зберігають свіжість харчових продуктів.
У шкіряному виробництві та текстильній промисловості — для обробки пряжі і шкіри з метою їх пом'якшення та надання еластичності. Гліцерин застосовується в тютюновій промисловості, при виробництві поліуретанів, гуми, фанери, барвників, чорнил і паст, зубної пасти, емульгаторів, фотографічних і інших матеріалів. Гліфталеві смоли — продукти реакції гліцерину з фталевою кислотою, — будучи розчинені в спирті, перетворюються в хороший, хоча і дещо крихкий, електроізоляційний лак.[3] Гліцерин необхідний для виробництва епоксидних смол — з гліцерину отримують епіхлоргідрин — незамінну речовину для синтезу епоксидної смоли.[3]
З гліцерину добувають вибухову речовину тринітрогліцерин, що використовується для виготовлення динаміту. Роль гліцерину при виробництві пороху другорядна, але гліцерин є незамінною сировиною для отримання нітрогліцерину, а значить і балістичного пороху і динаміту.
Гліцерин як кормова добавка підвищує надої молока.[6]
Гліцерин разом з пропіленгліколем формують основу рідини для паління в електронних сигаретах.
- ↑ Lide, D. R., Ed. CRC Handbook of Data on Organic Compounds, 3rd ed.; CRC Press: Boca Raton, FL, 1994; p 4386.(англ.)
- ↑ Ластухін Ю. О., Воронов С. А. Органічна хімія : підручник. — Вид. 3-тє, стереотипне. — Львів : Центр Європи, 2006. — С. 337. — ISBN 966-7022-19-6.(укр.)
- ↑ а б в г д е ж и к л м Станцо В.В. Спирт, не похожий на спирт / «Химия и Жизнь» Ежемесячный научно-популярный журнал Академии наук СССР. — №3, март 1977 (с.: 19-21)
- ↑ а б в г В.М.Поліщук Тваринні та рослинні жири як сировина для виробництва біодизеля (узагальнення досвіду) Науковий вісник Національного університету біоресурсів і природокористування України Збірник наукових праць [Архівовано 1 грудня 2012 у Wayback Machine.]. - 2010, Вип.144.
- ↑ Фізичні константи наведено за виданням: А. Гордон, Р. Форд. Спутник химика. Физико-химические свойства, методики, библиография. Москва: Мир, 1976, с.20-21(рос.)
- ↑ Друкований М. Ф., Яремчук О. С.,Мазур І. В. Розвиток комплексу біотехнологій — головний шлях розвитку аграрного сектора України[недоступне посилання з травня 2019] // Наукові праці Інституту біоенергетичних культур і цукрових буряків. Збірник наукових праць [Архівовано 13 грудня 2013 у Wayback Machine.]. — 2011, № 12[недоступне посилання з квітня 2019]
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — С. 78,79,82,95,100,102,117,123,133,138,139-141, 173-175,177,178,204,211,217,219,221,410,482. — 560 с. — ISBN 978-966-382-113-9.
| Це незавершена стаття про органічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |


 French
French Deutsch
Deutsch



